
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биологическое значение восстановления.Содержание книги
Поиск на нашем сайте
Амидирование тканевых белков. Присоединение аммиака к карбоксильным группам аспарагиновой, глютаниковой аминокислот и альфа-концевым карбоксильным группам.
Амидирование сопровождается изменением ф-х свойств: ионизация, структура т.е. белки «портятся» Синтез глютамина Это амидирование карбоксильной группы ГЛЮ.
Синтез глютамина представляет связывание аммиака. Это нетоксичная транспортная форма аммиака в организме в таком виде аммиак из тканей переносится в печени и почки и в таком же виде из печени глютамин может поступать в ткани где он служит источником азота для синтеза аминосахаров, пуриновых пиримидиновых нуклеотидов. Глютамины транспортируют аммиак в печени и почки одного из конечных продуктов – аммонийных солей. В почках очень активен фермент глютаминаза, который расщепляет глютамин на глютаминовую кислоту и аммиак.
В почках при выведении протонов, реабсорбции ионы Nа и К т. о. Глютаминаза участвует в регуляции кислотно-основного баланса. Активность глютаминазы зависит от Ph. При ацидозе. При ацидозе активность возрастает следовательно ацидоз уменьшается. У взрослых за сутки 0,5-1,2 аммонийных солей. На нее приходится 3,5% выводимого азота. У детей относительная доля аммонийных солей выше чем у взрослых. Синтез мочевины. Глютамин поступает в печень где под действием глютаминазы высвобождается аммиак, который превращается в мочевину. С изучением этого процесса связаны работы Кребса и М. В. Ненского. В синтезе мочевины участвует редкая кислота орнитин, поэтому синтез мочевины называют орнитиновый цикл.
Наиболее активно процесс проходит в печени.
Ключевыми ферментами являются карбомаил фосфатсинтетаза, ортинит-карбомаилсинтетаза и аргиназа. Источниками азота в мочевине являются аммиак и аспарагиновая кислота. Орнитиновый цикл тесно связан с циклом Кребса. Фумаровая кислота из орнитинового цикла уходит в цикл Кребса. ЦТК обеспечивает ОЦ АТФ. У здорового человека за сутки образуется 20-40 г мочевины на нее приходится до 90% выводимого азота.
БИЛЕТ 24 Это минорные вещества пищи, которые выполняют регуляторную роль в обмене веществ. Номенклатура витаминов Каждый витамин имеет три вида названий: 1. Буквы латинского алфавита 2. Название отражающее химическую природу витамина, например ретинол – спирт. 3. Название образующееся путем сочетания приставки анти + заболевание возникающее при отсутствии витамина. Например, антирахитический, антианемический. Классификация По растворимости делятся на: Ø Водорастворимые (С, В, Н, РР) Ø Жирорастворимые (А, Д, Е, К). Иногда выделяют витаминоподобные вещества, например инозит, пангамоновая кислота. Функции. Биологическая роль витаминов. 1. Коферментная (РР – противопрологрический) входит в состав НАД. В2 – ФАД. 2. Являются аллостерическими активаторами (регуляторами) многих ферментов. 3. Некоторые витамины входят в состав более сложных белков, например витамин А входит в состав родопсина. 4. Антирадикальная (оксидантная) функция. Витамины блокируют свободные радикалы в том числе и радикалы кислорода. Эта функция характерна для витаминов Е, А, С. Обмен витаминов Ø Всасывание. Для некоторых витаминов есть специальные белки-переносчики, в всасывании жирорастворимых витаминов принимают участие желчные кислоты. Ø Транспорт витаминов. Для жирорастворимых нужен белок-переносчик, для витамина А это ретинолсвязывающий белок. Ø В тканях витамины входят в состав коферментов. Ø Распад происходит в печени. Ø Продукты распада витаминов выводятся через почки. По их концентрации в моче судят об обмене витаминов в организме. В обмене витаминов возможны нарушения: авитаминоз – при отсутствии витаминов в пище и при нарушении их обмена. Гипервитаминоз – вследствие избыточного поступления в организм. Гиповитаминоз – при недостаточном поступлении или частичном нарушении обмена веществ. Различают экзогенные и эндогенные причины. Экзогенные лечатся путем назначения витаминных препаратов. К эндогенным относятся нарушения ЖКТ и нарушение всасывания, заболевания желчи и желчевыводящих путей, дисбактероизы, гельминтозы. Эндогенный авитаминоз лечат путем инъекций, минуя ЖКТ. В деском возрасте могут встречаться особые витаминрезистентные состояния, при которых нарушено включение коферментов. Эти состояния исправляют назначением готовых коферментных форм витаминов. Витамин А Ретинол, антисклерофтальмический. Препятствует сухости глаз. По природе – циклический ненасыщенный спирт. Распространен в продуктах животного происхождения: желток, сливочное масло, печень. Растительные продукты содержат провитамин каротин, морковь, красный перец. Суточная потребность до 5 мг. Биологическая роль: Ø участвует в синтезе зрительного пигмента родопсина. Ø Стимулирует рост и развитие эпителия костной, хрящевой ткани способствуя синтезу в них нуклеиновых кислот, сложных углеводов. Ø Активный антиоксидант является иноктиватором радикальной формы кислорода. Авитаминоз – нарушение сумеречного зрения (куриная слепота). Сухость роговицы глаза (ксерофтальмия) возникает в результате ороговевания эпителия слезной железы, происходит закупорка железы и прекращение слезоотделения. Страдают эпителиальные ткани дыхательных путей, мочевыводящих путей, дерматиты, нарушается репродуктивная функция. Возможен и гипервитаминоз. История развития учения о витаминах: В 1880 году Н.И. Лунин предположил существование каких-то веществ, без которых не может быть полноценного питания. В 1882 году Такаки, отметил что при добавлении в пищу свежих фруктов и овощей не развивается болезнь бери-бери. В 1896 году Эйкман отметил разницу между заболеваниями бери-бери (у кур) при питании полированном и очищенном рисом. В 1912 году Казимир Функ выделил из оболочки риса вещества, предохраняющие от заболеваемости бери-бери, и назвал его «витамин» (вита - жизнь, содержит - амин). Витамины – это органические минорные вещества пищи, которые выполняют регуляторную роль в обмене веществ. Витамины изучали: Эйкман, Функ (выделил первый витамин), Н.И. Лунин, К.А. Сосин и другие. Функции витаминов: №2 Гниение в кишечнике. ГНИЕНИЕ БЕЛКОВ В ТОНКОМ КИШЕЧНИКЕ Процессу гниения подвергаются не полностью расщепляющиеся белки и отдельные аминокислоты. Оно под действием ферментов гнилостной микрофлоры. При гниении образуется большое количество газообразного и негазообразного нередко токсичные веществ. К продуктам гниения относится: CO2, CH4, NH3, H2S, меркаптаны, альдегиды, кетоны, карболовые кислоты, диамины. Диамины образуются из аминокислот (лизин, орнитин). При их декарбоксилировании образуется:
Могут выводится из кишечника или обезвреживаться в печени, могут обезвреживать токсичные циклические продукты.
ОБЕЗВРЕЖИВАНИЕ В ПЕЧЕНИ ПРОДУКТОВ ГНИЕНИЯ БЕЛКОВ Выделяют:
Калиевая соль этой кислоты выводится через почки. Его количество в моче свидетельствует об антитоксической функции почек и усилении гнилостных процессов. Гиалуроновая кислота- активная форма это УДФ-глюкозовая кислота (урацил-рибоза-ф-ф-глюкуроновая кислота)
Глицин – бензойная кислота + глицерин→гиалуроновая кислота, используется для оценки антитоксической функции печени. Проба Квина – вводят бензойную кислоту. Антипириновая проба – аптипириновое вещество, которое в печени подвергается микросомальное окисление. Гнилостные процессы у детей отсутствуют. У взрослых усиление гнилостных процессов при снижении активности протеолитических ферментов желудка и кишечника при снижении моторики ЖКТ, дизбактериозах. №3 Взаимосвязь липидного и углеводного обмена. Обмены тесно связаны как в физиологических условиях, так и при паталогиях. Эта взаимосвязь возможна благодаря наличию общих метаболитов. Углеводы могут легко переходить в липиды:
Схема взаимодействия углеводного и липидного обмена.
Ацетоновые тела. К ним относятся:
В норме концентрация ацетоновых тел очень мала 0,6 ммоль/л. Ацетоновые тела синтезируются в печени из ацетил КоА через стадию ГМГ.
В физиологических условиях ацетоновые тела являются важным водорастворимым энергетическим материалом для клеток. Синтезировавшись в печени транспортируются в ткани, где активируются под действиями НSКоА или под действием сукцинил КоА. Ацетон + HSКоА→ацетонацил КоА. Ацетоновые тела используются как энергитический материал: ацетоацетил КоА→24АТФ (из цикла Кребса). Почти все ткани могут использовать ацетоновые тела, но при высокой концентрации ацетоновых тел развивается кетоацидоз. У детей выражена склонность к кетоацидозу т.к. у них ограничены запасы гликогена. Легче распадается ТАГ так как у них лабильна ТАГ-липаза. Активно протекает распад кетоген ацетоновых тел. Усвоение ацетоновых тел малоактивно. Инсулин – активирует синтез ТАГ из глюкозы т.е. активируется липогенез, активируя фермент ацитил КоА – карбоксилазу, он одновременно обладает антилиполитическим действием (тормозит липолиз). Большинство других гормонов угнетают липогенез в большей степени активирует липолиз. Адреналин и глюкагон – активируют ТАГ – липазу, а глюкокортикоиды индуцируют синтез ТАГ липазы.
БИЛЕТ_25 №1 Синтез и распад гликогена. Гликоген является депо (запасом глюкозы). Гликоген образуется в печени и других тканях:
Гексокиназа малоспецифична, катализирует эту реакцию и с другими гексозами (фруктозой, маннозой и т.д.)
(порция гликогена) а)при образовании a-1,4-глюкогидных n – не менее четырёх связей работает фермент; гликогенсинтаза б)при образовании a-1,6-гликозидных связей работает фермент; амило-1,4-1,6- гликозилтрансфераза. Ветвление цепи гликогена повышает его растворимость и, благодаря созданию большого количества не восстанавливающих концевых остатков, которые являются местами действия гликоген-синтазы, увеличивает скорость синтеза и расщепления гликогена. По мере необходимости гликоген может расщепляться (и в печени, и в других тканях). Различают два пути расщепления гликогена: Ø Амилолитический Таким путём расщепляются боковые цепи – это около 10% гликогена. В тканях есть a-амилазы (расщепляют срединные a-1,4-гликозидные связи) и a-амилазы (расщепляют концевые a-1,4- гликозидные связи). По сути, идёт гидролиз гликогена: Н2О Гликоген → Глюкоза Амилаза Полученную глюкозу, в какие бы процессы она потом ни вступала (синтез, распад), необходимо проактивизировать, т.е. получить фосфориокислый эфир глюкозы, т.е. фосфорилировать её: Глюкоза +АТФ → Глюкоза-6-Фосфат + АДФ Как видно из приведённой реакции, мы затрачиваем при этом одну молекулу АТФ. Ø Фосфоролитический (фосфоролиз): Этим путём расщепляется до 90 % гликогена. Процесс выглядит по – другому: 1. Гликоген + Н3РО3 → Глюкозо-1-фосфат фосфорилаза
2. Глюкозо-1-фосфат → Глюкозо-6-фосфат фосфоглюкомутаза
сер – ОН сер – О – РО3Н2 Этот процесс катализирует фермент: киназа фосфорилазы. (Активизирующее влияние на фосфорилазу «b» оказывает и АМФ Таким образом, ращепление гликогена и мышечное сокращение связаны преходящим увеличением содержания Са++ в цитоплазме. Фосфорилированию же киназы фосфорилазы способствует фермент протеинкиназа, которая активна лишь при присутствии в цитоплазме циклической формы АМФ. АМФ образуется в плазматической мембране из АТФ:
Аденилатциклаза (цАМФ) Аденилатциклаза - мембраносвязанный фермент. На его активность в значительной степени влияют специфические гормоны. Мы видим, что синтез и расщепление гликогена происходит разными путями. Главные ферменты синтеза и распада гликогена – это гликогенсинтеза и фосфорилаза. Синтез и расщепление гликогена координировано регулируются таким образом, что когда активируется гликогенсинтаза, то фосфорилаза остаётся почти неактивной и наоборот. На обмен гликогена большое влияние оказывают специфические гормоны: инсулин (вырабатывается в поджелудочной железе (b-клетки)-повышай способность печени и мышц синтезировать гликoген (интимный механизм инсулина пока выяснен не в достаточной степени),Значительно лучше изучен механизм действия адреналина и глюкогона. адреналин вырабатывается мозговым веществом надпочечников и вы-раженно стимулирует распад гликогена в мышцах и, в меньшей мере, в печени. Печень более чувствительна к гликогону, который вырабатывается a –клетками поджелудочной железы (при низком содержании глюкозы в крови).Эрл Сазерленд установил, что действие адреналина и глюкогена на обмен углеводов опосредуется циклическим АМФ. Адреналин и глюкогон не проникают в свои клетки-мишени, они связываются с плазматическими мембранами и стимулируют аденилатциклазу. Таким образом,получается следующая схема: Адреналин (глюкагон)
Аденилатциклаза
Протеинкиназа
Киназа фосфорилазы
«b» «а»
Глюкозо-6-фосфат Синтез гликогена тесно связан с его расщеплением. Активность гликоген-синтазы, подобно активности фосфорилазы, регулируется путем ковалентной модификации, т. е. фосфорилирования. В результате фосфорилирования гликоген-синтаза «а» (активная формула), превращается в неактивную форму-гликоген – синтазу «в».Фосфорилированная форма –гликоген-синтаза «в» требует для своей активности больших количеств глюкозо-6-фосфата.,тогда как дефосфорилированная «а» –форма активна и в присутствии и в отсутствии глюкозо-6-ффосфата. Таким образом,фосфорилирование оказывает противоположно направленное действие на активности гликоген-синтазы и гликоген-фосфорилазы. Так как фосфорилирование гликоген-синтазы «а» осущест-вляется протеинкиназой,то,когда протеин-киназа активна (см. схему, то-есть под действием адреналина и глюкогона), то она стимулирует выработку активной фосфорилазы «а» (через стАДНю киназы фосфорилазы) и неактивной гликоген-синтазы «в». Т. е. при повышенном распаде гликогена тормозится его синтез и наоборот
СО2+ Н2О Глюкоза №2 Кальций-фосфорный обмен Са – общее содержание 2% от массы тела (≈1,5 кг). 99% в костях, 1% внеклеточный. Содержание Са в плазме 2,3-2,8 ммоль/л, 50% этого Са ионизированы (соли), а другие 50% связаны с белками. Функции Са: Ø Пластический материал Ø Участвует в мышечном сокращении Ø Участвует в свертывании крови Ø Регулятор активности многих ферментов (выполняет роль вторичного посредника) Суточная потребность: 1,5 г. Всасывание Са в ЖКТ лимитировано. Всасывается примерно 50% Са пищевых продуктов при участии кальций-связывающего белка. Будучи внеклеточных катионом посупает в клетки через Са-каналы, депонируется в клетках в ЭПС и митохондриях. Р – 1% от массы тела (≈700 г). 90% в костях, 10% внутриклеточный фосфор. В крови 1-2 ммоль/л Роль Р: Ø Пластическая функция Ø Входит в состав макроэргов (АТФ) Ø Компонент нуклеиновых кислот, липопротеидов, нуклеатизов, солей Ø Входит в состав фосфатного буфера – регуляция рН Ø Регулятиор активности многих ферментов (фосфолирирование, дефосфолирирования) Суточная потербность: 1,5 г В ЖКТ всасывается при участии щелочной фосфатазы. Выводятся Са и Р в основном через почки незначительно через кишечник. Регуляция Са-Р обмена. Паратгормоном – этот гормон повышает уровень Са в крови и снижет уровень фосфора, повышение Са связано с активацией остеокластов→активацией в них фосфатазы, коллагеназы в результате чего при обновлении костной ткани происходит «вымывание» Са в кровь. Кроме того ↑ всасывание Са в ЖКТ и ↓ его выведения в почках. Фосфаты усиленно выводятся через почки. Кальцитонин – снижает уровень Са и Р в крови. Уменьшает активность остеокластов и тем самым уменьшает выделение Са из костной ткани. Витамин D (холи-кальци-ферол) – антирахитический витамин. Содержится в жирах, суточная потребность 25 мкг, синтезируется из предшественника 7-дегидрохолестерина, который в комплексе с белком поступает в печень где окисляется в 25 полодении→ 25 гидрокиси-холестерин этот предшественник транспортируется в почки где окисляется в первом положении→витамин D3→поступает в ткани→взаимодействует с рецепторами→активируется синтез белков опосредующих эффекты витамина. Нарушение Са-Р обмена. Рахит – проявляется нарушением минерализации костной ткани. Может быть следствием гиповитаминоза, отсутствием солнечных лучей, недостаточная чувствительность к витамину проявляется Снижением уровня Са, Р в крови и снижением щелочной фосфатазы. У новорожденных может развиваться транзиторная гипокальцийэмия, поскольку прекращается поступления СА от матери и имеется гипопаротиреоз. Гипокальцийэмия, Гипофосфатэимия – могут встречается при нарушении выроботки паратгормона, кальцитонина, нарушение функции ЖКТ(рвота, диарея), почек, механической желтухе, заживление переломов. №3 Взаимосвязь обменов. Ацетил- К0А, пируват, компоненты цикла Кребса – это те вещества, через которые осуществляются взаимные переходы между белками, жирами и углеводами. Например, пируват, образуется при распаде некоторых АК, может включиться в процессы глюконеогенеза, т.е. будет участвовать в синтезе углеводов. Ацетил- К0А, образуется при распаде других АК, может использоваться для синтеза ацетоновых тел и т.д. К незаменимым АК относятся те АК, которые не могут синтезироваться в организме, и обязательно должны поступать в составе пищи. Это лейцин, изолейцин, валин, треонин, лизин, гистидин, триптофан, метионин и фенилаланин. Еще две АК – цистеин и тирозин – могут синтезироваться из метионина и фенилаланила. При недостатке метионина и фенилаланила в пище тирозин и цистеин становятся незаменимыми АК. В зависимости от того какие вещества могут синтезироваться из аминокислот и х делят на 3 группы: Ø Гликогенные АК – те АК радикал которых может использоваться на глюконеогенез. Этих кислот большинство. Ø Кетогенные – те аминокислоты, радикал которых участвует в синтезе кетоновых или ацетоновых тел к этому виду аминокислот относят лейцин, изолейцин, триптофан, лизин. Ø Смешанные – фенилаланин, тирозин Все 20 АК превращаются в 8 безазотистых продуктов: ПВК, ЩУК, альфа-кето-глютаровая кислота, фумаровая кислота, сукцинил КоА, ацетил КоА (в последующем могут идти на синтез углеводов) ацето-ацетил КоА (+ацетил КоА на синтез ацетоновых тел).
№2 Распад гемоглобина. Переваривание: Под действием пепсина глобин отщепляется к гемму присоединяется HCl и образуется соляно-кислый-гематин коричневого цвета поэтому при желудочных кровотечениях содержимое желудка приобретает шоколадный оттенок. В кишечнике отщепляется соляная кислота и постепенно формируются пигменты дегтярно-черного цвета. Поэтому при кишечник кровотечениях стул имеет черный цвет.
Вердоглобин расщепляется на глобин, железо и биливердин Там (под действием микрофлоры) отщепляется глюкуроновая кислота и образуется новый пигмент мезобилиноген (уробилиноген). Часть его по vena porta идет в печень где разрушается до ди- и три-пиролов и выводится желчью. Другая часть в кишечнике переходит в стекобилиноген. Основная его часть выводится через кишечник в виде стертобилиноген (коричневый) – 300 мг. Другая часть по системе геморроидальных вен в кровь→почки→моча. Нарушения распада гемма. Концентрация гемоглобина не высока 2(8)-20 мкмоль/л повышение называется гипер-билирубин-эмия клинически прояляется как желтуха. Непрямой билирубин нейротоксичен. Прямой водорастворим и может выводится с мочой. По месту нарушения пигментного обмена различают гемолитические желтухи (надпеченочные), паренхиматозные (печеночные), механические (под печеночные). По характеру фракициям: конъюгированные, неконъюгированные смешанные Неконъюгированные при усиленном гемолизе эритроцито в крови повышен непрямой билирубин, в печени повышена концентрация стертобилина и содержимое кишечника пигментировано, в моче то же много стертобилина и выявляется уробилин. В кишечнике стертобилин. Разновидностью таких желтух. Болезнь Жильберта при которой снижена поступление и захват билирубина гепатацитами. Паренхиматозные желтухи: в крови повышен непрямой билирубин так как печень не может его обезвредить. Повышен и прямой билирубин так как затруднено его выведение желчью. Моча пигментирована и в ней присутствует билирубин, и уробилин. Содержимое кишечника более светлое так как меньше стертобилина. Разновидностью такой желтухи является желтуха Клиглера-Найяра при которой снижена активность глюк-уранл-трансферазы. Механическая (конъюгированная): развивается при нарушениях оттока желчи (опухоль, камень) в этом случае. В крови повышен прямой билирубин, в моче будет билирубин (пигментирована), в содержимое кишечника светло - белое. Разновидностью такой желтухи является Желтуха Дубина – Джонсона. При ней затруднено выведение прямого билирубина в желчь. Желтуха новорожденных: при ней концентрация билирубина можт повышаться до 40 ммоль/литр. Причина усиленный гемолиз эритроцитов, сниженный захват билирубина гепатитами, снижение активности глюк-уранил-трансферазы, снижение экскреции прямого билирубина в желчь, стерильность кишечника. №3 ГОРМОНЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ. 1. Инсулин - вырабатывается β-клетками, это белок (51 АК). Секрецию инсулина усиливает глюкоза и Са++, аргинин и лейцин. Контролирует секрецию инсулина соматотропин и соматостатин. Мишенью для инсулина служат: мышечная, соединительная, жировая ткань, в меньшей степени – печень. Эффект гормона реализуется по межмембранному типу — комплекс инсулин-рецептор повышает проницаемость клеточных мембран для глюкозы, АК, СА++, К+, Na++. Особенно сильно ускоряется транспорт глюкозы. Повышается проникновение Са++ в клетку, инсулин способствует образованию цГМФ из ГМФ за счет повышения активности гуанилатциклазы. Одновременно СА++ активирует фосфодиэстеразу, расщепляющую цГМФ. Снижение концентрации цГМФ сопровождается торможением распада гликогена, снижением глюконеогенеза и липолиза, снижает синтез кетоновых тел. При этом облегчается синтез гликогена и липогенез (синтез ТАГ), а также синтез белков, что ведет к ускорению роста и дифференциации клеток. Т.о., в тканях инсулин активирует: транспорт в клетку глюкозы, АК, К+ и СА++; активирует синтез гликогена, ТАГ и белков. В тканях инсулин тормозит: распад гликогена, глюконеогенез, липолиз, синтез кетоновых тел и холестерина. Т.е. инсулин активирует процессы, ведущие к снижению содержания глюкозы и тормозит процессы, повышающие содержание глюкозы. Нарушение (снижение) синтеза инсулина может привести к сахарному диабету. 2. Глюкагон - вырабатывается α-клетками поджелудочной железы. Его секреция ускоряется при увеличении Са++ и аргинина в крови. Ингибирует его секрецию глюкоза. Продукцию и секрецию глюкагона контролирует соматостатин. Мишень глюкагона—печень, жировая ткань и, в меньшей степени, мышцы. Эффект реализуется через АЦС, проявляется повышением распада гликогена в печени и отчасти в скелетных мышцах. Глюкагон повышает распад белка в печени и липолиз в жировой Тани в то же время угнетается синтез белка. Глюкагон способствует поддержанию высокого уровня глюкозы в крови. 3. Соматостатин вырабатывается Д-клетками. Сомитастатин тормозит секрецию глюкогона со всеми вытекающими последствиями (т.е. увеличивает глюконеогенез и распад гликогена). 4. Панкреатический полипептид вырабатывается F-клетками(36 АК). Проявляет глюкагоноподобную активность, снижает активность желудочных и панкреатических ферментов, расслабляет желчный пузырь, увеличивает перистальтику кишечника.
БИЛЕТ_27 №1. Дыхательные системы в митохондриях строго структурированы, окисление идет в основном на внутренней мембране митохондрий, которая имеет весь необходимый набор дыхательных систем, которые обеспечивают перенос электронов с субстрата на кислород и утилизируют выделяющуюся при этом энергию. То-есть в митохондриях окисление имеет в первую очередь энергетическое значение. Основная дыхательная цепь в митохондриях имеет следующий вид:
В высших организмах промежуточными переносчиками в дыхательной цепи являются:НАД(никотинамиддинуклеотид) (НАДФ(никотинамиддинуклеотидфосфат)), ФАД и ФМН, КоQ, семейство белков – цитохромов (гемсодержащие белки) и белки, содержащие негеминовое железо, то-есть белки содержащие железо-сероцентры. Рассмотрим все эти системы. Можно сказать что существуют полная и укороченная дыхательные цепочки. Процесс начинается с переноса электронов от восстановленного субстрата (SH2) к НАД или ФАД. Это определяется тем, является ли дегидрогеназа, катализирующая первую стадию, НАД – или ФАД – зависимой. Если процесс начинается с НАД, то следующим переносчиком будет ФМН. Каким бы не был исходный субстрат, электроны от флавина переносятся к КоQ, а затем в ходе определенной последовательности реакций переноса цитохромами достигают кислорода – терминального акцептора электронов. 1)НАД – и НАДФ – зависимые дегидрогеназы (где НАД и НАДФ – ко-ферменты). Описано более 250 таких ферментов. Это белки, молекулярная масса 70000 – 100000 Дальтон, часто в активных центрах содержат – тиогруппы (соответственно, подвержены воздействию тиоловых ядов), в ряде случаев содержит металлы. Отмечается специфичность ферментов в отношении НАД или НАДФ (или - или). Например, НАД-зависимый фермент лактатдегидрогеназа (ЛДГ). НАДф-зависимый - глюкозо-6-фосфатдегидрогеназа. А вот глутаматдегидрогеназа активна и в присутствии НАД, и в присутствии НАДФ. Изоцитратдегидрогеназа активна и в присутствии НАД и в присутствии НАДФ (в зависимости от вида изофермента). НАД (НАДФ)-зависимые ДГ катализируют следующие реакции: от субстрата под действием фермента отщепляется два протона и два электрона, акцептором которых являются НАД или НАДФ:
При недостатке витамина РР развивается пеллагра (дерматит, диарея, деменция). Обычно НАД представляет собой свободный ко-фермент, связывающийся с ДГ только в ходе реакции. Поступают НАД и НАДФ из цитоплазмы. 2) ФАД и ФМН-зависимые ДГ обычно ковалентно связаны с ДГ, так что целиком весь белок называют флавопротеидом (ФП). ко-ферменты ФАД и ФМН содержат и металлы, поэтому иногда говорят: металлофлавопротеиды. Например, сукцинат-ДГ содержит железо, ксантиноксидаза – молибден. Атомы металлов, входящих в состав этих ферментов, могут легко изменять свою валентность, присоединяя или теряя электроны. ФАД и ФМН имеют следующую структуру: Флавин – рибитол – фосфорная кислота (ФМН). Флавин – рибитол – фосфорная кислота – фосфорная кислота – рибоза – аденин (ФАД) Флавин (изоаллоксазин) + рибитл = витамин В2 (рибофлавин). Этот витамин активно участвует в окислительных процессах. При недостатке витамина В12 развивается поражение кожи, глаз и т.д. При окислении какого-то субстрата, от него ходе реакции, катализируемой этими ферментами отщепляется водород и электроны, но ФАД и ФМН, присоединяя их и при этом восстанавливаясь, очень быстро отдают их на какой-акцептор. Причем, флавиновые ферменты иногда окисляют определенные субстраты (ксантин, глицерофосфат, янтарную кислоту и т.д.), а могут окислять восстановленные формы НАДН и НАДФН. Акцептором может быть кислород (в таком случае ферменты называются оксидазы, а кислород присоединяет один или два электрона), убихинон, цитохромы и т.д.
3) КоQ (убихинон) – это жирорастворимое вещество. Для человека и млеопитающих n = 10, микробы – n = 6.
Белковая цепочка и определяет гидрфобность вещества. С убихинона электроны поступают на систему цитохромов, а протоны поступают в раствор (в межмембранное пространство). 4) Белки, содержащие жыелезосероцентры. Эти белки содержат негеминовое железо, то-есть в их составе нет гема, а железо образует комплекс с белком, при этом атомы железа связаны с атомами серы. Простетические группы этих белков представлены FeS; (FeS)2; (FeS)4 и т.д. Эти белки активно участвуют в переносе электронов, который осуществляется за счет изменения валентности железа в составе железосероцентров. Точная локализация их до сих пор не установлена, также как и механизмы окисления – восстановления. 5) Система цитохромов – это белки, простетическая группа которых представлена гемом. Цитохромы («клеточные пигменты») впервые обнаружены в конце 19 века. В природе известно 25 – 30 цитохромов. Локализо
|
||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 162; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.018 с.) |












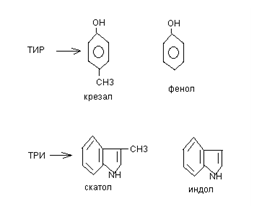 Чрезвычайно токсичные, их всасывание происходит по системе vena porta, обезвреживание в печени.
Чрезвычайно токсичные, их всасывание происходит по системе vena porta, обезвреживание в печени. микросомальное окисление токсичных веществ – участвуют мооксидазы, в результате гидроксилирования идет снижение токсичности, повышается водорастворимость, повышается реакционная способность.
микросомальное окисление токсичных веществ – участвуют мооксидазы, в результате гидроксилирования идет снижение токсичности, повышается водорастворимость, повышается реакционная способность.








 Превращение фосфорилазы «b» (неактивной) в фосфорилазу «а» (активную), происходит путём фосфорилирования. Фосфорилаза «b» + АТФ Фосфорилаза «а» + АДФ
Превращение фосфорилазы «b» (неактивной) в фосфорилазу «а» (активную), происходит путём фосфорилирования. Фосфорилаза «b» + АТФ Фосфорилаза «а» + АДФ АТФ: Аденин-рибоза-Ф-Ф-Ф Аденин-рибоза- Ф + ПФ
АТФ: Аденин-рибоза-Ф-Ф-Ф Аденин-рибоза- Ф + ПФ

 АТФ цАМФ
АТФ цАМФ


 Фосфорилаза Фосфорилаза
Фосфорилаза Фосфорилаза
 Фосфоролиз (распад гликогена)
Фосфоролиз (распад гликогена) Глюкозо-1-фосфат
Глюкозо-1-фосфат Адреналин (глюкагон)
Адреналин (глюкагон) Аденилатциклаза
Аденилатциклаза АТФ цАМФ
АТФ цАМФ
 Протеникиназа Гликогенсинтаза «b»
Протеникиназа Гликогенсинтаза «b» фосфорилирование
фосфорилирование
 Cа++ Киназа фосфорилазы Гликогенсинтаза «а»
Cа++ Киназа фосфорилазы Гликогенсинтаза «а»


 Фосфорилаза «b» Фосфорилаза «а»
Фосфорилаза «b» Фосфорилаза «а»

 УДФ-глюкоза
УДФ-глюкоза

 Глюкоза-6-фосфат Глюкоза-6-фосфат
Глюкоза-6-фосфат Глюкоза-6-фосфат Распад в тканях: происходит при распаде эритроцитов у взрослых через 120 дней у детей около 80 дней. Происходит в лимфоидных клетках, костном мозге, селезенке, печени. Освободившийся гемоглобин при распаде эритроцитов соединяется с белком гаптоглобином и транспортируется в клетки РЭС (ретикуло-эндотелиальная-систма). На первом этапе под действием гемоксигеназа происходит разрыв 1 метинового мостика и пирольная структура разворачивается → образуется вердоглобин.
Распад в тканях: происходит при распаде эритроцитов у взрослых через 120 дней у детей около 80 дней. Происходит в лимфоидных клетках, костном мозге, селезенке, печени. Освободившийся гемоглобин при распаде эритроцитов соединяется с белком гаптоглобином и транспортируется в клетки РЭС (ретикуло-эндотелиальная-систма). На первом этапе под действием гемоксигеназа происходит разрыв 1 метинового мостика и пирольная структура разворачивается → образуется вердоглобин.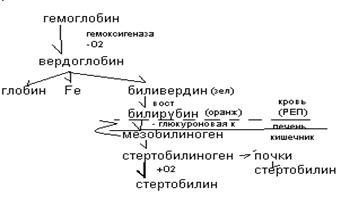 (пигмент зеленого цвета). Затем биливердин восстанавливается в билирубин (оранжево-желтый цвет) он плохо растворим в воде и очень токсичен. Поэтому билирубин адсорбируется с белками плазмы крови → становится более гидрофильным и в таком виде транспортируется в печень для обезвреживания. Эта форма имеет название: свободный билирубин (неконъюгированный) так как химически он с белками не связан или непрямой так как дает цветную реакцию не сразу, а после осаждения белков. Этот билирубин поступает в печень→захватывается гепатоцитами и в печени обезвреживается путем присоединения к нему глюкуроновой кислоты, сначала 1 потом 2. Этот билирубин тоже имеет 2 названия. Связанный так как он химически связан с глюкуроновой кислотой или прямой так как сразу дает качественную реакцию. Далее он экскретируется в желчь с затратой энергии и в составе желст поступает в тонкий кишечник.
(пигмент зеленого цвета). Затем биливердин восстанавливается в билирубин (оранжево-желтый цвет) он плохо растворим в воде и очень токсичен. Поэтому билирубин адсорбируется с белками плазмы крови → становится более гидрофильным и в таком виде транспортируется в печень для обезвреживания. Эта форма имеет название: свободный билирубин (неконъюгированный) так как химически он с белками не связан или непрямой так как дает цветную реакцию не сразу, а после осаждения белков. Этот билирубин поступает в печень→захватывается гепатоцитами и в печени обезвреживается путем присоединения к нему глюкуроновой кислоты, сначала 1 потом 2. Этот билирубин тоже имеет 2 названия. Связанный так как он химически связан с глюкуроновой кислотой или прямой так как сразу дает качественную реакцию. Далее он экскретируется в желчь с затратой энергии и в составе желст поступает в тонкий кишечник.






