Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
При этом способе не только обезвреживается аммиак, но паралельно и синтезируются заменимые АК.
№3 ЭЙКОЗАНОИДЫ Эйкозаноиды – производные либо арахидоновой (С20:4) кислоты, либо эйкопентановой (С20:5) кислоты. Все эйкозаноиды делятся на группы: I. Простаноиды
I. Лейкотриены II. Липоксины Синтез эйкозаноидов Источником является арахидоновая кислота, входящая в состав фосфолипидов:
Простагландины – циклические производные, их основа – простакиновая к-та. В зависимости от группы у 9 атома С выделяют:
В названии индекс (PgE2) показывает количество двойной связи простогландины рассматривают как тканевой гормон. Они обладают аутокринные или паракринным эффектом. РgF обладают сосудосуживающим действием, вызывает бронхоспазм, усиливают сокращение миометрия матки. PgЕ обладает расширяющим действием на сосуды, антиаритмическим действием на сердце, антисекретическим эффектом на слизистую желудка противоязвенное действие, увеличивает диурез, участвует в болевой рецепции, терморегуляции в иммунологических процессах. В патологических условиях в больших концентрациях Pg является медиаторами воспалений и аллергических реакциях. Тромбоксаны – циклические производные синтезируются в тромбоцитах, обладают сосудосуживающим эффектом, увеличивает агрегацию тромбоцитов, способствует тромбообразованию. Простоциклины – синтезируется в эндотелии сосудов, сосудорасширяющее действие, снижает агрегацию тромбокинов, обладает фиброциклическим действием, противоспалительные антиоксидаты. Лейкотриены – синтезируется в лейкоцитах, нецикличный, содержит 3 сопряженных двойных связей. Различают несколько видов. Наиболее распространен ЛТА и ЛТВ. В их составе нет аминокислот. В ЛТС, ЛТД, ЛТЕ есть несколько аминокислот. Индекс пишут редко. Биороль ЛТ:
БИЛЕТ_№_21
№1 БИОХИМИЯ ПЕЧЕНИ. Печень – самый крупный из внутренних органов человека (у взрослых достигает 1,2 – 1,5 кг).Химический состав печени:1) Вода – 70 – 75%2) Сухой остаток – 25 – 30% а) белок – 12 – 24% (из них 90% - глобулины), б) липиды – 2 – 6% в) углеводы (гликоген) – 2 – 8%
При отеках вода увеличивается до 80%, при ожирении уменьшается до 55%. При ожирении липиды увеличиваются до 20% и при жировом перерождении до 50%. При глюкогенозах гликоген увеличивается до 20% и более. Функции печени многообразны:1Принимает и расщепляет почти все вещества, поступающие в организм из желудочно-кишечного тракта.2Служит местом образования желчи.3Осуществляет биосинтез различных веществ, которые используются как субстраты в других органах и тканях.4Участвует в обезвреживании токсических продуктов метаболизма.5Инъактивирут многие гормоны.6Участвует в метаболизме чужеродных соединений и лекарственных средств.7Участвует в выделении некоторых продуктов метаболизма с желчью в кишечник и т.д. Одна из главных функций и шероховатого и гладкого ретикулума – синтез белков «на экспорт» (например, альбумина) и синтез ферментных комплексов, участвующих в метаболизме пступающих в гепатоцит соединений, а также синтез ТАГ, фосфолипидов, холестерола. Гладкий ретикулум участвует в детоксикации токсических соединений. Роль печени в обмене углеводов. Печень играет важную роль в поддержании физиологической концентрации глюкозы в крови. При нормогликемии гепатоциты извлекают большую часть глюкозы, поступающей из желудочно-кишечного тракта. Она расходуется на: а) на сисинтез гликогена (10 – 15%), б) окисляется (около 60%), в) на синтез жирных кислот (30%). В печени протекают и реакции глюконеогенеза (предшественники глюкозы поступают из мышц, жировой ткани, с пищей). роль печени в обмене липидов. Прежде всего печень участвует в переваривании и всасывании липидов. В печени синтезируются жирные кислоты – это эмуьгаторы жира и активаторы панкреатической липазы. Они же принимают участие и во всасывании жирных кислот. Печень выделяет в сутки 500 – 700 г желчи, содержащей до 90% воды. Концентрирование желчи происходит в желчном пузыре. Печень играет важную роль и в регуляции метаболизма жиров. Так, при дефиците глюкозы (основного энергоматериала) в печени ускоряется окисление жирных кислот. При избытке глюкозы жирные кислоты используются для синтезаТАГ и фосфолипидов.
Печень участвует в регуляции обмена холестерина. Он синтезируется из ацетил-КоА и избыточное образование ацетил-КоА (например, при избыточном питании) стимулирует процессы липолиза, в том числе и синтез холестерола. Тормозится его синтез (по принципу обратной связи) самим холестерином и жирными кислотами, поступающими в печень с кровью. Гепатоциты участвуют и в образовании транспортных форм липидов (липопротеидных комплесов). В печени окисляется большое количество жирных кислот, поступающих из желудочно-кишечного тракта и жировой ткани. Пи усилении липолиза (голодание, недостаток инсулина, интенсивная мышечная работа), часть ацетил-КоА (образующегося в ходе окисления жирных кислот) не успевает утилизироваться в ходе цикла Кребса и используется на синтез кетоновых тел (ацетоацетата, бета-оксимасляной кислоты и ацетона). Некоторые ткани используют ацетоацетат и бета-оксимасляную кислоту как энергетический материал – это сердечная мышца, кора надпочечников. Роль печени в обмене белков и аминокислот. Аминокислоты, поступающие из желудочно-кишечного тракта, печень использует для синтеза собственных специфических белков и для биосинтеза белков плазмы крови (фибриногена, альбуминов, большей части альфа и бета-гллобулинов и липопротеидов). Например, ежедневно синтезируется около 12г альбуминов и 2г фибриногена.В гепатоцитах синтезируются и специфические белки свертывания крови (фактор 2, 4, 6, 10). Печень активно участвует в обмене аминокислот, так как здесь интенсивно протекают процессы трансаминирования. Роль печени в пигментном обмене. Основная масса эритроцитов разрушается в печени. Гемоглобин, являясь пигментом крови, в результате ряда превращений (них мы говорили выше), превращается в билирубин, являющийся основным пигментом желчи, в виде билирубинглюкуронидов. Далее он поступает в кишечник, где претерпевает еще ряд превращений и выделяется из организма в составе кала и мочи. Роль печени в минеральном обмене. В печени могут депонироваться многие макро- и микроэлементы и поступающая в больших количествах вода. Антитоксическая функция печени: Детоксикация реализуется путем химической модификации веществ, которая включает в себя окисление, восстановление, метилирование, ацетилирование, гидролиз, конъюгацию с теми или иными веществами.Окисление, восстановление, гидролиз катализируют, в основном, микросомальные ферменты. Главный компонент микросомальной системы – цитохром Р450, имеющий много изоформ и отличающийся относительной специфичесностью. При реакциях гидроксилирования используются молекулярный кислород и НАДФН.В реакциях конъюгирования, в основном, присоединяются глюкуроновая кислота и ФАФС (так обезвреживается, например, индол, скатол, крезол, фенол). Так же обезвреживаются и билирубин. Аммиак утилизируется в ходе образования мочевины. Утилизация гормонов в печени зависит от их природы. Пептидные и белковые гормоны гидролизуются с участием протеаз до образования аминокислот, которые затем подвергаются дальнейшему распаду. Катехоламины подвергаются в гепатоцитах окислительному дезаминрованию (с участием моноаминоксидазы), затем метилируются и конъюгируются с глюкуронвой или серной кислтами. Продукты катаболизме выводятся с мочой. Стероидные гормоны гидроксилируются с участием гидроксилаз и тоже конъюгируются с глюкуроновой или серной кислотами и выводится с мочой. Тироксин в гепатоцитах вовлекается с трансаминирование, превращается в кетопроизводное и тоже конъюгируются. Кадаверин и путресцин (продукты декарбоксилирования соответственно лизина и орнитина) выделяются с мочой в неизменном виде.
Лекарственные вещества в печени, в основном, окисляются микросомальными оксидазами (Р450). Причем активность этих оксидаз индуцируется самими лекарственными веществами. №2 Взаимные превращения моносахаров в тканях. Взаимопревращения триоз, тетроз, пентоз и гептозы мы рассмотрели при обсуждении гликолиза и пентозофосфатного пути окисления углеводов. Рассмотрим взаимопревращения гексоз. В основном, катаболизм большенства простых сахаров идёт по гликолитическому пути. ØМанноза Под действием гексокиназы манноза может превращаться в маннозо-6-фосфат:
гексокиназа Далее:
Фосфоманнозо- изомериза ØФруктоза На долю фруктозы приходится значительная часть поступающих с пищей углеводов. Обычное её дневное поступление составляет около 100г – как в виде свободного сахара, так и в виде компонента сахарозы. Большая часть потребляемой фруктозы метаболизируется печенью по фруктозо-1-фосфатному пути:
Фруктокиназа
Фруктозо-1-фосфат- Альдолаза СН2ОН СН2ОРО3Н2 Глицериновый Фосфодиокси- альдегид ацетон
СН2ОН СН2ОРО3Н2 Глицериновый 3-фосфоглицериновый
в гликогиз Фруктоза может превратиться и во фруктозо-6-фосфат под действием гексокиназы. Однако, сродство гексокиназы к глюкозе в 20 раз больше, чем к фруктозе и поэтому в печени, характеризующейся высоким содержанием глюкозы, имеет место лишь незначительное фосфорилирование фруктозы по фруктозо-6 –фосфатному типу. В то же время в жировой ткани, где содержание фруктозы значительно выше, чем содержание глюкозы, большая часть фруктозыметаболизируется во фруктозо-6-фосфат. Фруктозо-6-фосфат, в свою очередь, легко может переходить во фруктозу-1,6-дифосфат:
фосфофруктокиназа И, далее, по пути гликолиза. Другой путь утилизации фруктозо-6-фосфата: переход ее в глюкозо-6-фосфат путем изомеразной реакции. А глюкозо-6-фосфат может использоваться, например, для каких-то синтетических процессов. ØГалактоза. Галактоза включается в этот процесс более сложным путем: она, как правило, не утилизируется с помощью гексокиназы:
Галактозофосфат- уридилтрансфераза +УТФ; -ПФ (у детей)
УДФ-глюкозо-эпимераза (у взрослых) УДФ-галактоза УДФ-глюкоза +
При недостатке фермента: галактозофосфатуридилтрансфераза развивается тяжелая патология-галактоземия. Часто это генетические мутации. Развивается непереносимость к галактозе(содержащейся в молоке), цирроз печени, почек, катаракта (вследствие накопления многоатомного спирта галактита (дульцита), отставание в умственном развитии.
№3 ПЕРИКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ ПОЛ – неферментативное свободно-радикальный процесс, в который в основном вовлекаются фосфолипидные клетки мишени. Инициатором ПОЛ является активные радикальные формы О2: супер-оксид О2÷, гидроксирадикал ОН* (О2* + Н2О2→О2+ОН+ОН*), оксидазота NО*, если NO*+О2*→ОNОО. Активные формы О2 атакуют атомы С в ненасыщенных жирных кислотах, находятся между 2-й связью. Стадии ПОЛ 1. Инициация: заключается в том, что активные формы О2 отрывают атом Н от жирной кислоты, превращая жирную кислоту в радикал жирной кислоты. 2. Разветвление с образованием большого количества новых радикалов: R*+О2→RОО* образовавшиеся радикалы воздействуют на новые молекулы жирных кислот. RН+RОО*→R*+RООН Гидроперекись также служит источником новых радикальных ферментов при участии ионов Ме переменной валентности – чаще Fе. RООН+Fе2+→RО*+ОН*+Fе3+ Некоторое количество гидроперикиси превращаются в малоновый диальдегид эти образовавшиеся радикалы атакуют новые жирные кислоты. 3. Обрыв – затухание процесса R*+R*1→RR1, R*+RОО*→RООR В физиологических условиях образуется невысокие концентрация продлевают ПОЛ и перекисное окисление участвует в регуляции фосфолипидного состава клеточных мембран. Повышая проницаемость клеточной мембраны участвует в фагоцитозе, пиноцитоза и синтезе эйкозаноидов. Уменьшают активность ПОЛ: супероксиддесмутаза, каталаза, глютадионпероксидазы, которые инактивируют радикальные формы О2, многие витамины Е, А, С. Витамин Е токоферол содержит циклический спирт тонол и ненасыщенный боковой радикал, жирорастворимый витамин. Широко распространен в природе. Суточная потербность 20-50 мг. Биороль: является «ловушкой» для свободных радикалов, инактивируя их участвует в обмене селена, который входит в состав ряда ферментов. Авитаминоз встречается редко и проявляется в повсеместном повреждении клеточных мембран. В эритроцитах сопровождается гемолизом, в мышечных клетках – мышечная слабость, дистрофия, в репродуктивных органах – нарушение подвижности сперматозоидов, рассасывание плода, невынашивание беременности.
БИЛЕТ_№_22 В ротовой полости белки не перевариваются (нет ферментов). Переваривание белка начинается в желудке. Главными клетками слизистой желудка продуцируется пепсиноген (неактивная форма фермента). Его активация происходит под действием HCl, вырабатываемой обкладочными клетками слизистой (метод частичного пртеолиза - т.е. Пепсин (активная форма) представляет собой эндопептидазу (т.е. расщепляет пептидные связи внутри белковой молекулы, а не с N- или С-конца), специфически действующую на пептидные связи, образованные с участием ароматических АК (например, тирозина) или дикарбоновых АК (например, глютамата). В результате образуются пептоны - большие полипептидные производные, которые затем поступают в тонкий кишечник. Соляная кислота не только участвует в активации пепсиногена. Под ее воздействием белковые молекулы денатурирует, утрачивая третичную структуру в результате разрушения водородных связей. Полипептидная цепь раскручивается и становится более доступной для действия протеолитических ферментов. Низкое значение рН (вследствие генерации HCl) также вызывает разрушение большинства микроорганизмов, попадающих в ЖКТ. В желудке также вырабатывается ренин (химозин, сычужный фермент). Он вызывает створаживание молока (что особенно важно для детей, т.е. предотвращает быстрый выход молока из желудка). В присутствии Са++ ренин переводит казеины молока в параказеин, на который затем действует пепсин. У взрослых ренин, внроятно, отсутствует. В 12-перстную кишку поступает желчь и секрет поджелудочной железы, имеющие щелочную реакцию, и сдвигают рН в щелочную сторону. Этот сдвиг необходим для проявления активности ферментов, вырабатываемых поджелудочной железой и железами слизистой кишечника, но он ингибирует дальнейшее действие пепсина. Поджелудочная железа секретизирует следующие ферменты: трипсиноген, химотрипсиноген, проэластазу и прокарбоксипентидазу. Это все неактивные формы ферментов. Активация трипсиногена осуществляется другим протеолитическим ферментом - энтерокиназой, вырабатывающийся железами слизистой кишечника. Активация идет по типу частичного протеолиза (аналогично с активацией пепсиногена). Получившийся активный трипсин специфически действует на пептидные связи, образованные основными АК (лизин, рагинин). Химотрипсиноген, проэластаза и прокарбоксипептидаза активируется трипсином по типу частичного протеолиза. Соответственно образовавшиеся химотрипсин (специфически действует на пептидные связи между остатками ароматических АК), эластаза (расщепляет связи между остатками АК с короткой цепью (глицин, аланин, серин). Это все эндопептидазы. После их действия, дальнейшее расщепление полипептидов осуществляет экзопептидаза – карбоксипептидаза, которая атакует С-концевую пептидную связь, высвобождая одиночные АК. Железы слизистой кишечника вырабатывают аминопситидазу (экзопептидазу), которая гидролизует пептидные связи с N-конца, и дипептидазы (различной специфичности), они завершают расщепление депептидов до свободных АК. Таким образом, мы можем отметить, что переваривание белков обладает рядом особенностей: Протеолетические ферменты вырабатываются в неактивном состоянии – это своего рода защитный механизм от самопереваривания слизистой желулочно-кишечного тракта. Активация сводится к механизму частичного пртеолиза. Активизируются ферменты (протеазы) непосредственно в ЖКТ. Протеазы ЖКТ отличаются субстратной специфичностью. Таким образом, пищеварение белков завершается образованием свободных одиночных АК. Всасывание аминокислот. АК подвергаются активному переносу через кишечную стенку (от слизистой поверхности к серозной). В этом переносе может участвовать витамин B6 (пиридоксальфосфат). Транспорт происходит с затратой энергии. АК переносятся целым рядом переносчиков, из которых некоторые являются Na+ - зависимыми (по сути – это сочетанный Ко - транспорт при работе Na+ , К+ - насоса). Есть предположения, что могут всасываться и белки и пептиды, при этом у этих лиц возникает иммунологическая реакция на изменение белка. №2 Свёртывание крови Регуляция агрегатного состояния крови (РАСК) Свертывающая система крови. Это биологическая система поддерживающая жидкое состояние крови и препядствующая кровопотери путем образования кровяного сгустка или тромба. В свертывании крови выделяют 2 стадии: · Сосудисто-тромбоцитарный гемостаз – суживание сосудов, уменьшение выделение эндотелием противосрертывающих факторов и адгезия и агрегация тромбоцитов в участке в результате формируется тромбоцитарный тромб (или белый тромб) · Коагуляция – здесь участвуют тромбоцитарные факторы, эритроцитарные и плазменные. Плазменные факторы крови. Классифицированы в 1954 Коллером. Он описал ХIII факторов, позже добавлены еще 2 фактора. Все плазменные факторы свертывающей системы, кроме IV являются белками чаще всего глобулинами и чаще всего гликопротеидами. Они синтезируются в неактивном состоянии. Активация этих факторов происходит различными механизмами: 1. путем частичного протеолиза 2. путем взаимодействия с Ко-факторами 3. путем взаимодействия с фосфолипидами мембран клеток и ионами Са→конформационные перестройки. Большинство белковых факторов являются в активной форме протеолитическими ферментами протеазами содержащими в активном центре серин примеры: II, VII, IX, X. Все факторы свертывние крови синтезируются в печени, для этих фактором (2,7,9,10) необходим витамин К. Все плазменные факторы помимо римской цифры имеет тривиальное название по фамилиям чаще всего больных у которых был обнаружен дефицит этих факторов. I. Фибриноген – белок II. Протромбин – фермент (протеолитический). Для его синтеза необходим vit К III. Тканевой тромбопластин обрывки плазматических мембран имеет большую молекулярную массу, богат белками липопротеидами, содержин НК IV. Ионы Са V. Проакцеверин – ко-фактор, белок VI. Акциверин (V активный) – VII. Проконвертин – в активной форме будет ферментом, синтез требует витамина К VIII. Антигемофилийный глобулин А (АГГА, фактор Вилленбранда) – ко-фактор IX. Антигемофилийный глобулин В (фактор Кристмаса) – фермент, синтез требует вит К (в активной форме протеаза) X. Фактор Проуэра-Стюарта – в активной форме фермент, синтез требует вит К (в активной форме сериновая протеаза) XI. Фактор Розенталя – в активной форме фермент XII. Фактор Хагемана – фермент, гликопротеид XIII. Фибринстабилизирующий фактор фермент трансамидиназа XIV. Прекалликреин (ф. Леттчера) XV. Кининоген (ф. Фитцджеральда) Схема свертывания крови. Во всех схемах выделяют три главные стадии гемокоогуляции: 1. Образование тромбопластина крови и тромбопластина ткани 2. Образование тромбина 3. Образование фибринового сгустка Выделяют 2 механизма гемокоогуляции: внутренний механизм свертывания так называется потому что в нем участвуют факторы находящиеся внутри сосудистого русла и внешний механизм свертывания крови в нем помимо внутрисосудистых факторов участвуют еще и внешние факторы. Внутренний механизм ввертывания крови (контактный ) Запускается при повреждении эндотелия сосудов например при атеросклерозе, после высоких доз катехоламином. В этом случае в участке повреждения приоткрывается субэндотелиальный слой в котором присутствует коллаген, фосфолипиды. К этому участку присоединяется 12-й фактор (пусковой фактор). Взаимодействуя с измененным эндотелием претерпевает конформационные структурные изменения и становится очень мощным активным протеолитическим ферментом. Этот фактор активирует: 1. свертывающую систему крови 2. активирует противосвертывающую систему 3. активирует агрегацию тромбоцитов 4. активирует кининовую систему 12 фактор контактируя переходит в 12 активный→активирует прекалликреин (14)→активирует кининоген (15)→повышают активность 12 фактора. 12а→активирует 11→11 активный→активирует 9→9а (ф. Кристмаса)→взаимодействует с 8 фактором и ионами Са→(9а+8+Са)→активирует 10 (при участии тромфоцитарного фактора Р3)→ 10а+5+Са→ Р3-фрагмент мембран тромбоцитов содержит липопротеиды и богат фосфолипидами (10а+5+Са+ Р3- тромбопластин крови ТПК) ТПК запускает 2 стадию → активирует переход 2→2а→активный тромбин замускает 3 стадию. Стадия образование нерастворимого тромбина. 1 (под воздействием АТК)→в фибрин мономер→фибринполимер. Фибриноген – белок состоит из 6 ППЦ, включает 3 домена и выступающими пептилами. Под действием тромбина отщепляются А и В пептиды, формируются участки агрегации и фибриновые нити соединяются сначала в линейные цепи, а затем формируются ковалентные сшивки межцепочечные (в образовании которых участвует 13 фактор который активируется тромбином) между ГЛЮ и ЛИЗ. Фибриновый сгусток подвергается сжатию (ретракции) за счет энергии АТФ и фактора Р8 – ретрактоэнзим. Механизм свертывания носит каскадный характер т.е. усиливается от предшествующего этапа в этой схеме есть и обратные связи. 2а→активирует 13 фактор, 5 фактор, Р3 и 8 фактор.
Внешний механизм свертывания крови (прокоагуляция) Включается при травме, разрыве сосуда и контакте плазмы с тканями. С плазмой крови взаимодействует фактор 3 → активирует 7 → 7а →(ТФ+7а+Са) – тромбопластин тканей. 2 стадия ТПТ активирует 10→(10а + 5+Са)→активируется 2→2а→фибриноген→фибрин. Время свертывания 10-12 секунд.
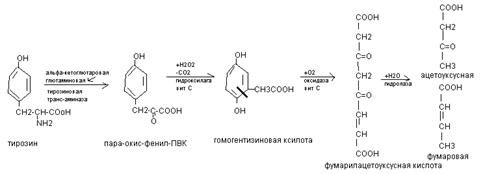
Нарушение гемостаза. Наблюдается при тромбоцитопениях, тромфоцитофилиях, тромбоцитопениях. Могут быть тромботические состояния при преобладаении свертывающей системы, гемморагические состояния при преобладании противосвертывающей системы, гемофилии А (8), В (9), С (11) парагемофилия (5). №3 ОСОБЕННОСТИ ОБМЕНА ФЕНИЛАЛАНИНА И ТИРОЗИНА Фенилаланин – незаменимая аминокислота основной реакцией превращения фенилаланина в организме является окисление в тирозин при участи фермента фенилаланингидроксилаза и ко-фермента тетра-гидра-био-птерин с добавлением О2. При врожденном дефекте фермента – фенилкетонурия при которой фенилаланин переходит в фенилПВК, фенилУК (токсичные) и одновременно тирозин не используется на синтез нейромедиаторов. Поэтому фенилкетонурия называется фенилпировиноградная олигофрения. Тирозин – заменимая аминокислота и используется на синтез многих важных веществ: Ø +I = тироксин (гормон щитовидной железы) Ø Через окисление переходит в диоксифенилаланин (ДОФА), который потом в коже образует меланины, а в эндокринной системе – норадреналин, адреналин, ДОФ-амин (катехоламины) Ø Через трансаминирование превращается в фумаровую кислоту, которая идет на синтез углеводов и в ацетоуксусную кислоту – на синтез ацетоновых тел. Окисление тирозина в ДОФА.
При нарушении активности ферментов синтеза меланинов развивается альбинизм, а эти ферменты выполняют защитную функцию от УФ, являются АОХ и иммунную функцию. Трансаминирование тирозина.
При врожденном дефекте трансаминазы, гидроксилазы, гидралазы – тиразинозы. При отсутствии оксидазы – алкатонурия объясняется присутствием гомогентизиновой кислоты, которая при контакте с воздухом переходит в продукты темного цвета.
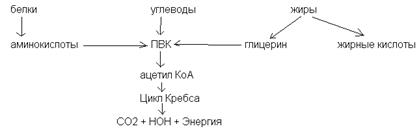
БИЛЕТ_23 1) Реакции окисления-восстановления. Большинство стадий катаболического пути включают рекции окисления, в которых принимают участие окисленные формы ко-ферментов НАД(+), НАДФ(+) и реже ФАД(+), которые в результате восстанавливаются до НАДН, НАДФН и ФАДН2. В анаболических реакциях, а это, в основном, реакции восстановления, используются восстановленные формы этих ко-ферментов (в первую очередь НАДФН), сами же ко-ферменты в ходе этих реакций окисляются. 2) Энергетика реакций: катаболизм представляет собой экзэргонический процесс, требующий АДФ и происходящий с образованием АТФ. АТФ затем служит источником энергии в эндэргонических реакциях анаболизма, в ходе которых образуется АДФ. 3) Исходные соединения, конечные продукты и промежуточные метаболиты. Конечные продукты и метаболиты, образующееся в катаболических процессах, обычно служат исходными соединениями анаболических процессов и, наоборот, соединения, получаемые в ходе анаболических процессов могут быть исходными для катаболических путей. Все вышеуказанное позволяет сделать вывод, что катаболизм и анаболизм – это сопряженные, взаимодополняющие процессы. Общие пути катаболизма. Как известно основные органические вещества в клетке – белки, жиры, углеводы. Каждое из этих классов соединений в значительной мере отличается друг от друга по химическому составу, следовательно и пути синтеза и пути распада этих соединений отличаются друг от друга. Однако, необходимо отметить, что весь процесс клеточного метаболизма взаимосвязан и взаимозависим. Более того, процесыы катаболизма и анаболизма происходят одновременно, хотя и существуют сдвиги в сторону одного или другого процесса, в зависимости от потребности клетки. Общим же, связывающим звеном всех видов распада и синтеза является цикл лимонной кислоты (или цикл трикарбоновых кислот, или цикл Кребса). Ганс Кребс – определил последовательность реакций цикла. Рассмотрим процессы катаболизма. Чисто условно катаболизм основных органических веществ в организме делят на три этапа: 1) распад сложных органических веществ до мономеров (белки - аминокислоты, жиры – жирные кислоты плюс спирты, сложные углеводы - моносахара). Это специфичные пути катаболизма для каждого вида биомолекул. Энергия при этих процессах не образуется; 2) полученные на первом этапе продукты (аминокислоты, жирные кислоты и т.д.) превращаются в общие продукты катаболизма (ПВК и ацетил- КоА). Это тоже специфичные пути. При этих реакциях образуется некоторое количество энергии; 3) общие пути катаболизма. Так как различные органические соединения (белки, жиры, углеводы) имеют разную химическую структуру, то и распадаются они по-разному. Но на определенных этапах распада белков, жиров и углеводов образуются общие для всех видов распада соединения, которые либо запускают цикл Кребса, либо являются его интермедиатами. Так, углеводы при распаде превращаются в ПВК. Жирные кислоты – превращаются в ацетил - КоА. Различные аминокислоты превращаются в различные интермедиаты цикла Кребса и включаются в цикл на определенном этапе (например: аланин, треонин, глицин, цистеин, серин – превращаются в пируват; аспарагин – в оксалоацетат (ЩУК), тирозин – в фумарат; валин, метионин – в сукцинил-КоА; лейцин, изолейцин, триптофан – в ацетил-КоА и т.д.). Из всех указаных соединений, в которые превращаются белки, жиры и углеводы при распаде, только ПВК не является составной частью цикла Кребса. Однако ПВК превращается в ацетил-КоА под действием пируват ДГ-комплекса. Общую схему катаболизма мы можем представить так:
Таким образом, общими путями катаболизма мы можем назвать цикл Кребса и, в какой-то мере, превращение ПВК в ацетил КоА.
3 Аммиак чрезвычайно токсичное вещество. Токсичность аммиака объясняется многими его эффектами главными среди которых будут связывание альфа-кето-кислот и блокирование включений этих альфа-кето-кислот цикл Кребса, что нарушает энергетический обмен в тканях. Кроме того может повышается концент рация глютамата до токсичных для ткани мозга концентраций. Кроме того аммиак вызывает защелачивание тканей и нарушает транспорт Na и Са. Поэтому концентрация аммиака в тканях и в крови очень низка так в плазме крови: 20-80 мкмоль/литр. Эта низкая концентрация поддерживается наличием в организме путей связывания (обезвреживания) аммиака. Эти способы можно разделить на: Ø временные (протекают в тканях) · · амидирование белков · синтез глютамина Ø образование конечных продуктов азотистого обмена · соли аммония · мочевинамиди
Восстановление Присоединение к альфа-кето-кислотам аммиака с одновременным восстановлением альфа-кето-кислоты с образованием аминокислоты.
В качестве альфа-кето-кислот используется пировиноградная кислота которая восстанавливается в фенлаланин, щавелевоуксусная в аспарагиновую кислоту, альфа-кето-глютаровая кислота получается глютаминовая кислота.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 127; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.51.3 (0.133 с.) |


 АТФ АДФ
АТФ АДФ Манноза Маннозо-6-фосфат
Манноза Маннозо-6-фосфат Маннозо-6-фосфат Фруктозо-6-фосфат
Маннозо-6-фосфат Фруктозо-6-фосфат АТФ АДФ
АТФ АДФ Фруктоза Фруктозо-1-фосфат
Фруктоза Фруктозо-1-фосфат

 С СН2ОН
С СН2ОН Н
Н

 Фруктозо-1-фосфат Н – С – ОН + С=О
Фруктозо-1-фосфат Н – С – ОН + С=О


 Н АТФ АДФ Н триозофосфатизомераза
Н АТФ АДФ Н триозофосфатизомераза

 Н – С – ОН Н – С – Н
Н – С – ОН Н – С – Н Триозокиназа
Триозокиназа альдегиз альдегиз
альдегиз альдегиз АТФ АДФ
АТФ АДФ Фруктозо-6-фосфат Фруктозо-1,6дифосфат
Фруктозо-6-фосфат Фруктозо-1,6дифосфат АТФ АДФ
АТФ АДФ Галактоза Галактозо-1-фосфат
Галактоза Галактозо-1-фосфат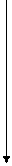
 галактокиназа
галактокиназа УДФ-галактоза
УДФ-галактоза УДФ-галактозопирофосфорилаза
УДФ-галактозопирофосфорилаза Галактозо-1-фосфат
Галактозо-1-фосфат
 Важным витамином в свертывании крови является витамин К (нафтахинон, антигемморагический) Суточная потребность 10-20 мкг, необходим для синтез 2,7,9,10 факторов. В этих факторах образуется γ-карбокси-глютаминовая кислота.
Важным витамином в свертывании крови является витамин К (нафтахинон, антигемморагический) Суточная потребность 10-20 мкг, необходим для синтез 2,7,9,10 факторов. В этих факторах образуется γ-карбокси-глютаминовая кислота.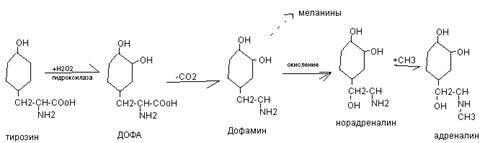
 восстановительное аминирование альфа-кето-кислот
восстановительное аминирование альфа-кето-кислот