
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Особенности процессинга для рРНК, тРНК, иРНК.Стр 1 из 7Следующая ⇒
иРНК – заключается в добавлении КЕП участка и полиаденилового хвоста + сплайсинг. тРНК – созревает путем метилирования азотистых оснований и добавляется акцепторный участок ЦЦА + сплайсинг. рРНК – из большого предшественника вырезаются фрагменты всех видов РНК 18S; 5S; 5,8S; 28S; + сплайсинг.Возможен альтернативный сплайсинг – он состоит в том, что для разных белков интроны могут выполнять роль экзонов и наоборот.Возможен и безматричный синтез РНК он происходит из нуклеозид ди-фосфаты, участвует фермент полинуклеатидфосфорилаза и синтезируются стандартные, небольшие молекулы РНК, они необходимы для стандартных белков.Таким образом в организме передача генетической информации передается в ледующем направлении ДНК→РНК→→→белок. Однако в некоторых Биосах, фагах, эмбриональных тканях возможен синтез ДНК по матрице РНК (РНК→ДНК) этот синтез катализирует фермент РНК-зависимая ДНК-полимераза (обратная транскриптаза, ревертаза). Возможен еще вариант РНК→РНК (у вирусов) здесь участвует РНК-репликаза. (2) Транспортные РНК. Каждая клетка содержит до 60 видов молекул тРНК. Они самые маленькие из всех видов НК (М = 25000), содержит 73 – 93 нуклеотида. Функции тРНК заключаются в транспортировке аминокислот к месту синтеза белка – в рибосомы. тРНК обладают специфичностью. Аминокислота, транспортируемая тРНК доставляется к определенному участку информационной (матричной РНК), указанному кодоном. Чтение (распознавание) кодонов достигается вследствии наличия в каждой тРНК уникальной тринуклеотидной последовательности, называемой антикодонами, последовательность которого комплементарна последовательности кодона. Пространственная структура тРНК напоминает «клеверный лист»:
тРНК содержит до 50 различных нетипичных (модифицированных) нуклеотидов. Присоединение АК к тРНК катализируется ферментом аминоацил-тРНК-синтетазой. И уже в виде комплекса аминоацил-тРНК аминокислота доставляется к месту синтеза белка.
БИЛЕТ 13 1. Первичная структура определяется: а)природой входящих в молекулу аминокислот; б)относительным количеством входящих в молекулу аминокислот; в)строго определенной аминокислотной последовательностью полипептидной цепи (или цепей).
значение первичной структуры белковых молекул: 1) определяет общую конформацию и биологическую активность белка, 2) Определяет видовую специфичность, 3) позволяет определять молекулярные патологии, 4)дает возможность синтезировать белок с заданными биологическим свойствами (впервые был синтезирован инсулин Сэнджером в 1964 году). Для первичной структуры характерна видовая специфичность, то-есть каждый вид животных организмов имеет свою, неповторимую первичную структуру у белков, выполняющих одну и ту же функцию у разных видов. серповидно-клеточная анемия – наследственной болезни, при которой способность эритроцитов связывать кислород снижается. Интактная молекула гемоглобина состоит из двух бэтта- цепей и двух альфа-цепей. Бэтта- цепь нормального гемоглобина взрослого человека в шестом положении содержит глутаминовую кислоту. В серповидных клетках (характерно измененной формы) – бэтта-цепь в шестом положении содержит валин. Все остальные аминокислоты в составе бэтта-цепи и альфа-цепи совершенно одинаковые. 2. Химический состав эритроцитов На долю воды в эритроцитах приходится 60-70%. Остальные составляет сухой остаток (30-40%), из которого 90% и более (до 98%) составляет НЬ. Есть в эритроцитах и другие белки (всего белков 300-340г/л), ферменты, холестерин, фосфолипиды (чуть больше, чем в плазме), глюкоза (примерно столько же, сколько и в плазме), металлы (Fe, Cu, Zn). K+ содержится в эритроцитах 80-100 м моль/л (до 120); Na+ - 13-22 м моль/л (до 35); Са++ - 0,5 м моль/л; Mg++ -1.65-2.65 м моль/л; Fe -19 м моль/л. Особенности метаболизма эритроцитов Эритроциты не содержат ядер и митохондрий, соответственно, процессы, протекающие в этих органеллах у них не идут. Поэтому, для эритроцитов важнейшим энергообразующим процессом, например, является гликолиз. Активно идёт пентозофосфатный путь, который даёт НАДФН, необходимый для восстановления глютатиона, который в свою очередь обеспечивает резистентность эритроцитов, в первую очередь к кислотам и перекисям. Кислород-транспортная функция Кровь транспортирует 02 и С02. Кислород в небольших количествах может транспортироваться в растворённом состоянии (при нормальной температуре на 100мл крови приходится 0,3-0,5мл растворённого 02 (при условии парциального давления 02 в крови на уровне 80-90мл ртутного столба). Всего в крови на 10мл приходится 20-25мл 02, т.е. в растворённом состоянии находится всего 1-2% всего кислорода крови. Т.е. этот вид транспорта кислорода несущественен. В клинике, для увеличения доставки кислорода к тканям, увеличивают парциальное давление кислорода в крови (гипербарическая оксигенация). При этом увеличивается растворимость 02 и возникает возможность больше доставить кислорода к нужному органу. В основном же транспорт 02 к тканям осуществляется с участием НЬ. Hb+Ог -НЬОг (оксигемоглобин) Кислород присоединяется к молекуле тема за счёт 6й координационной связи железа (четыре координационных связи железа связаны с пиррольными кольцами в одной плоскости, 5" и 6" направлены перпендикулярно этой плоскости. 5* насыщается гистидином из молекулы глобина, а 6" насыщается О?). Такое расположение предотвращает самопроизвольное окисление железа. В молекуле НЬ содержится 4 гема, следовательно 1 молекула НЬ может связать 4молекулы 0)г. При присоединение кислорода к НЬ отмечено кооперативное влияние цепей гемоглобина, т.е. присоединение кислорода к первой цепочке, облегчает присоединение 02 ко второй, к 3 цепи Ог присоединяется ещё легче и т.д. График зависимости насыщения гемоглобина от парциального давления кислорода выглядит так:
Карбоксигемоглобин (НЬСО). СО присоединяется к той же связи, что и 02, но в Железо в составе гемоглобина может окисляться до Fe+++ под действием различных
3. Окисление жирных кислот. Разделяют несколько вариантов окисления жирных кислот в зависимости от углеродного атома: α-окисление, β-окисление, ω-окисление. Основным вариантом является β-окисление. Наимболее активно оно протекает в жировой ткани, печени, почках и сердечной мышце. β-окисление заключается в постепенном отщеплении от жирной кислоты двух углеродных фрагментов в виде ацетил КоА с освобождением энергии. Запас жирных кислот расположенных в цитозоле, в котром протекает и активация жирных кислот с образованием из них ацетил КоА.
Последующее β-окисление ацетил КоА идет в митохондриях. Митохондриальная мембрана не проницаема для длинноцепочных ацетил КоА. В переносе их внутрь митохондрий участвует специальный переносчик карнитин (метил, гидропроизводной аминомасляной кислоты). Суть переноса: ацетил КоА взаимодействует с карнитином образует комплекс.
Химизм митохондриального β-окисления.
Энергетическая эффективность- бета окисления складывается из: а) Е окисления ацетил КоА в цикле Кребса б) Е самого бета окисления Энергия окисления тем выше, чем длиннее углеродная цепь. Количество молекул ацетил КоА из данной жирной кислоты определяется по формуле: 1) n=Nc/2, где n-количество атомов, N- число С атомов кислоты. nАТФ=(N/2)*12
nАТФ=((N/2)-1)*5
Расход АТФ:– 2 связи Итого: 17(N/2)-7 – бета окисление насыщенной кислоты с четным числом атомов «С». При окислении жирных кислот с нечетным числом «С» образуется сукцинил КоА который вступает в цикл Кребса. Особенности окисления ненасыщенных жирных кислот Начальные стадии окисления – обычное бета окисление до места двойной связи. Затем если эта двойная связь находится в альфа или бета положении, то продолжается окисление жирной кислоты со 2 этапа (минуя стадию восстановления ФАД→ФАДН2. Но если двойная связь находится не в альфа или бета положении, то ферментами енолтрансферазами связь перемещается в альфа или бета положение т.о. при окислении ненасыщенных жирных кислот образуется меньше энергии по формуле: 7(N/2)-7-2m, где m-число двойных связей, теряется образование ФАДН2.
Регуляция активности ферментов. Адаптация организма к меняющимся условиям (режим питания, экологическим воздействиям).. Существует несколько возможностей регуляции скорости ферментных реакций: 1. Изменение скорости синтеза ферментов. (этот механизм длительный). 2. Увеличение доступности субстрата к ферменту путем изменения проницаемости клеточных мембран. 3. Изменение активности ферментов имеющихся в клетках и тканях. Этот механизм быстрый и носит обратимый характер. В многоступенчатых ферментативных процессах выделяют регуляторные, ключевые ферменты, которые ограничивают суммарную скорость процесса. Чаще всего это ферменты начальной и конечной стадий процесса. Изменение активности ключевых ферментов происходит по следующему механизму: 1. Аллостерическому:
2. Изменение олигомерности фермента: Мономеры неактивные ↔ олигомеры активные 3. Фосфолирирование: Фермент (неактивный) + Н3РО4 ↔ Фосфолирированный активный фермент.
Готовые нуклеотиды угнетают начальные в стадии их синтеза.
Иногда исходные субстраты активируют конечные ферменты А активирует F3, например активная форма глюкозы активирует последний фермент синтеза гликогена (F3). Структурная организация ферментов в клетке Слаженность обменных процессов в организме возможна благодаря структурной разобщенности ферментов в клетках. Отдельные ферменты располагаются в тех или иных внутриклеточных структурах – кампартментализация. Например, в плазматической мембране активен фермент калий-натрий АТФаза.В митохондриях активны ферменты окислительных реакций. В ядре – ферменты синтеза нуклеиновых кислот ДНК-полимераза. В лизосомах – РНКаза, фосфатаза и другие.Ферменты наиболее активные в данной клеточной структуре называются индикаторными или маркерными ферментами. Их определение в клинической практике отражает глубину структурных повреждений ткани. Некоторые ферменты объединяются в полиферментные комплексы: пируват ДК. Принципы обнаружения и количественного определения ферментов: Обнаружение основано на их высокой специфичности. Ферменты обнаруживают по производимому ими действию т.е. по факту протекания той реакции которую катализирует данный фермент. Критерии: Ø Исчезновение субстрата реакции Ø Появление продуктов реакции Ø Изменение оптических свойств кофермента. Количественное определение ферментов Т.к. их концентрация очень низка, то определяют не истинную концентрацию, а о количестве фермента судят косвенно, по активности фермента.Активность ферментов оценивают по скорости ферментативной реакции в оптимальных условиях (оптимум температуры, РН, избыточно высокая концентрация субстрата). В этих условиях скорость реакции прямопропорциональна концентрации фермента. Единицы активности (количества) фермента: 1. Международная – то количество фермента, которое катализирует превращение 1 микромоля субстрата за минуту при 25 градусах. 2Катализирующая – то количество фермента, которое катализирует превращение 1 моля субстрата за секунду.3Удельная активность – отношение активности фермента к весовому количеству фермента.4Молекулярная активность фермента показывает сколько молекул субстрата превращается под действием 1 молекулы фермента. Применение сведений о ферментах в медицинской практике составляет раздел медицинской энзимологии. Она включает 3 раздела:1Энзимодиагностика (исследование ферментов для диагностических целей).2Энзимопотология. 3Энзимотерапия.Для отдельных тканей используют органоспецифические ферменты. Содержание трансаминазы в плазме крови возрастает в результате увеличения тканевой проницаемости.Глюкоза-6-фосфатдегидрогеназа увеличивается в результате усиленного распада эритроцитов.Активность других ферментов наоборот низкая, например активность пепсина, ферментов поджелудочной железы липазы, амилазы, в силу незрелости секреторных клеток. С возрастом возможно перераспределение отдельных изоферментов. У детей преобладает ЛДГ3, а у взрослых ЛДГ2. Энзимопатология – заболевания, ведущим механизмом развития которых является нарушение активности ферментов. Энзимотерапия – применение ферментов, коферментов, активаторов, иммуноглобулинов с лечебными целями.
2 Цикл Кребса.
В ходе одного полного цикла происходит: 1) полное окисление ацетильного остатка до двух молекул углекислого газа; 2) образование 3 молекул НАДН и одной ФАДН2; 3) образование одной молекулы ГТФ. Рассмотрим работу отдельных ферментов: 1) цитратсинтаза – идет образование –с – с- связи, но эта рекция не требует расхода АТФ. Необходимая энергия обеспечивается гидролизом тиоэффирной связи. При этом увеличивается реакционная способность альфа-углеродного атома ацетила. Фермент обладает высокой специфичностью, а сама реакция представляет собой объект регуляции всего цикла. Ингибиторами фермента являются: АТФ, НАДН и сукцинил КоА.2) Аконитаза – катализирует переход цитрата в изоцитрат путем дегидратации цитрата до цис-аконитовой кислоты с последующей ее гидратацией и переходом в изолимонную кислоту. Обладает абсолютной стереоспецифичностью. В регуляции значительной роли не играет. Ингибируется фтороцитратом. Этим объясняется токсичность некоторых растений, содержащих фтороацетат, из которого синтезируется фтороцитрат (например, астрогал).3) Изоцитрат-ДГ – катализирует первую из 3 реакций цикла, в ходе которых синтезируется НАДН. Игрет одну из основных регуляторных ролей в цикле. Активаторы – АДФ, НАД+; ингибиторы – АТФ, НАДН. Изоцитрат-ДГ обнаружена и в цитоплазме, где она катализирует аналогичную реакцию, но использует в качестве ко-фермнта НАДФ. В цитоплазме этот фермент играет роль источника альфа-кетоглютарата для синтеза акминокислот и источника НАДФН для анаболических реакций.4) Альфа-кетогютарат-ДГ – комплекс (содержит три фермента, пять ко-ферментов – те же, что и ПДК, работают аналогично).5) Сукцинилтиокиназа – расщепляется макроэргическая связь в молекуле сукцинил КоА, при этом энергия сохраняется путем образования нуклеозидтрифосфата (ГТФ). Это единственная стадия в цикле, в ходе которой прямо выделяется энергия метаболизма. 6) Сукцинат ДГ – абсолютно стереоспецифична. Это пример реакции субстратного фосфорилирования. Отщепляется Н+ только в транс-положении. Единственный фермент, локализованный на метохондриальной мембране (все остальне ферменты – растворимые в воде белки – локализованные внутри митохондрий).7) Фумараза – также обладает стереоспецифичностью (действует только на образование L-малата). В регуляции участия не принимает.8) Малат ДГ – есть и в цитозоле, принимет при этом участие в работе малатного челночного механизма, способствуя проникновению НАДН из цитозоля в митохондрии. Так же связывает цикл Кребса с процессом биосинтеза пиримидинов и некоторых аминокислот. Обладает абсолютной специфичностью. Значение цикла Кребса. 1)Энергетическое (образуется три молекулы НАДН, ФАДН2, которые могут в ходе передачи электронов в дыхательной цепочки дать энергию, достаточную лдля синтеза 11 молекул АТФ: 3*3 НАДН + 1*2 ФАДН). Кроме того, в ходе цикла образуется молекула ГТФ, при гидролизе которой выделяется столько же энергии, как и при гидролизе АТФ. То-есть всего в ходе цикла мы можем получить 12 молекул АТФ.2) Цикл Кребса играет большую роль и для анаболических процессов, так как промежуточные продукты используются для самых разных синтетических процессов. Так, ЩУК используется для синтеза пирувата (через образования фосфоенолпирувата), который в свою очередь идет на синтез углеводов, некоторых аминокислот (глицерина, валина, аланина, серина, цистеина, фенилаланина, тирозина, триптофана и т.д.). Ацетил КоА используется для синтеза жирных кислот. Сукцинил КоА на синтез гема и т.д. Регуляция цикла Кребса. Мы уже упоминали регуляцию отдельных ферментов цикла. Следует лишь добавить, что при анаболических процессах расходуется ЩУК и, чтобы реакции цикла не тормозились, происходит дополнительное образование ЩУК:
Как правило, сигналом дополнительного образования ЩУК служит накопление ацетил- КоА (в случае отвода интермедиатов цикла на синтетические процессы). Ацетил КоА является сильнейшим аллостерическим активатором пируваткарбоксилазы. Следовательно, интенсивность цикла зависит и от наличия ПВК. При диабете отмечается дефицит ПВК, следовательно образуется дефицит ЩУК, ЦТК – блокирован, накапливается ацетил-КоА, что приводит к увеличению синтеза жирных кислот, холестерина, ацетоновых тел. Вторй путь дополнительного образования ЩУК – получение его путем окислительного дезаминирования из аспарагиновой кисслоты (аспартата). Схематично: СООН | CH2
CH – NH2 окилительное | дезаминирование COOH
3.Эндокринная функция эпифиза и тимуса.Гормоны гипофиза. Передняя доля: соматотропин, пролактин (простые белки), тиреотропин, фолиторопин, лютропин (гликопротеиды), кортикотропин, липотропин (пептиды). Средняя доля: меланотропин (пептид) Задняя доля: окситоцин, возопрессин (пептиды). Соматотропин ≈200 аминокислот: 1. обладает анаболическим действием, 2. активирует: a. синтез нуклеиновых кислот, b. белков, c. коллагена, d. глюконеогенез, 3. приводит к гипергликемии, активирует синтез ГАГ 4. усиливает распад жиров на энергитические нужды Пролактин в период беременности и при лактации активируется. Стимулирует: маммогенез, лактопоэз, эритропоэз Фолитропин – определяет цикличность созревание фолликулов, выроботку эстрогенов. В мужском организме стимулирует сперматогенез. Лютропин – в женском организме способствует формированию желтого тела и выроботку прогестерона, в мужском стимулирует сперматогенез и продукцию андрогенов. Тиротропин – стимулирует развитие щитовидной железы, активирует синтез белков, ферментов. Кортикотропин – 39 аминокислот, активирует созревание надпочечников и выроботку кротикостероидов из холестерина. Гиперфункция: синдром Иценко-Кушинга, проявляется гипергликемией перераспределением жиров с накоплением их на лице и груди, гипертенизия, остеопороз. Липотропин - ≈100 аминокислот, стимулирует распад жиров, служит источником эндорфинов. Гиперфункция: гипофизарная кахексия, гипофункция: гипофизарное ожирение. К гормонам средней доли гипофиза относится – меланотропин (мелано-цито-стимулирующий) – это пептид стимулирует формирование меланоцитов и синтез в них меланина, который обладает фотопротекторным действием и является антиоксидантом. Гормоны задней доли гипофиза: вазопрессин (антидиуретический), окситоцин – гормоны являются нейросекретами синтезируются в гипоталамических ядрах, а затем перемещаются в заднюю долю гипофиза. Состоят из 9 аминокислот. Вазопрессин регулирует водный обмен усиливает реабсорбцию воды в почечных канальцах через синтез белка – аквапорина. Суживает сосуды и повышает артериальное давление. Недостаток гормона приводит к заболевнаию несахарный диабет – резко увеличивается диурез. Окситоцин стимулирует сокращение мускулатуры матки, сокращает гладкую мускулатуру молочных желез усиливая отделения молока. Активирует синтез липидов. Гормоны вилочкой железы.Тимус орган лимфопоэза, тимопоэза и орган выроботки гормонов определяющих иммунные процессы в организме. Эта железа активна в детском возрасте а к отрочеству развивается инволюция. Основные гормоны: α,β – тимозин – определяет пролиферацию Т-лимфоцитов. I, II-тимопоэтины – усиливают созревание Т-лимфоцитов, блокируют нервномышечную возбудимость Тимусный гуморальный фактор – способствует дифференцировке Т-лимфоцитов на киллеры, хелперы, супрессоры. Лимфоцито-стимулирующий гормон – усиливает образование антител. Тимусный гомеостатический гормон – является синергистом соматотропина и антогонистом кортикоторопина и гонадотропина и поэтому тормозит преждевременное половое созревание. При гипофункции тимуса развиваются имунодефицитные состояния. При гиперфункции развиваются аутоиммунные заболевания.
БИЛЕТ 15 Биосинтез РНК. Для синтеза всех видов РНК (р, т, м) используется только один тип ферментов: ДНК – зависимые РНК – полимеразы, в состав которых входит прочно связанный ион цинка. В зависимости от того, какой вид РНК синтезируется, выделяют РНК – полимеразу 1 (катализирует синтез рРНК), РНК – полимеразу 2 (мРНК) и РНК – полимеразу 3 (тРНК). В митохондриях обнаружен еще один тип – РНК – полимераза 4. 1)Используются трифосфонуклеозиды, а не ди- и не монофосфонуклеозиды. 2) Для оптимальной активности необходим ко-фактор – ион магния. 3) Фермент использует только одну цепь ДНК в качестве матрицы для синтеза комплиментарной копии РНК (почему и синтез - матричный). Последовательное присоединение нуклеотидов происходит так, что цепь наращивается от 5` к 3` концу (5` - 3` иолимеризация):
И Т.Д.
Ф – Ф – Ф – 5` Ф – Ф – Ф – 5` Ф – Ф – Ф –5`
- ПФ - ПФ 5) Для начала синтеза может использоваться затравочная порция РНК: В то же время может идти (чаще так и бывает) полимеризация без затравки, с использованием вместо затравочной порции только одного нуклеозидтрифосфата (как правило, это АТФ или ГТФ). 6) В ходе этой полимеризации фермент копирует только одну цепь ДНК и передвигается по матрице в направлении 3` - 5`. Выбор копируемой цепи не случаен. 7) Цепь матричной ДНК содержит сигналы инициации синтеза РНК для фермента, расположенные в определенных положениях перед началом гена, и сигналы терминации синтеза, расположенные вслед за концом гена или группы генов. 8) Для описанных выше процессов может потребоваться суперскрученная ДНК, что помогает узнавать сигналы инициации и терминации синтеза и облегчает связывание РНК – полимеразы с матрицей. РНК – полимераза представляет собой олигомерный фермент, ссостоящий из 5 субъединиц: альфа, альфа`, бета, бета`, гамма. Определенным субъединицам соответствуют определенные функции: например, бета – субъединица участвует в образовании фосфодиэфирной связи, гамма – субъединица участвует в распознавании стартового сигнала. Участок ДНК, отвечающий за первоначальное связывание РНК – полимеразы, называется промотором, содержит 30 – 60 пар азотистых оснований. Синтез РНК под действием ДНК – зависимой РНК – полимеразы происходит в 3 этапа: инициация, элонгация, терминация. 1)Инициация – гамма-субъединица, находясь в составе РНК – полимеразы, способствует не только «узнаванию» промоторных участков ДНК, но и непосредственно связывается в районе ТАТА – последовательности. При этом одна из цепей ДНК служит матрицей для синтеза новой цепи РНК. И как только начинается этот синтез, гамма-субъединица отделяется от фермента, и, в дальнейшем, присоединяется к другой молекуле фермента, чтобы участвовать в новом цикле транскрипции. Размер расплетенного участка ДНК постоянен в течении всего процесса и составляет около 17 пар нуклеотидов на молекулу РНК – полимеразы. Одну и ту же кодирующую цепь могут одновременно считывать несколько молекул РНК – полимеразы, но процесс отрегулирован таким образом, что в каждый данный момент каждая молекула РНК – полимеразы транскрибирует различные участки ДНК. В то же время, для ДНК – зависимой РНК – полимеразы 3, синтезирующей тРНК, характерно «узнавание» внутреннего промотора. 2)Элонгация, или продолжение синтеза осуществляется РНК – полимеразой, но уже в виде тетрамера, т.к. гамма-субъединица уже отщепилась. Новая цепь растет путем последовательного добавления рибонуклеотидов к свободной 3` - оксигруппе. 3)Терминация – здесь принимает участие белковый фактор (ро). Он не входит в состав РНК – полимеразы. Вероятно, он узнает терминаторную последовательность нуклеотидов на матрице по одному из механизмов взаимодействия гамма-субъединици и промотора. Терминатор также содержит около 30 – 60 пар нуклеотидов и заканчивается серией АТ – пар, хотя для некоторых РНК отмечено, что сигналы терминации отстоют от кодирующего гена на 1000 – 2000 оснований. При этом синтез РНК прекращается и молекула насинтезированного РНК сходит с фермента. Большая часть таким образом синтезируемых молекул РНК не является биологически активными. Скорее, они представляют собой предшественники, которые должны превратиться в зрелые формы в ходе различных реакций. Это называется процессинг. Такими реакциями являются: (1)Фрагментация длинноцепочечных предшественников (причем из одного транскрипта может образоваться от 1 до 3 тРНК). (2) Присоединение нуклеотидов к концам. (3) Специфическая модификация нуклеотидов (метилирование, сульфирование, дезаминирование и т.д.).Процессинг мРНК имеет еще одну особенность. Оказалось, что иногда информация, кодирующая АК – последовательность в генах, прерывается некодирующими последовательностями, т.е. «гены разорван». Но при транскрипции копируется весь «разорванный» ген. В этом случае при процессинге эндонуклеазы, или их называют рестриктазой, вырезают некодирующие участки (интроны). Их выделено в настоящее время более 200. Рестриктазы расщепляют связи (в зависимости от вида фермента) между строго определенными нуклеотидаами (например Г – А, Т – А и т.д.). Затем лигазы сшивают кодирующие участки (экзоны КЛАССИФИКАЦИЯ БЕЛКОВ. 1)Основанная на функциях (ферменты, гормоны, транспортные и так далее) 2) Основанная на различиях в форме белковой молекулы: а) фибриллярные (в виде нити) – например коллаген. б) глобулярные (сфера, элипс) – например, все ферменты. 3) Основана на составе белков: а) простые (состоят только из аминокислот) б) сложные (состоят из органической и неорганической группировки не пептидной природы, которая называется простетической группой, соединенных с пептидной цепью). 1)Простыебелки (протеины):1 Альбумины.2Глобулины. 3 Протамины4Гистоны.5Проламины. 6 Глютеллины.7Протеиноды. 2)Сложные белки (протеиды):. 1) Хромопротеиды – состоят из простого белка, соединенного с окрашенной простетической группой (отсюда и название: chroma - краска). Подразделяются на: а) гемопротеиды – в качестве простетической группы – гем. К этим белкам относятся: гемоглобин, миоглобин, ряд ферментов (каталаза, пероксидаза, цитохромы). Функции многообразны: участвуют в транспорте газов, окислительно-восстановительных реакциях и так далее. б) флаворотеиды – простетическую группу составляют ФАД и ФМН (производные изоаллоксазина). Это некоторые фермнты (флавиновые дегидрогеназы), катализирующие окислительно-восстановительные реакции. 2) Липопротеиды – состоят из простого белка, связанного с каким-либо липидом, представляющим простетическую группу. Это может быть нейтральный жир, свободная жирная кислота, фосфолипиды, холестерин. Липопротеиды входят в состав биомембран, миелиновых оболочек, присутствуют в свободном состоянии в плазме крови. 3) Гликопротеины – их простетическая группа представлена углеводами и их производными (глюкоза,галактоза, манноза,галактозамин, сиаловые кислоты, гликозаминогликаны). Гликопротеиды входя в состав слюны, хрящевой, костной ткани,биомембран, участвуют в иммунологических реакциях, ионном обмене и так далее. 4) Нуклеопротеиды – состоят из белков (которые, в основном, представлены протаминами и гистонами) и нуклеиновых кислот (простетическая группа). Их основная функция – хранение и передача наследственной информации. 5) Фосфопротеиды – в качестве простетической группы выступает фосфорная кислота. Большое количество этих белков содержится в ткани мозга. К фосфопротеидам относят казеин молока. Функции фосфопротеидов многообразны. Они являются донорами фосфатов в клетке, являются источниками пластического и энергетического материала. 6) Металлопротеиды – простетическая группа представлена металлами (цинк, железо, медь, кобальт и другие). К этой группе белков относятся ферритин (выполняет роль депо железа, содержится в печени, селезенке, костном мозге), трансферрин (переносчик железа), некоторые ферменты (алкогольдегидрогеназа, карбангидраза, СОД и другие). 3.флавиновые ферменты 2) ФАД и ФМН-зависимые ДГ обычно ковалентно связаны с ДГ, так что целиком весь белок называют флавопротеидом (ФП). ко-ферменты ФАД и ФМН содержат и металлы, поэтому иногда говорят: металлофлавопротеиды. Например, сукцинат-ДГ содержит железо, ксантиноксидаза – молибден. Атомы металлов, входящих в состав этих ферментов, могут легко изменять свою валентность, присоединяя или теряя электроны. ФАД и ФМН имеют следующую структуру: Флавин – рибитол – фосфорная кислота (ФМН). Флавин – рибитол – фосфорная кислота – фосфорная кислота – рибоза – аденин (ФАД) Флавин (изоаллоксазин) + рибитл = витамин В2 (рибофлавин). Этот витамин активно участвует в окислительных процессах. При недостатке витамина В12 развивается поражение кожи, глаз и т.д. При окислении какого-то субстрата, от него ходе реакции, катализируемой этими ферментами отщепляется водород и электроны, но ФАД и ФМН, присоединяя их и при этом восстанавливаясь, очень быстро отдают их на какой-акцептор. Причем, флавиновые ферменты иногда окисляют определенные субстраты (ксантин, глицерофосфат, янтарную кислоту и т.д.), а могут окислять восстановленные формы НАДН и НАДФН. Акцептором может быть кислород (в таком случае ферменты называются оксидазы, а кислород присоединяет один или два электрона), убихинон, цитохромы и т.д. рибитол фосфорная кислота рибитол фосфорная кислота CH3
N || NH || СН3 O CH3 O ФМН (фрагмент) ФМН – Н2 (фрагмент) (изоаллоксазин)
ДИНАМИЧЕСКОЕ СОСТОЯНИЕ БЕЛКОВ В ОРГАНИЗМЕ. Белки тканей организма постоянно обновляются, то есть подвергается распаду и постепенно замещаюися вновь синтезированными. В таких тканях как кровь, слизистая кишечника, печень приблизительно за 10 дней, Белки обмениваются на ½ - период полуобмена. В других тканях – кожа, мышцы период полуобмена >. Распад тканевых белков (катаболизм) осуществляют особые тканевые протеолитические ферменты катепсины. Выделяют несколько видов, которые обозначают: А, В, Д, Н, N. Катепсины локализованы как в лизосомах так и в цитозоле. Лизосомальные называются кислыми катепсинами так как оптимум рН= 4,5-5,5. Катепсины могут быть как эндопептидазами, так и экзопептидазами. В активном центре катепсинов могут присутствовать цистеин, аспарагиновая кислота, серин. Например катепсин Д по эффекту аналогичен катепсину желудочного сока, катепсин Н – печени, катепсин N – обладает калогенолитической активностью. Биороль: Ø участвует в обновлении тканевых белков Ø разрушает дефективный денатуриновый белок. Обычно эти белки вначале соединяются в особый белок убиквинтин и после этого начинается разрушение дефективных белков катепсинами Ø реконструктивная функция – катепсины переводят неактивные формы белки в активные. Ø При голодании, кровопотери, интоксикации катепсины обеспечивают мобилизацию белков из условных депо белков (плазма крови, мышцы, печень). В ткани всегда существует определенный запас аминокислот. Он поддерживается на достаточно постоянном уровне благодаря сбалансированности путей образования и использования аминокислот. Пути образования тканевых аминокислот 1. Аминокислоты всосавшиеся из кишечника в результате переваривания пищевых белков (1/3 фонда) 2. Аминокислоты, образовавшиеся при распаде белков 3. Синтез в тканях заменимых кислот Пути расходования 1. Синтез тканевых белков из пепетидов
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 157; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.64.128 (0.118 с.) |






 антикод
антикод
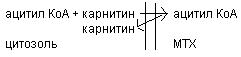

 2) nβ-циклов=(N/2)-1
2) nβ-циклов=(N/2)-1
 Очень распространен авторегуляторный механизм. Авторегуляторным механизмом является ретроингибирование, при котором продукты ферментативного процесса угнетают начальные ферменты.
Очень распространен авторегуляторный механизм. Авторегуляторным механизмом является ретроингибирование, при котором продукты ферментативного процесса угнетают начальные ферменты.



 | ЩУК
| ЩУК



 N N +2е- CH3 N NH
N N +2е- CH3 N NH














 NH NH
NH NH


