
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обезвреживание аммиака в организме, цикл мочевины.Стр 1 из 8Следующая ⇒
Билет. Витамин Д Жирорастворимый витамин, т. е. хорошо растворим в жирах и легко накапливаются в организме при избыточном поступлении с пищей. Д2 (эргокальциферол) Производные эргостеорина (растительный стероид). При облучении пищевых продуктов УФО из эргостерина получается Д2, используемый в лечебных целях. Витамин Д3 (холекальциферол) образуется в коже человека из 7-дегидрохолестерина под действием УФ лучей. Источник: сливочное масло, желток, рыбий жир. Роль: стимулирует синтез кальцийсвязывающего белка в кишечнике в местах всасывания. Белок переносит ионы кальция через мембраны эпителиальных клеток. Перенос кальция и кальцификация костей регулируется не Д3, а его метаболитом, содержащим оксигруппы в 1-м и 250м положениях – гормон кальцитрол Недостаток: рахит (нарушение кальцификации растущих костей) Избыток: отложение солей кальция в тканях легких, почек, сосудов.
Обезвреживание аммиака в организме, цикл мочевины. Основным механизмом связывания аммиака в организме является синтез мочевины. Мочевина выводится из организма с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного обмена. На долю мочевины приходится до 80-85 % от всего выводимого из организма азота. Количество выделяемой мочевины зависит от количества белков, поступающих с пищей. Если суточный рацион включает 80–100 г белка, то за сутки образуется и выводится 25–30 г мочевины. Основным местом синтеза мочевины является печень. На первом этапе из NН3 и СО2 при участии АТФ синтезируется макроэргическое соединение карбамоилфосфат:
На втором этапе цикла мочевинообразования происходит конденсация карбомоилфосфата и орнитина с образованием цитруллина. На следующей стадии вначале происходит связывание одной молекулы NН3 путем восстановительного аминирования с образованием (с затратой молекулы АТФ) аспарагиновой кислоты. Затем цитруллин и аспарагиновая кислота взаимодействуют с образованием аргининосукцината, который распадается на аргинин и фумарат при участии аргининосукцинатлиазы. Аргинин расщепляется под действием фермента аргиназы на орнитин и мочевину. Образовавшийся орнитин может вступать в следующий цикл мочевинообразования. Хотя аргинин есть во всех клетках организма человека, образование мочевины происходит исключительно в клетках печени - единственном органе, где локализован фермент аргиназа. Мочевина из клеток печени поступает в кровь и выводится из организма через почки.
Качественная и количественная реакции на НК. Качественная:
Аденин + AgNO3 + NaOH = осадок светло-коричнего цвета.
1) Гидролизат + дефиниламин = сине-зеленый р-р 2) ДНК + дефиниламин = синий р-р 3) РНК + дефиниламин = зеленый р-р 4) Гидролизат + орцин = синий р-р 5) ДНК + орцин= желтый р-р 6) РНК + орцин = зеленый р-р Количественная: Спектрометрический метод. В одну пробирку вносят о.5 мл р-ра ДНК, в другую РНК, в каждую добавляют по 1,5 мл воды и по 1,5 мл р-ра хлорной к-ты. Измеряют оптическую плотность полученных р-ров при 270 нм для последующего расчета гипохромного эффекта. Гидролизуют, охлаждают, затем измеряют плотность при 270 нм и 290 нм и рассчитывают по формуле. Х1= (Е270-Е290) * 10.1 / 0.19 (для ДНК) Х2= (Е270-Е290) * 10.5 / 0.19 (для РНК)
Х1 и х2 – концетрации ДНК и РНК; Е270- экстинция гидролизата при 270нм; Е290 - экстинция гидролизата при 290нм; 0.19 – удельная экстинция, соответствующая 1мг фосфора НК в 1 л р-ра; 10.1 и 10.5 – коэффициенты пересчета содержания фосфора на концентрацию НК, исходя из теоритического содержания фосфора в ДНК 9.9% и в РНК 9.5%.
Билет.
Растворимость радикалов аминокислот определяется полярностью функциональных групп, входящих в состав молекулы (полярные группы притягивают воду, неполярные её отталкивают). Аминокислоты с неполярными радикалами. К неполярным (гидрофобным) относят радикалы, имеющие алифатические углеводородные цепи (радикалы аланина, валина, лейцина, изолейцина, пролина и метионина) и ароматические кольца (радикалы фенилаланина и триптофана). Радикалы таких аминокислот в воде стремятся друг к другу или к другим гидрофобным молекулам, в результате чего поверхность соприкосновения их с водой уменьшается. Аминокислоты с полярными незаряженными радикалами. Радикалы этих аминокислот лучше, чем гидрофобные радикалы, растворяются в воде, так как в их состав входят полярные функциональные группы, образующие водородные связи с водой. К ним относят серии, треонин и тирозин, имеющие гидроксильные группы, аспарагин и глутамин, содержащие амидные группы, и цистеин с его тиольной группой.
Цистеин и тирозин содержат соответственно тиольную и гидроксильную группы, способные к диссоциации с образованием Н+, но при рН около 7,0, поддерживаемого в клетках, эти группы практически не диссоциируют. Аминокислоты с полярными отрицательно заряженными радикалами. К этой группе относят аспарагиновую и глутаминовую аминокислоты, имеющие в радикале дополнительную карбоксильную группу, при рН около 7,0 диссоциирующую с образованием СОО- и Н+. Следовательно, радикалы данных аминокислот - анионы. Ионизированные формы глутаминовой и аспарагиновой кислот называют соответственно глутаматом и аспартатом. Аминокислоты с полярными положительно заряженными радикалами. Дополнительную положительно заряженную группу в радикале имеют лизин и аргинин. У лизина вторая аминогруппа, способная присоединять Н+, располагается в?-положении алифатической цепи, а у аргинина положительный заряд приобретает, хуанидиновая группа, Кроме того, гистидин содержит слабо ионизированную имидазольную группу, поэтому при физиологических колебаниях значений рН (от 6,9 до 7,4) гистидин заряжен либо нейтрально, либо положительно. При увеличении количества протонов в среде имидазольная группа гистидина способна присоединять протон, приобретая положительный заряд, а при увеличении концентрации гидроксильных групп - отдавать протон, теряя положительный заряд радикала. Положительно заряженные радикалы – катионы. Билет № 13 НУКЛЕ˜ИНОВЫЕ КИСЛ˜ОТЫ (полинуклеотиды), высокомолекулярные органические соединения, обеспечивающие хранение и передачу наследственной (генетической) информации в живых организмах из поколения в поколение. В зависимости от того, какой углевод входит в состав нуклеиновой кислоты — дезоксирибоза или рибоза, различают дезоксирибонуклеиновую (ДНК) и рибонуклеиновую (РНК) кислоты. Последовательность нуклеотидов в нуклеиновых кислотах определяет их первичную структуру.
ДНК. Каждый мононуклеотид ДНК состоит из остатков фосфорной кислоты, 2-П-дезоксирибозы и пуринового или пиримидинового азотистого основания. Углеводно-фосфатный остаток одинаков во всех мономерах ДНК, азотистое основание же может быть представлено аденином (А), гуанином (Г), цитозином (Ц) или тимином (Т). В ДНК разных организмов имеется некоторое количество так называемых, минорных оснований, например 5-метил-цитозина, частично заменяющего цитозин. У высших животных и человека содержание этого основания достигает 1,5%, у высших растений 5—7%, у бактерий — не более 0,6%. В ДНК бактерий встречается также 6-метиладенин и иногда другие метилированные азотистые основания. В ДНК Т-четных бактериофагов (Т2, Т4 и Т6) цитозин полностью замещен 5-оксиметилцитозином, в ДНК вирусов SP01 и SP8 тимин замещен 5-оксиметилурацилом, а у фага PBS1 — урацилом. В мононуклоотидах 2-П-дезокси-рибоза присоединена гликозидной связью через первый углеродный атом к атому азота в 9-м положении пуринового основания (аденина или гуанина) или в 3-м положении пиримидинового основания (цитозина или тимина). Остаток фосфорной кислоты присоединен эфирной связью к 5'-му или З'-му атому углерода дезоксирибозы. Таким образом, мононуклеотидные остатки соединены между собой через фосфорную кислоту, которая соединена с 5'-С-атомом дезоксирибозы одного нуклеотида и с 3'-С-атомом дезоксирибозы соседнего нуклеотида и т. д. ДНК из различных источников отличаются друг от друга по соотношению входящих в их состав азотистых оснований, то есть по нуклеотидному составу, однако нуклеотидный состав всех ДНК подчиняется определенным закономерностям — правилам Чаргаффа, согласно которым: 1) число молекул аденина равно числу молекул тимина; 2) число молекул гуанина равно числу молекул цитозина; 3) число молекул пуриновых оснований равно числу молекул пиримидиновых оснований; 4) число 6-аминогрупп в молекуле ДНК равно числу 6-кетогрупп, то есть сумма аденин + цитознн равна сумме гуанин + тимин.
Нуклеотиды РНК состоят из сахара — рибозы, к которой в положении 1' присоединено одно из оснований: аденин, гуанин, цитозин илиурацил. Фосфатная группа соединяет рибозы в цепочку, образуя связи с 3' атомом углерода одной рибозы и в 5' положении другой. Фосфатные группы при физиологическом рН отрицательно заряжены, поэтому РНК — поли анион. РНК транскрибируется как полимер четырёх оснований (аденина (A), гуанина (G), урацила (U) и цитозина (C), но в «зрелой» РНК есть много модифицированных оснований и сахаров[11]. Всего в РНК насчитывается около 100 разных видов модифицированных нуклеотидов, из которых 2'-О-метилрибоза наиболее частая модификация сахара, а псевдоуридин — наиболее часто встречающееся модифицированное основание[12]. У псевдоуридина (Ψ) связь между урацилом и рибозой не C — N, а C — C, этот нуклеотид встречается в разных положениях в молекулах РНК. В частности, псевдоуридин важен для функционирования тРНК[13]. Другое заслуживающее внимания модифицированное основание — гипоксантин, деаминированный гуанин, нуклеозид которого носит название инозина. Инозин играет важную роль в обеспечении вырожденности генетического кода. Роль многих других модификаций не до конца изучена, но в рибосомальной РНК многие пост-транскрипционные модификации находятся в важных для функционирования рибосомы участках. Например, на одном из рибонуклеотидов, участвующем в образовании пептидной связи[ 2. Жировым обменом называют совокупность процессов переваривания и всасывания нейтральных жиров (триглицеридов) и продуктов их распада в желудочно-кишечном тракте, промежуточного обмена жиров и жирных кислот и выведение жиров, а также продуктов их обмена из организма [6]. Понятия «жировой обмен» и «липидный обмен» часто используются как синонимы, т.к. входящие в состав тканей животных и растений входят нейтральные жиры и жироподобные соединения, объединяются под общим названием липиды. Желудочное пищеварение значительно облегчает последующее переваривание жира в кишечнике. В желудке происходит частичное разрушение липопротеиновых комплексов мембран клеток пищи, что делает жиры более доступными для последующего воздействия на них липазы панкреатического сока. Кроме того, даже незначительное по объему расщепление жиров в желудке приводит к появлению свободных жирных кислот, которые, не подвергаясь всасыванию в желудке, поступают в кишечник и там способствуют эмульгированию жира. Наиболее сильным эмульгирующим действием обладают желчные кислоты, попадающие в двенадцатиперстную кишку с желчью. В двенадцатиперстную кишку вместе с пищевой массой заносится некоторое количество желудочного сока, содержащего соляную кислоту, которая в двенадцатиперстной кишке нейтрализуется в основном бикарбонатами, содержащимися в панкреатическом и кишечном соке и желчи. Образующиеся при реакции бикарбонатов с соляной кислотой пузырьки углекислого газа разрыхляют пищевую кашицу и способствуют более полному перемешиванию ее с пищеварительными соками. Одновременно начинается эмульгирование жира. Соли желчных кислот адсорбируются в присутствии небольших количеств свободных жирных кислот и моноглицеридов на поверхности капелек жира в виде тончайшей пленки, препятствующей слиянию этих капелек. Кроме того, соли желчных кислот, уменьшая поверхностное натяжение на границе раздела фаз вода -- жир, способствуют дроблению больших капелек жира на меньшие. Создаются условия для образования тонкой и устойчивой жировой эмульсии с частицами диаметром 0,5 мкм и меньше. В результате эмульгирования резко увеличивается поверхность капелек жира, что увеличивает площадь их взаимодействия с липазой, т.е. ускоряет ферментативный гидролиз, а также всасывание.
Основная часть пищевых жиров подвергается расщеплению в верхних отделах тонкой кишки при действии липазы панкреатического сока. Так называемая панкреатическая липаза проявляет оптимум действия при рН около 8,0. В кишечном соке содержится липаза, катализирующая гидролитическое расщепление моноглицеридов и не действующая на ди- и триглицериды. Ее активность, однако, невысока, поэтому практически основными продуктами, образующимися в кишечнике при расщеплении пищевых жиров, являются жирные кислоты и в-моноглицериды. Всасывание жиров, как и других липидов, происходит в проксимальной части тонкой кишки. Фактором, лимитирующим этот процесс, по-видимому, является величина капелек жировой эмульсии, диаметр которых не должен превышать 0,5 мкм. Однако основная часть жира всасывается лишь после расщепления его панкреатической липазой на жирные кислоты и моноглицериды. Всасывание этих соединений происходит при участии желчи. Небольшие количества глицерина, образующиеся при переваривании жиров, легко всасываются в тонкой кишке. Частично глицерин превращается в б-глицерофосфат в клетках кишечного эпителия, частично поступает в кровяное русло. Жирные кислоты с короткой углеродной цепью (менее 10 углеродных атомов) также легко всасываются в кишечнике и поступают в кровь, минуя какие-либо превращения в кишечной стенке. Продукты расщепления пищевых жиров, образовавшиеся в кишечнике и поступившие в его стенку, используются для ресинтеза триглицеридов. Биологический смысл этого процесса состоит в том, что в стенке кишечника синтезируются жиры, специфичные для человека и качественно отличающиеся от пищевого жира. Однако способность организма к синтезу жира, специфичного для организма, ограничена. В его жировых депо могут откладываться и чужеродные жиры при их повышенном поступлении в организм. Механизм ресинтеза триглицеридов в клетках стенки кишечника в общих чертах идентичен их биосинтезу в других тканях. Печень и жировая ткань играют наиболее важную роль в дальнейшей судьбе хиломикронов. Допускают, что гидролиз триглицеридов хиломикронов может происходить как внутри печеночных клеток, так и на их поверхности. В клетках печени имеются ферментные системы, катализирующие превращение глицерина в б-глицерофосфат, а неэтерифицированных жирных кислот (НЭЖК) -- в соответствующие ацил-КоА, которые либо окисляются в печени с выделением энергии, либо используются для синтеза триглицеридов и фосфолипидов. Синтезированные триглицериды и частично фосфолипиды используются для образования липопротеинов очень низкой плотности (пре-в-липопротеинов), которые секретируются печенью и поступают в кровь. Липопротеины очень низкой плотности (в этом виде за сутки в организме человека переносится от 25 до 50 г триглицеридов) являются главной транспортной формой эндогенных триглицеридов. Хиломикроны из-за своих больших размеров не способны проникать в клетки жировой ткани, поэтому триглицериды хиломикронов подвергаются гидролизу на поверхности эндотелия капилляров, пронизывающих жировую ткань, под действием фермента липопротеинлипазы. В результате расщепления липопротеинлипазой триглицеридов хиломикронов (а также триглицеридов пре-в-липопротеинов) образуются свободные жирные кислоты и глицерин. Часть этих жирных кислот проходит внутрь жировых клеток, а часть связывается с альбуминами сыворотки крови. С током крови покидают жировую ткань глицерин, а также частицы хиломикронов и пре-в-липопротеинов, оставшиеся после расщепления их триглицеридного компонента и получившие название ремнантов. В печени ремнанты подвергаются полному распаду. После проникновения в жировые клетки жирные кислоты превращаются в свои метаболически активные формы (ацил-КоА) и вступают в реакцию с б-глицерофосфатом, образующимся в жировой ткани из глюкозы. В результате этого взаимодействия ресинтезируются триглицериды, которые пополняют общий запас триглицеридов жировой ткани. Расщепление триглицеридов хиломикронов в кровеносных капиллярах жировой ткани и печени приводит к фактическому исчезновению самих хиломикронов и сопровождается просветлением плазмы крови, т.е. потерей ею молочного цвета. Это просветление может быть ускорено гепарином. Промежуточный жировой обмен включает следующие процессы: мобилизацию жирных кислот из жировых депо и их окисление, биосинтез жирных кислот и триглицеридов и превращение непредельных жирных кислот. Триглицериды жировой ткани подвергаются гидролизу (липолизу) под действием ферментов липаз. В жировой ткани содержится несколько липаз, из которых наибольшее значение имеют так называемые гормоночувствительная липаза (триглицеридлипаза), диглицеридлипаза и моноглицеридлипаза. Ресинтезированные триглицериды остаются в жировой ткани, способствуя таким образом сохранению ее общих запасов. Усиление липолиза в жировой ткани сопровождается нарастанием концентрации свободных жирных кислот в крови. Транспорт жирных кислот осуществляется весьма интенсивно: в организме человека за сутки переносится от 50 до 150 г жирных кислот. Связанные с альбуминами (простые растворимые в воде белки, проявляющие высокую связывающую способность) жирные кислоты с током крови попадают в органы и ткани, где подвергаются в-окислению (цикл реакций деградации жирных кислот), а затем окислению в цикле трикарбоновых кислот (цикл Кребса). Около 30% жирных кислот задерживается в печени уже при однократном прохождении через нее крови. Некоторое количество жирных кислот, не использованных для синтеза триглицеридов, окисляется в печени до кетоновых тел. Кетоновые тела, не подвергаясь дальнейшим превращениям в печени, попадают с током крови в другие органы и ткани (мышцы, сердце и др.), где окисляются до СО2 и Н2О. Триглицериды синтезируются во многих органах и тканях, но наиболее важную роль в этом отношении играют печень, стенка кишечника и жировая ткань. В стенке кишечника для ресинтеза триглицеридов используются моноглицериды, в больших количествах поступающие из кишечника после расщепления пищевых жиров. При этом реакции осуществляются в следующей последовательности: моноглицерид + жирнокислотный ацил-КоА (активированная уксусная кислотыа)> диглицерид; диглицерид + жирно-кислотный ацил-КоА > триглицерид. В норме количество триглицеридов и жирных кислот, выделяющихся из организма человека в неизмененном виде, не превышает 5% от количества жира, принятого с пищей. В основном выведение жира и жирных кислот происходит через кожу с секретами сальных и потовых желез. В секрете потовых желез содержатся главным образом водорастворимые жирные кислоты с короткой углеродной цепью; в секрете сальных желез преобладают нейтральные жиры, эфиры холестерина с высшими жирными кислотами и свободные высшие жирные кислоты, выведение которых обусловливает неприятный запах этих секретов. Небольшое количество жира выделяется в составе отторгающихся клеток эпидермиса. В процессе переваривания жиров в желудочно-кишечном тракте всасывается около 98% жирных кислот, входящих в состав пищевых жиров, и практически весь образовавшийся глицерин. Оставшееся небольшое количество жирных кислот выделяется с калом в неизмененном виде или же подвергается превращению под воздействием микробной флоры кишечника. В целом за сутки у человека с калом выделяется около 5 г жирных кислот, причем не менее чем половина их имеет полностью микробное происхождение. С мочой выделяется небольшое количество короткоцепочечных жирных кислот (уксусная, масляная, валериановая), а также в-оксимасляная и ацетоуксусная кислоты, количество которых в суточной моче составляет от 3 до 15 мг. 3). Методы очистки белков выделение и очистка белков происходят при низких температурах. На первых стадиях очистки белков целесообразно использовать методы, учитывающие какую-либо характерную особенность данного белка, например термостабильность или устойчивость в кислых растворах. Первыми методами очистки необходимо удалить из раствора основную массу балластных белков, которые значительно отличаются от выделяемого белка физико-химическими свойствами. Впоследствии применяют всё более тонкие методы очистки белка. Высаливание Метод очистки белков, основанный на различиях в их растворимости при разной концентрации соли в растворе. Соли щелочных и щёлочно-земельных металлов вызывают обратимое осаждение белков, т.е. после их удаления белки вновь приобретают способность растворяться, сохраняя при этом свои нативные свойства. Чаще всего для разделения белков методом высаливания используют разные концентрации солей сульфата аммония - (NH4)2SO4. Чем выше растворимость белка, тем большая концентрация соли необходима для его высаливания. Ультрацентрифугирование Метод разделения также основан на различии в молекулярных массах белков. Скорость седиментации веществ в процессе вращения в ультрацентрифуге, где центробежное ускорение достигает 100 000-500 000 g, пропорционально их молекулярной массе. На поверхность буферного раствора, помещённого в кювету, наносят тонкий слой смеси белков. Кювету помещают в ротор ультрацентрифуги. При вращении в кювете происходит расслоение смеси белков на отдельные фракции с разной молекулярной массой (рис. 1-56). После расслоения белковых фракций дно кюветы прокаливают иглой и по каплям собирают содержимое небольшими порциями в пробирки. Электрофорез белков Метод основан на том, что при определённом значении рН и ионной силы раствора белки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки - к катоду (-). Ионообменная хроматография Так же как и электрофорез, метод основан на разделении белков, различающихся суммарным зарядом при определённых значениях рН и ионной силы раствора. При пропускании раствора белков через хроматографическую колонку, заполненную твёрдым пористым заряженным материалом, часть белков задерживается на нём в результате электростатических взаимодействий. В качестве неподвижной фазы используют ионообменники - полимерные органические вещества, содержащие заряженные функциональные группы. Различают положительно заряженные анионообменники, среди которых наиболее часто используют диэтиламиноэтилцеллюлозу (ДЭАЭ-целлюлозу), содержащую катионные группы, и отрицательно заряженные катионообменники, например карбоксиметилцеллюлозу (КМ-цел-люлозу), содержащую анионные группы. Выбор ионообменника определяется зарядом выделяемого белка. Так, для выделения отрицательно заряженного белка используют анионообменник. Билет № 28 Билет 19. Биосинтез РНК. Матричный биосинтез РНК (транскрипция) осуществляется при участии ферментов РНК-полимераз. Этот фермент катализирует такой же тип реакции как и ДНК-полимераза (перенос нуклеозид-трифосфата на цепь РНК), но только вместо субстрата ТДФ используется УТФ. Матрицей при транскрипции является двунитевая ДНК. Вблизи активного центра РНК-полимеразы двунитевая спираль раскручивается и фермент составляет цепь РНК по считываемой информации с нити ДНК. РНК составляется по принципу комплементарности с тем отличием, что вместо тимина используется урацил и нуклеозиды, которые содержат рибозу. Инициация проходит на строго определенном участке матрицы ДНК, он называется промотор,и именно с ним происходит специфическое взаимодействие активного центра РНК-полимеразы. После чего начинается синтез цепи РНК. ДНК содержит много таких промоторов и при изменении условий РНК-полимереза может присоединяться к другому промотору. Так, при повышении температуры на 2,0-3,0 °С выше физиологического уровня РНК-полимераза присоединяется к промотору, с которого начинается считывание информации необходимой для синтеза специальных защитных белков - БТШ. Вновь синтезированная РНК еще не готова к выполнению своей функции и подвергается ряду превращений - процессингу. В нем принимают участие многие ферменты. Так, часто цепь РНК необходимо разрезать на несколько более коротких или подровнять концы, удалив лишние нуклеотиды - это осуществляют РНК-азы. Процесс транскрипции является точкой приложения многих биологически активных веществ, например антибиотиков и токсинов. Так, антибиотик рифампицин блокирует действие РНК-полимераз прокариот, а токсин бледной поганки - a-аманитин - РНК-полимеразу эукариот. Это подавляет синтез мРНК для многих жизненно важных белков.
3 ) ИССЛЕДОВАНИЕ КАТАЛИТИЧЕСКИХ СВОЙСТВ ФЕРМЕНТОВ 1. Определение начальной скорости ферментативной реакции. Каталитическая активность пероксидазы хрена определяется фотометрической регистрацией продукта окисления ортофенилендиамина, имеющего максимум поглощения при 435 нм. Ход работы. В две пробирки вносят по 0,1 мл пероксидазы (ПХ) + 0,5 мл ортофенилендиамина (ОФД), растворённого в фосфатно-цитратном буфере рН 5,0 (ФЦБ) + 3,4 мл дистиллированной воды и тщательно перемешивают. Раствор ОФД готовят перед внесением в пробирки: 4 мг ОФД растворяют при тщательном перемешивании в 10 мл ФЦБ. Содержимое пробирки №1 переливают в контрольную кювету ФЭКа, пробирки №2 – в опытную. Прибор настраивают на «0» по контрольной кювете, после чего в опытную кювету, стоящую во 2-ом кюветодержателе, добавляют 0,2 мл Н2О2 (готовят перед определением: 20 мкл 30%-ного раствора Н2О2 доводят водой до 10 мл), перемешивают наконечником и начинают записывать показатели ФЭКа при 435 нм через 10, 20, 30, 60 сек, 2, 4, 6 мин и т.д. до выхода реакции на плато. По полученным результатам строят график зависимости Е435 от времени. Рассчитать начальную скорость реакции, то есть скорость реакции в начальный период, когда количество субстрата или продукта реакции изменяется пропорционально времени (tg α). Начальную скорость реакции выразить в изменении оптической плотности продукта реакции за 1 мин. Билет 20. 1) Моносахариды – это простейшие углеводы. Они не подвергаются гидролизу – не расщепляются водой на более простые углеводы. Общая формула – Сn(H2O)n. Моносахариды представляют собой бесцветные кристаллические вещества, растворимые в воде и сладкие на вкус (фруктоза – самый сладкий сахар). Все они являются оптически активными веществами. Моносахариды являются полиоксикарбонильными соединениями, следовательно, классифицируются по числу углеродных атомов в молекуле и присутствию альдегидной или кетонной группы. Например: альдогексоза, кетопентоза. Важнейшими моносахаридами являются альдопентозы: рибоза и дезоксирибоза, которые входят в состав нуклеиновых кислот; ксилоза (древесный сахар), который является составной частью ксиланов, содержащихся в древесине,соломе. Из альдогексоз самыми распространенными являются глюкоза и фруктоза.
2) Пищевые нуклеопротеины, попадая в организм человека, в желудке отщепляют белковый компонент и денатурируют под действием HCl желудочного сока. Далее полинуклеотидная часть этих молекул гидролизуется в кишечнике до мононуклеотидов. В расщеплении нуклеиновых кислот принимают участие ДНК-азы и РНК-азы панкреатического сока, которые, будучи эндонуклеазами, гидролизуют макромолекулы до олигонуклеотидов. Последние под действием фосфодиэстераз панкреатической железы расщепляются до смеси 3'- и 5'-мононуклеотидов. Нуклеотидазы и неспецифические фосфатазы гидролитически отщепляют фосфатный остаток нуклеотидов и превращают их в нуклеозиды, которые либо всасываются клетками тонкого кишечника, либо расщепляются нуклеозидфосфорилазами кишечника с образованием рибозоили дезок-сирибозо-1-фосфата, пуриновых и пиримидиновых оснований. Пищевые пурины и пиримидины не являются незаменимыми пищевыми факторами и очень мало используются для синтеза нуклеиновых кислот тканей. В энтероцитах обнаружена высокая активность ксантиноксидазы - фермента, который большую часть пуринов, поступающих в клетки, превращает в мочевую кислоту, удаляющуюся с мочой. Пиримидиновые основания, не успевшие поступить в энтероциты, под действием микрофлоры кишечника расщепляются до NH3, CO2, β-аланина и β-аминоизобутирата. В различных клетках организма синтезируется до 90% пуриновых и пиримидиновых нуклеотидов из простых предшественников de novo. Введённые в кровь азотистые основания и нуклеозиды, а также основания и нуклеозиды, образующиеся в результате внутриклеточного разрушения нуклеиновых кислот, в небольшом количестве могут использоваться для повторного синтеза нуклеотидов по так называемым «запасным» путям.
БИЛЕТ 23 1.липиды.классификация 2.цикл трикарбоновых кислот-промежуточные и общие продукты у углеводов,белков жиров. 3 йодное и кислотное число жира
ЛИПИДЫ
Липиды делят на две основные группы: - простые (нейтральные);- сложные К простым нейтральным липидам (не содержащим атомов азота, фосфора, серы) относят производные высших жирных кислот и спиртов: глицеролипиды, воски, эфиры холестерина, гликолипиды и другие соединения. Молекулы сложных липидов содержат в своем составе не только остатки высокомолекулярных карбоновых кислот, но и фосфорную и серную кислоты. К сложным липидам относят: фосфолипиды, стероиды и гликолипиды. ПРОСТЫЕ ЛИПИДЫ
Триацилглицерины (ТАГ), молекулы, которых содержат одинаковые остатки жирных кислот, называются простыми, в противном случае — смешанными. Природные жиры и масла содержат, главным образом, смешанные триацилглицерины. Другой важной группой простых липидов являются воски. Восками называют сложные эфиры высших одноосновных карбоновых кислот и одноатомных (содержащих одну группу ОН) высокомолекулярных (с 18—30 атомами углерода) спиртов.
Воски широко распространены в природе. В растениях они покрывают тонким слоем листья, стебли, плоды, предохраняя их от смачивания водой, высыхания, действия микроорганизмов. Воска выполняют в организме преимущественно защитную функцию, которая сводится к образованию защитных покрытий. Воски — важный компонент воскового налета виноградной ягоды — прюина. Воска входят в состав жира, покрывающего кожу, шерсть, перья. СЛОЖНЫЕ ЛИПИДЫ Важнейшими представителями сложных липидов являются фосфолипиды. Молекулы фосфолипидов построены из остатков спиртов (глицерина, сфингозина), жирных кислот, фосфорной кислоты (Н3Р04), а также содержат азотистые основания (чаще всего холин [НО-СН2-СН2-(CH3)3N]+OH или этаноламин HO-CH2-CH2-NH2), остатки аминокислот и некоторых других соединений. В молекуле фосфолипидов имеются заместители двух типов: гидрофильные и гидрофобные. В качестве гидрофильных (полярных) группировок выступают остатки фосфорной кислоты и азотистого основания («голова»), а гидрофобных (неполярных) – углеводородные радикалы («хвосты»). Пространственная структура фосфолипидов.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 235; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.125.171 (0.09 с.) |

 В природе моносахариды образуются в зеленых растениях в результате фотосинтеза, который представляет собой процесс химического связывания или «фиксации» углекислого газа и воды за счет использования энергии солнечных лучей растениями. Главным источником получения моносахаридов, имеющих практическое значение, являются полисахариды. Так, глюкозу получают в большом количестве гидролизом крахмала:(С6H10O5)n + nН2О -> nС6Н12O6. Химические свойства. Для моносахаридов характерны реакции, свойственные спиртам, альдегидам и кетонам, так как в молекулах простых сахаров содержатся гидроксильные и в скрытом виде карбонильные группы. При взаимодействии моносахаридов с различными веществами реакции могут протекать: по карбонильной группе, гидроксильным группам либо с изменением углеродного скелета молекулы. 1. Альдегидная группа моносахаридов окисляется до карбоксильной группы с образованием альдоновых кислот. 2. При нагревании моносахаридов с концентрированными кислотами происходит дегидратация молекулы. Из пентоз образуется фурфурол, из гексоз – оксиметилфурфурол:
В природе моносахариды образуются в зеленых растениях в результате фотосинтеза, который представляет собой процесс химического связывания или «фиксации» углекислого газа и воды за счет использования энергии солнечных лучей растениями. Главным источником получения моносахаридов, имеющих практическое значение, являются полисахариды. Так, глюкозу получают в большом количестве гидролизом крахмала:(С6H10O5)n + nН2О -> nС6Н12O6. Химические свойства. Для моносахаридов характерны реакции, свойственные спиртам, альдегидам и кетонам, так как в молекулах простых сахаров содержатся гидроксильные и в скрытом виде карбонильные группы. При взаимодействии моносахаридов с различными веществами реакции могут протекать: по карбонильной группе, гидроксильным группам либо с изменением углеродного скелета молекулы. 1. Альдегидная группа моносахаридов окисляется до карбоксильной группы с образованием альдоновых кислот. 2. При нагревании моносахаридов с концентрированными кислотами происходит дегидратация молекулы. Из пентоз образуется фурфурол, из гексоз – оксиметилфурфурол: Моносахариды D-ряда (глюкоза, фруктоза, манноза) расщепляются при каталитическом действии ферментов дрожжей.
Моносахариды D-ряда (глюкоза, фруктоза, манноза) расщепляются при каталитическом действии ферментов дрожжей. Рис. 10-1. Переваривание нуклеиновых кислот пищи.
Рис. 10-1. Переваривание нуклеиновых кислот пищи.

 Общая формула липидов.
Общая формула липидов.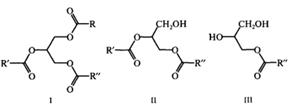


 Фосфолипиды (фосфатиды) – обязательные компоненты растений. Фосфолипиды играют важную роль в организме человека. Входя в состав клеточных оболочек, они имеют существенное значение для их проницаемости и обмена веществ между клетками и вну
Фосфолипиды (фосфатиды) – обязательные компоненты растений. Фосфолипиды играют важную роль в организме человека. Входя в состав клеточных оболочек, они имеют существенное значение для их проницаемости и обмена веществ между клетками и вну


