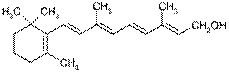Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Качественные реакции на витамины ⇐ ПредыдущаяСтр 8 из 8
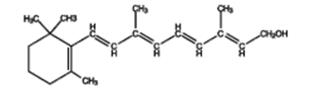
1. Качественная реакция на ретинол (витамин А) с концентрированной серной кислотой Витамин А имеет несколько витамеров, из которых наиболее распространённым является А1 (ретинол, антиксерофтальмический витамин):
Витамин А хорошо растворим в жирах и жирорастворителях: бензине, хлороформе, ацетоне и др. Предполагают, что витамин А участвует в окислительно- восстановительных процессах, входит в состав зрительного пурпура – родопсина, находящегося в палочках сетчатки и принимающего участие в процессе зрения.
Реакция Друммонда. В сухой пробирке смешивают 1 каплю рыбьего жира с 5 каплями хлороформа и добавляют 1 каплю концентрированной серной кислоты. Рыбий жир можно заменить раствором ретинола. Жидкость приобретает фиолетово-красный цвет, переходящий в бурый. Реакция с сульфатом железа (II). В пробирку к 1 капле раствора рыбьего жира или масляного раствора витамина А (ретинола) приливают 5 капель хлороформа, 5-10 капель концентрированной уксусной кислоты, насыщенной сульфатом железа (II), 1-2 капли концентрированной серной кислоты. Появляется голубое окрашивание, постепенно переходящее в красно-розовое. Каротины дают при этой реакции зеленое окрашивание.
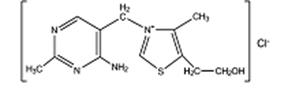
2. Качественные реакции на тиамин (витамин В1) Витамин В1 (тиамин, антиневритный витамин) является соединением, содержащим тиазоловое и пиримидиновое кольца.
Наличие серы и азота в молекуле дало основание назвать его тиамином. Витамин В1 играет важную роль в процессах превращения углеводов, так как входит в состав фермента пируватдекарбоксилазы, расщепляющего образующуюся при диссимиляции углеводов пировиноградную кислоту науксусный альдегид и СО2. Витамин В1 входит в состав пируватдекарбоксилазы в виде фосфорного эфира — тиаминпирофосфата.
1 ) Диазореакция на тиамин. Тиамин в щелочной среде с диазореактивом образует сложное комплексное соединение оранжевого цвета. К 5 каплям 1% раствора сульфаниловой кислоты прибавляют 5 капель нитрита натрия (азотистокислого натрия). Получается диазореактив. К этому реактиву добавляют на кончике стеклянной палочки небольшое количество тиамина в порошке и затем добавляют 5-7 капель 10% раствора соды. Появляется оранжевое окрашивание.
2) Реакция окисления тиамина в тиохром. Тиамин (I) под действием железосинеродистого калия окисляется в тиохром (II) — пигмент жёлтого цвета, согласно уравнению:
1 каплю 5% раствора тиамина (или небольшое количество тиамина - на кончике стеклянной палочки - растворяют в очень небольшом объёме воды) смешивают в пробирке с 5-10 каплями 10% раствора гидроксида натрия и затем добавляют 1-2 капли 5% раствора железосинеродистого калия. Нагревание смеси приводит к её окрашиванию в жёлтый цвет в результате окисления тиамина в тиохром, который в щелочном растворе при облучении ультрафиолетом обладает интенсивной синей флуоресценцией.
3. Качественная реакция восстановления рибофлавина (витамина В2) В виде фосфорного эфира рибофлавин входит в состав окислительно-восстановительных ферментов, участвующих в переносе водорода. Реакция на витамин В2 основана на его способности легко восстанавливаться:
жёлтого цвета бесцветного пробирку наливают 10 капель раствора рибофлавина, добавляют 10 капель концентрированной соляной кислоты и небольшой кусочек металлического цинка. Выделяющийся водород реагирует с рибофлавином, и раствор изменяет окраску из жёлтой в розовую, а затем обесцвечивается. При встряхивании обесцвеченный раствор вновь окисляется кислородом воздуха в рибофлавин жёлтого цвета.
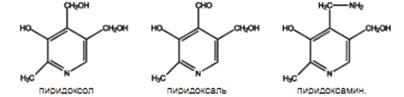
4. Феррихлоридная проба на пиридоксин (витамин В6) Активностью витамина В6 обладает группа веществ, производных пиридина и носящих общее название пиридоксин. К ним относятся отличающиеся только характером замещения радикала в 4-м положении:
Каждое из этих соединений может превратиться в фосфопиридоксаль, который является составной частью ферментов, катализирующих реакции белкового обмена: реакции переаминирования, декарбоксилирования аминокислот и некоторые другие. Витамин В6 с хлорным железом образует соединение типа фенолята железа, окрашенное в красный цвет.
К 5 каплям 1% раствора витамина В6 приливают такое же количество 1% раствора хлорного железа, перемешивают. Смесь окрашивается в красный цвет.
5. Качественные реакции на аскорбиновую кислоту (витамин С)
Витамин С (аскорбиновая кислота, антицинготный витамин) является лактоном L-дикетогулоновой кислоты. Аскорбиновая кислота в организме является участником окислительно-восстановительных систем. Аскорбиновая кислота – окисленное производное шестиатомного спирта сорбита – содержит диенольную группу —С=С—, которая обусловливает способность витамина С легко подвергаться окислению с одновременным восстановлением других соединений. Реакции на аскорбиновую кислоту основаны на её способности легко окисляться. 1) Восстановление метиленовой сини аскорбиновой кислотой. Аскорбиновая кислота (I) обесцвечивает раствор метиленовой сини (II), восстанавливая краску в лейкосоединение (III), окисляясь в дегидроаскорбиновую кислоту (IV):
В двух пробирках смешивают по 1 капле 0,01% раствора метиленовой сини и 10% раствора бикарбоната натрия, добавляя затем в одну из них 5 капель аскорбиновой кислоты, а в другую – столько же дистиллированной воды. Нагревание пробирок приводит к обесцвечиванию жидкости в пробирке с аскорбиновой кислотой.
2) Восстановление феррицианида калия аскорбиновой кислотой. Аскорбиновая кислота восстанавливает железосинеродистыи калий К3[Fe(CN)6] в железистосинеродистыи калий K4[Fe(CN)6], который образует с хлорным железом плохо растворимую в воде соль трёхвалентного железа – берлинскую лазурь тёмно-синего цвета: С6Н8О6 + 2K3[Fe(CN)6] + 2KOH → С6Н6О6 + 2K4[Fe(CN)6] + 2Н2О; 3K4[Fe(CN)6] + 4FeCl3 → Fe4[Fe(CN)6]3 + 12KCI. К 5 каплям 1% раствора витамина С приливают 1 каплю 10% раствора гидроксида натрия и 1 каплю 5% железосинеродистого калия, перемешивают, после чего добавляют 3 капли 10% раствора соляной кислоты и 1 каплю 1% раствора хлорного железа. Выпадает синий осадок берлинской лазури. Для контроля проделывают те же реакции, добавляя вместо раствора витамина С дистиллированную воду. В этом случае берлинская лазурь не образуется (отметить цвет раствора в контрольной пробирке-зеленый).
3 ) Йодная проба на аскорбиновую кислоту. Раствор йода в йодиде калия при добавлении к нему раствора аскорбиновой кислоты обесцвечивается за счёт восстановления аскорбиновой кислотой молекулярного йода и образования йодисто-водородной кислоты: С6Н8О6 + I2 → С6Н6О6+ 2HI.
В две пробирки наливают по 10 капель дистиллированной воды и по 1-2 капли раствора йода в растворе йодида калия. В одну пробирку добавляют 10 капель раствора аскорбиновой кислоты, в другую – столько же дистиллированной воды. В пробирке с аскорбиновой кислотой раствор йода обесцвечивается.
Билет № 25 . КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ВИТАМИНЫ
Задачи: проделать предложенные химические реакции; проанализировать полученные результаты и сделать вывод.
А. Качественные реакции на водорастворимые витамины а) Диазореакция на тиамин
^ Ход работы. К диазореактиву, состоящему из 5 капель 1%-го раст-вора сульфаниловой кислоты и 5 капель 1%-го раствора нитрита натрия, прибавляют 1-2 капли 5%-го раствора тиамина и затем по стенке, наклонив пробирку, осторожно добавляют 5-7 капель 10%-го раствора карбоната натрия. На границе двух жидкостей образуется оранжево-красное кольцо.
^ Ход работы. 1 каплю 5%-го раствора тиамина смешивают в пробирке с 5-10 каплями 10%-го раствора гидроксида натрия и затем добавляют 1-2 капли раствора железосинеродистого калия. При нагревании жидкость окрашивается в желтый цвет вследствие окисления тиамина в тиохром.
^ Ход работы. В пробирку наливают 10 капель 0,025%-й взвеси рибофлавина в воде, добавляют 5 капель концентрированной соляной кислоты и небольшой кусочек металлического цинка. Наблюдают бурное выделение пузырьков водорода и изменение окраски жидкости. 3. Реакции на витамин РР (никотиновую кислоту, никотинамид)
^ Ход работы. 5-10 мг никотиновой кислоты растворяют при нагревании в 10-20 каплях 10%-го раствора уксусной кислоты. К нагретому до кипения раствору добавляют равный объем 5%-го раствора ацетата меди. Жидкость становится мутной, окрашивается в голубой цвет, а при стоянии выпадает синий осадок никотината меди. б) Реакция обнаружения аминогруппы в никотинамиде
^ Ход работы. В пробирку помещают 5-10 мг порошка витамина РР, прибавляют 2 мл 0,1 М раствора гидроксида натрия и нагревают до кипения. Ощущают запах образующегося аммиака. Витамин РР восстанавливается гидросульфитом натрия с образованием соединения желтого цвета. ^ 4. Реакции на витамин В6 (пиридоксин) Активностью витамина В6 обладают три соединения, объединенных под названием “пиридоксин”:
а) Феррохлоридная проба на витамин В6. При взаимодействии пиридоксина с хлорным железом образуется комплексная соль типа фенолята железа, окрашенная в красный цвет. ^ Ход работы. В пробирку наливают 1 мл 1%-го раствора витамина В6, добавляют 2 капли 1%-го раствора хлорида железа и содержимое встряхивают. Жидкость окрашивается в красный цвет. б) Реакция осаждения витамина В6. Пиридоксин, являясь производным пиридина, осаждается фосфорномолибденовой, пикриновой, фосфорновольфрамовой кислотами и другими реактивами на алкалоиды. ^ Ход работы. К 2-3 каплям 1%-го раствора витамина В6 добавляют 2-3 капли 1%-го раствора фосфорномолибденовой кислоты и наблюдают появление осадка.
В состав витамина В12 входит кобальт. В результате взаимодействия ионов кобальта с тиомочевиной при нагревании образуется роданид кобальта зеленого цвета. ^ Ход работы 1. Содержимое одной ампулы с кобаламином переносят в пробирку, добавляют 3-5 капель концентрированной серной кислоты и нагревают до обесцвечивания в пламени спиртовки, установленной в вытяжном шкафу с включенной тягой. По окончании минерализации в пробирку осторожно, медленно, при постоянном перемешивании добавляют 1 мл дистиллированной воды.
2. На беззольный фильтр наносят 2-3 капли 10%-го раствора тиомочевины, осторожно высушивают над пламенем спиртовки. Затем наносят 1-2 капли минерализата В12 и осторожно нагревают фильтр над пламенем спиртовки. На фильтре, чаще ближе к краю, появляется зеленое окрашивание.
7. Реакции на витамин С (аскорбиновую кислоту) Все качественные реакции на аскорбиновую кислоту основаны на ее способности легко вступать в окислительно-восстановительные реакции. Окисляясь, аскорбиновая кислота превращается в дегидроаскорбиновую, восстанавливая различные соединения:
а) Реакция восстановления феррицианида калия c витамином С Аскорбиновая кислота в щелочной среде восстанавливает ферри-цианид калия (железосинеродистый калий) до ферроцианида калия (железистосинеродистого калия), который при взаимодействии с хлорным железом в кислой среде образует плохо растворимую в воде соль трехвалентного железа - берлинскую лазурь, выпадающую в осадок темно-синего цвета:
калия кислота калия
ферроцианид берлинская калия лазурь ^ Ход работы. В одну пробирку (опыт) вносят 5 капель 1%-го раствора витамина С, а в другую (контроль) - 5 капель дистиллиро-ванной воды. В обе пробирки добавляют по 1 капле 10%-го раствора гидроксида калия и 1 капле 5%-го раствора железосинеродистого калия, перемешивают, после чего добавляют по 3 капли 10%-го раствора соляной кислоты и 1 капле 1%-го раствора хлорида железа. В опытной пробирке выпадает темно-синий осадок берлинской лазури, который при осторожном наслаивании воды становится более отчетливым. Витамин С обесцвечивает раствор метиленовой сини, восста-навливая ее в лейкосоединение:
в) Йодная проба на витамин С
Раствор Люголя (раствор йода в йодиде калия) при добавлении к нему витамина С обесцвечивается вследствие восстановления молекулярного йода с образованием йодистоводородной кислоты.
При добавлении витамина С к нитрату серебра выпадает осадок в виде металлического серебра: аскорбиновая + 2АgNО3 ® 2Аg¯ + 2НNО3 + дегидроаскорбиновая ^ Ход работы. В две пробирки (опыт и контроль) вносят по 5 капель 1%-го раствора аскорбиновой кислоты; затем в опытную пробирку добавляют 1-2 капли 1%-го раствора азотнокислого серебра, а в контрольную - 1-2 капли дистиллированной воды. В опытной пробе наблюдается появление темного осадка металлического серебра. Б. Качественные реакции на жирорастворимые витамины ^ 1. Реакции на витамин А
витамин А1 (ретинол) Качественные реакции на витамин А основаны на образовании окрашенных соединений сложной структуры. а) Реакция Друммонда ^ Ход работы. В сухую пробирку вносят 1 каплю рыбьего жира и 4-5 капель хлороформа. Смесь хорошо перемешивают встряхиванием и добавляют 1 каплю концентрированной серной кислоты. Появляется сине-фиолетовое окрашивание, быстро переходящее в красно-бурое.
При взаимодействии ретинола с FeSО4 в кислой среде образуется соединение розово-красного цвета. Каротины дают в этой реакции зеленоватое окрашивание. ^ Ход работы. К 1-2 каплям рыбьего жира осторожно (работать под тягой) прибавляют 5-10 капель насыщенного раствора сульфата железа (FeSO4), приготовленного на ледяной уксусной кислоте, и добавляют 1 каплю концентрированной серной кислоты. Появляется голубое окрашивание, постепенно переходящее в розово-красное.
В результате водоотнимающего действия хлорида сурьмы (SbCl3) витамин А превращается в соединение синего цвета. Эта цветная реакция используется для количественного определения витамина А колориметрическим методом. ^ Ход работы. В совершенно сухую пробирку помещают 1 каплю рыбьего жира и 4-5 капель насыщенного (33%-го) раствора хлорида сурьмы (III) в безводном хлороформе. Появляется синее окрашивание, которое постепенно переходит в розово-фиолетовое. Внимание! Присутствие даже небольших количеств воды в пробирке может помешать протеканию реакции, так как в водных условиях хлорид сурьмы (III) легко превращается в хлороксид сурьмы, который не реагирует с ретинолом, вызывая помутнение раствора. Для устранения следов влаги в пробу можно добавить 1-2 капли уксусного ангидрида.
Получение индивидуальных белков из биологического материала (тканей, органов, клеточных культур) требует проведения последовательных операций, включающих:дробление биологического материала и разрушение клеточных мембран;фракционирование органелл, содержащих те или иные белки;экстракцию белков (перевод их в растворённое состояние);разделение смеси белков на индивидуальные белки. 1. Методы разрушения тканей Высокоэнергетические соединения. АТФ — универсальная форма химической энергии в клетке Другая распространенная группа - соединения с высокоэнергетической тиоэфирной связью - ацилтиоэфиры. Эти соединения характеризуются тем, что по крайней мере одна из входящих в состав молекулы групп имеет высокий энергетический потенциал. При переносе этой группы происходит разрыв связи, соединяющей ее с молекулой, что приводит к резкому уменьшению свободной энергии, заключенной в молекуле химического соединения. Такие связи называются высокоэнергетическими, или макроэргическими. Присоединение группы с высоким энергетическим потенциалом к молекуле-акцептору повышает уровень ее свободной энергии, переводя таким образом молекулу в активированную форму, в которой это соединение может участвовать в биосинтетических реакциях. Примерами высокоэнергетических соединений могут служить адениловые нуклеотиды (фиг. 6.1). Они играют роль переносчиков фосфорильных групп. Высокоэнергетический характер этих соединений отчетливо проявляется при гидролизе, когда фосфорильная группа переносится к акцептору— воде. Например, для АТФ
Билет № 24 Фосфолипидами называют липиды, содержащие фосфатную группу. Главная роль среди них принадлежит фосфоглицеридам, в молекуле которых одна из трех —ОН-групп глицерола этерифицирована не жирной, а фосфорной кислотой, а две другие — жирными кислотами. Молекула фосфолипидов состоит из головы, роль которой играет фосфатная группа, и двух углеводородных хвостов (остатки жирных кислот). Фосфатная голова несет электрический заряд и, следовательно, она растворима в воде; другими словами, она гидрофильна. Хвост же не растворим в воде. Это свойство молекулы, когда один ее конец растворим в воде, а другой — нет, очень важно при образовании мембран. Гликолипиды Гликолипидами называют вещества, образующиеся в результате соединения липидов с углеводами. Углеводные головы гликолипидных молекул полярны, и это определяет их роль: подобно фосфолипидам гликолипиды входят в состав мембран.
Биосинтез жирных кислот катализируется синтазой жирных кислот. Эта ферментная система локализована в цитоплазме и нуждается в качестве затравки в ацетил-КоА. В циклической реакции одна молекула удлиняется семикратно на С2-звена. В качестве конечного продукта реакции образуется анион С16-кислоты, пальмитат. Фактический субстрат реакции удлинения цепи малонил-КоА на каждой стадии конденсации отщепляет карбоксильную группу в вида СО2. Восстановителем в синтезе жирных кислот является НАДФН + Н+. В результате на синтез одной молекулы пальмитата расходуется одна молекула ацетил-КоА, 7 молекул малонил-КоА и 14 молекул НАДФН + Н+; при этом образуются 7 молекул СО2, 6 молекул H2O, 8 молекул КоА и 14 молекул НАДФ+.Жиры, поступившие в пищеварительный аппарат, распадаются на глицерин и жирные кислоты, которые потом всасываются в лимфатические сосуды и далее из лимфы переходят в кровь. Продуктом окисления жирных кислот является ацетилкоэнзим А, который затем расщепляется до двуокиси углерода и воды. Ацетилкоэнзим А является связующим звеном между углеводным и жировым обменом Уровень жирных кислот в организме регулируется как отложением (депонированием) их в жировой ткани, так и высвобождением из нее По мере увеличения уровня глюкозы в крови, жирные кислоты под влиянием инсулина, депонируются в жировой тканиВысвобождение жирных кислот из жировой ткани стимулируется адреналином, глюкагоном и соматотропым гармоном, тормозится — инсулином. 2. Кислотный гидролиз сахарозы Билет 22 1.Гетерополисахариды Полисахариды, в структуре которых характерно наличие двух или более типов мономерных звеньев, носят название гетерополисахаридов. Гликозамингликаны – линейные отрицательно заряженные гетерополисахариды. Раньше их называли мукополисахаридами, так как они обнаруживались в слизистых секретах (мукоза) и придавали этим секретам вязкие смазочные свойства. Эти свойства обусловлены тем, что гликозамингликаны могут связывать большие количества воды, в результате чего межклеточное вещество приобретает желеобразный характер. Гликозамингликаны представляют собой длинные неразветвленные цепи гетерополисахаридов, построеныые из повторяющихся дисахаридных единиц – димеров. Одним мономером этих димеров является гексуроновая (глюкуроновая, галактуроновая) кислота, вторым мономером могут быть гексозамины (глюкозамин или галактозамин), аминогруппа которых обычно ацетилирована. Основными гликозамингликанами являются: гиалуроновая кислота, хондроитинсульфаты, кератансульфаты, гепарин. Гиалуроновая кислота построена из повторяющихся единиц, включающих глюкуроновую кислоту и N - ацетилглюкозамин. Гиалуроновая кислота связывает воду, поэтому межклеточное пространство приобретает характер желеобразного «матрикса», способного поддерживать клетки. Структура гиалуроновой кислоты в виде геля является своеобразным биологическим фильтром, задерживая крупные частицы и молекулы, попавшие в организм. В клетках организма содержится специальный фермент – гиалуронидаза, который, выделяясь в межклеточное пространство, может повышать межклеточную проницаемость. Поэтому гиалуронидазу называют фактором проницаемости. В здоровом организме гиалуроновая кислота и гиалуронидаза находятся в равновесии. При некоторых заболеваниях активность фермента повышается и гиалуроновая кислота разрушается. Гиалуронидазу секретируют некоторые патогенные микроорганизмы, это способствует распространению патологического роцесса на соседние ткани. Препараты этого фермента используются в медицинской практике для рассасывания рубцов. Хондроитинсульфаты. Гепарин с остоит из повторяющихся единиц, содержащих глюкуроновую кислоту, и N – ацетилглюкозамин, сульфатированный в 4 – или 6 – положении глюкозного остатка. Гепарин – естественный антикоагулянт (противосвертывающее средство), синтезируется в печени. Он обнаруживается на поверхности многих клеток, однако является внутриклеточным компонентом тучных клеток. В отличие от остальных гетерополисахаридов, гепарин не является структурным компонентом межклеточного вещества. Он вырабатывается тучными клетками соединительной ткани и выделяется при их распаде (цитолизе) в межклеточное пространство и кровеносное русло. В крови гепарин нековалентно соединяется со специфическими белками. Комплекс гепарина с гликопротеинами плазмы прявляет противосвертывающую активность. Кератансульфаты – наиболее гетерогенные гликозамингиканы, отличаются друг от друга по суммарному содержанию углеводов и распределению в разных тканях. Кератансульфаты обнаружены в роговице глаза, хрящевой ткани, костях, межпозвонковых дисках
Метаболизм включает процессы распада веществ (катаболизм) и процессы синтеза (анаболизм) Катаболизм – это фаза, в которой происходит расщепление сложных органических молекул до более простых конечных продуктов. Углеводы, жиры и белки, поступившие извне с пищей или присутствующие в самой клетке в качестве запасных веществ, распадаются в серии последовательных реакций до таких соединений как молочная кислота, углекислый газ и аммиак. Катаболические процессы сопровождаются выделением свободной энергии, заключенной в сложной структуре органических молекул, например, АТФ, НАДФН. Анаболизм – это фаза обмена веществ, в которой из малых молекул предшественников или строительных блоков, синтезируются белки, нуклеиновые кислоты, жиры, углеводы и другие компоненты клеток. Так как биосинтез приводит к увеличению и усложнению молекул и структур, то он требует затраты свободной энергии. Источником этой энергии служат распад АТФ до АДФ и неорганического фосфора и богатые энергией водородные связи. Катаболические и анаболические процессы протекают в клетках одновременно, однако их скорости регулируются независимо. Ферментативное расщепление главных питательных веществ, которые служат клетке источником энергии (углеводы, жиры и белки) совершается постепенно через ряд последовательных реакций. В аэробном катаболизме (с участием кислорода): На первой стадии полисахариды (углеводы) распадаются до гексоз и пентоз, жиры до жирных кислот, глицерина, белки – до аминокислот. На второй стадии распада веществ все эти продукты превращаются в еще более простые соединения. Так, гексозы, пентозы и глицерин расщепляются до одного и того же промежуточного продукта ацетил коэнзима А. Аналогичные превращения претерпевают жирные кислоты и аминокислоты. Их расщепление также завершается образованием ацетилкоэнзима А. Таким образом, ацетилкоэнзим А представляет собой общий конечный продукт второй стадии катаболизма. На третьей стадии ацетильная группа ацетил КоА вступает в цикл Кребса (цикл лимонной кислоты) – общий конечный путь, на котором почти все виды клеточного топлива окисляются до углекислого газа, воды и аммиака. Анаболические пути (синтез веществ) расходятся, и образуется много разнообразных молекул. Биосинтез начинается с малых молекул предшественников и протекает также в три стадии.
При нагревании с кислотами или под действием соответ-х ферментов происходит гидролиз дисахаридов – распад на молекулы моносахаридов. Сахароза при гидролизе распадается на альфа-Д-глюкопиранозу и бета-Д-фруктофуранозу. Ход работы: в пробирку наливают 2 мл 1% р-ра сахарозы, 1 мл 10% р-ра серной кислоты и кипятят 1-2 мин. После охлаждения нейтролизуют небольшим количеством сухой соды, до тех пор пока не перестанет выделятся угл газ. Проводим реакцию Фелинга. Образовался ра-р красного цвета, реакция указывает на обр-е моносахаридов, т к сахароза не восстанавливает гидрата окиси меди.
Билет №8 Третичная структура белков Третичная структура белков - трёхмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 12108; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.236.219 (0.097 с.) |