
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Регуляция путем изменения биосинтеза ферментовСодержание книги
Поиск на нашем сайте
Рассмотренные ранее способы изменения скорости протекания реакций направлены на изменение активности уже имеющихся ферментов. Существует другой способ регуляции — изменение содержания ферментов. В организме имеются вещества, которые, присоединяясь к белку — регулятору оперона, могут изменять скорость биосинтеза белков-ферментов: наблюдается либо усиление биосинтеза ферментов (индукция генов), либо замедление (репрессия генов). Компартментализация (отделение, отсек) в клетке Этот способ регуляции характерен только для высших форм живых организмов и позволяет осуществить наиболее тонкую регуляцию метаболизма. Он направлен на снижение скорости процесса за счет разъединения субстрата с ферментами с помощью мембраны. Перенос групп атомов и субстратов осуществляется за счет челночных механизмов, переводящих субстрат в форму, которая способна проникать через мембрану. Затем по другую сторону мембраны происходит обратное их превращение в первоначальную форму. Изоферменты Изоферменты — это ферменты, катализирующие одну и ту же реакцию, но отличающиеся друг от друга по АК-составу, порядку связывания АК, электрофоретической подвижности, Км, локализации в клетке и органе. Изоферменты выполняют одинаковые биологические функции, но с различной эффективностью. Например, лактатдегидрогеназа (ЛДГ) — олигомер, состоящий из 4 протомеров одного или двух типов, обозначаемых: Н (сердце) и М (мышцы). ЛДГ существует в 5 формах, легко различающихся с помощью электрофореза. Пять изоферментов ЛДГ имеют следующий полипептидный состав: ЛДГ1 — (Н4); ЛДГ2 — (Н3М); ЛДГ3 —(Н2М2); ЛДГ4 — (НМ3); ЛДГ5 — (М4). Различные ткани человека имеют свои характерные изоферментные спектры. В сердечной мышце и почках наиболее высокой активностью обладают изоферменты ЛДГ1 и ЛДГ2. В печени и скелетной мускулатуре максимальны ЛДГ5. В селезенке, поджелудочной железе, щитовидной железе, надпочечниках - ЛДГ3. Лактатдегидрогеназа катализирует обратимое восстановление пировиноградной кислоты (ПВК) в молочную (лактат), в котором в роли восстановителя выступает НАДН + Н+. пируват + НАДН + Н+ «лактат + НАД+. В тканях, в которых преобладает аэробный распад глюкозы, присутствуют обычно ЛДГ1 и ЛДГ2, для которых характерно низкое сродство к пирувату, и поэтому они не могут эффективно конкурировать за пировиноградную кислоту с пируватдегидрогеназным комплексом. В результате пировиноградная кислота подвергается преимущественно окислительному декарбоксилированию и образующийся в этой реакции ацетил-КоА «сгорает» в цикле трикарбоновых кислот. В тканях, где доминирует анаэробный гликолиз, присутствуют изоферменты с высоким сродством к пирувату: ЛДГ4 и ЛДГ5. В этих тканях пируват расходуется преимущественно в лактатдегидрогеназной реакции. Механизм биохимической ферментативной реакции можно представить упрощенно в общем виде:
где Е — фермент; S — субстрат; ES — фермент-субстратный комплекс; Р — продукты реакции; К+1, К-1, К+2 — константы скоростей прямых и обратной реакций. Константа Михаэлиса—Ментен (Km) характеризует константу диссоциации фермент-субстратного комплекса и численно равна концентрации субстрата (в моль/л), при которой скорость данной реакции составляет 1/2 от максимальной. Она характерна для каждой пары фермент-субстратного комплекса. Уравнение Михаэлиса—Ментен выражает зависимость скорости биохимической ферментативной реакции от концентрации субстрата:
где Vбиохим.р.— скорость данной биохимической реакции, Vmax — максимальная скорость биохимической реакции, S — субстрат, Кm — константа Михаэлиса—Ментен. Анализ уравнения Михаэлиса—Ментен: 1) Если концентрация субстрата в реакции низка, т.е. [S] << Кm, то уравнение приобретает вид:
Таким образом, при низких концентрациях субстрата скорость биохимической реакции прямо пропорциональна концентрации субстрата и описывается уравнением I порядка. 2) При высоких концентрациях субстрата, т. е. [S] >> Кm, величиной Кm можно пренебречь, тогда
Таким образом, при высоких концентрациях субстрата скорость биохимической реакции становится максимальной и описывается уравнением нулевого порядка.
График зависимости скорости биохимической ферментативной реакции от концентрации субстрата
|
||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 253; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.91.223 (0.009 с.) |


 E + S
E + S  ES
ES  P + E.............................
P + E............................. 


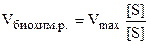 ,
, 




