
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема: пептиды, белки: их строение, свойства, значение в организме, методы исследования. Физико-химические свойства белков.Стр 1 из 16Следующая ⇒
Оглавление. Оглавление. 2 Введение. 6 Аминокислоты. 7 Структура белков. 8 Конформация белков. 8 Тема: ПЕПТИДЫ, БЕЛКИ: ИХ СТРОЕНИЕ, СВОЙСТВА, ЗНАЧЕНИЕ В ОРГАНИЗМЕ, МЕТОДЫ ИССЛЕДОВАНИЯ.ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ. 10 Пептиды.. 10 Белки.. 11 Роль белков в организме человека. 11 Методы разделения белков и пептидов: 12 Признаки коллоидного состояния. 12 Сходство растворов ВМС и коллоидных растворов. 12 Отличие растворов ВМС от коллоидных растворов. 13 Сходство растворов ВМС с ионно-молекулярными растворами.. 13 Специфические свойства растворов ВМС.. 13 Анализ мембранного равновесия Доннана. 14 ФЕРМЕНТЫ... 14 Общие черты ферментов и неорганических катализаторов. 15 Отличие ферментов от неорганических катализаторов. 15 Строение ферментов. 16 Активный центр ферментов. 16 Механизм действия ферментов. 17 Специфичность. 18 Кинетика ферментативных реакций.. 18 Ингибиторы.. 20 Определение активности фермента. 21 Классификация ферментов. 22 Тема: ФЕРМЕНТЫ, КАК БИОЛОГИЧЕСКИЕ КАТАЛИЗАТОРЫ... 26 Классификация ферментов. 26 Свойства ферментов. 28 Специфичность действия ферментов. 28 Активирование и ингибирование ферментов. 29 Регуляция путём ковалентной модификации.. 29 Путь нековалентной модификации.. 31 Типы ингибирования. 32 Конкурентное ингибирование. 32 Неконкурентное ингибирование. 32 Регуляция путем изменения биосинтеза ферментов. 33 Компартментализация (отделение, отсек) в клетке. 33 Изоферменты.. 33 Анализ уравнения Михаэлиса—Ментен: 35 Количественная характеристика активности фермента. 37 Количественная характеристика активности ферментов в биологических жидкостях. 37 Энзимодиагностика. 37 Наследственные нарушения (энзимопатии) 38 Энзимотерапия. 38 Липиды. 39 Классификация липидов. Характеристика фосфолипидов и восков. 39 Воска. 40 Фосфолипиды.. 40 Фосфатидилхолины (лецитины). 40 Фосфатидилэтаноламины. 41 Обмен липидов. 41 Ресинтез жирных кислот в стенке кишечника. 45 Транспорт липидов. 45 Цикл трикарбоновых кислот (цикл Кребса) 47 Первая реакция. 47 Вторая реакция. 47 Третья реакция. 47 Четвертая реакция. 48 Пятая реакция. 48 Шестая реакция. 48 Седьмая реакция. 49 Тема УГЛЕВОДЫ... 49 КЛАССИФИКАЦИЯ УГЛЕВОДОВ.. 50 МОНОСАХАРИДЫ. 50 Стериоизомерия моносахаридов. 50
Циклические (полуацетальные) формы моносахаридов. 51 Основные реакции моносахаридов. 53 ОЛИГОСАХАРИДЫ... 54 ПОЛИСАХАРИДЫ... 55 ГЕТЕРОПОЛИСАХАРИДЫ. 57 Промежуточный обмен углеводов в организме. 58 ВИТАМИНЫ... 60 Классификация витаминов. 62 Витамин.. 62 Активная форма. 62 Источники.. 63 Жирорастворимые витамины.. 65 Витамины группы А (ретинол, антиксерофтальмический) 65 Витамины группы К (филлохиноны, менахиноны,антигеморрагический) 67 Витамины группы Е (токоферол, антистерильный. Витамин размножения) 68 Водорастворимые витамины.. 68 Витамин В1 (тиамин, антиневрический) 68 Витамин В2 (рибофлавин, витамин роста) 69 Витамин В6 (пиридоксин, антидермический) 70 Витамин В12 (кобаламин,антианемический) 72 Витамин С (аскорбиновая кислота, антискорбутный витамин). 72 Витамин Р (рутин, цитрин, витамин проницаемости) 73 Витамин РР (никотиновая кислота, никотинамид, ниацин, антипеллагрический) 74 Химия нуклеиновых кислот. 74 Общая характеристика нуклеиновых кислот. 74 Химическое строение РНК и ДНК. 74 Структура нуклеиновых кислот. 78 Вторичная структура ДНК характеризуется правилом Э. Чаргаффа (закономерность количественного содержания азотистых оснований): 79 Тема: ОБМЕН НУКЛЕИНОВЫХ КИСЛОТ И НУКЛЕОТИДОВ В ОРГАНИЗМЕ ЧЕЛОВЕКА. 84 Этапы репликации: 85 Транскрипция. 86 Этапы транскрипции: 86 Биосинтез белка. 86 Регуляция транскрипции. Теория Оперона. 87 Тема: ЭНЕРГЕТИЧЕСКИЙ ОБМЕН. Цикл лимонной кислоты - цикл трикарбоновых кислот (ЦТК), цикл Кребса - конечный общий путь окисления белков, липидов, углеводов.ЦТК - амфиболический цикл. 87 Цикл лимонной кислоты — ЦТК — цикл Кребса. 88 Энергетическая роль ЦТК.. 88 Регуляция цикла Кребса. 88 Биоэнергетика. Биологическое окисление.. 89 Роль кислорода в метаболизме. 89 Токсичность кислорода. 89 Макроэргические молекулы.. 90 Нуклеозидтрифосфаты.. 90
Введение. Электронная версия лекций свободно распространяется среди студентов и аспирантов Сев-КавГТУ, и используется в образовательном процессе. Может быть полезна в научных работах, т.к. достаточно полно охватывает предмет биохимии. Текст проверен на орфографию в редакторе Word.
Внимание! Следует соблюдать осторожность при изменении шрифтов, отступов, стилей и других параметров, способных вызвать смещение текста. В нем находится множество схем, таблиц и рисунков которые при сдвиге распадаются на составляющие разного рода (например, графика – текс, таблица – текст и др.).
Аминокислоты. Классификация аминокислот разработана на основе химического строения радикалов. Различают циклические и алифатические (ациклические) аминокислоты. По числу аминных и карбоксильных групп аминокислоты разделяют на: 1 – моноаминомонокарбоновые (глицин, аланин, лейцин и др.); 2 – диаминомонокарбоновые (лизин, аргинин); 3 - моноаминодикарбоновые (аспарагиновая и глутаминовая кислоты); 4- диаминодикарбоновые (цистин).
По характеру заряженности боковых радикалов, их полярности аминокислоты классифицируют на: 1 – неполярные, гидрофобные (глицин, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, триптофан, тирозин); 2 – полярные, незаряженные (серин, треонин, метионин, аспарагин, глутамин, цистеин); 3 - полярные, отрицательно заряженные (аспарагиновая и глутаминовая кислоты,); 4 – полярные, положительно заряженные (лизин, аргинин, гистидин).
В α-аминокислотах можно выделить: Анионные группы: -СОО-;
NH2 Полярные незаряженные группы: -ОН; -СОNH2; -SH; Неполярные группы: -СН3, алифатические цепи, ароматические циклы (фенилаланин, тирозин и триптофан содержат ароматические циклы).
Пролин в отличие от других 19 аминокислот не аминокислота, а иминокислота, радикал в пролине связан как с α-углеродным атомом, так и с аминогруппой: α NH – CH – COOH
CH2 Аминокислоты различают по их растворимости в воде. Это связано со способностью радикалов взаимодействовать с водой (гидрироваться). К гидрофильным относят радикалы, содержащие анионные, катионные и полярные незаряженные функциональные группы. К гидрофобным относят радикалы, содержащие метильные группы, алифатические цепи или циклы. Пептидные связи соединяют аминокислоты в пептиды. α-карбоксильная группа одной аминокислоты реагирует с α-аминогруппой другой аминокислоты с образованием пептидной связи.
R1 R2 R1 R2 N-конец пептидная связь С-конец
Полипептидные цепи белков представляют собой полипептиды, т.н. линейные полимеры α-аминокислот, соединенных пептидной связью. Мономеры аминокислот, входящих в состав полипептидов, называются аминокислотными остатками. Цепь повторяющихся групп –NH-CH-CO- называется пептидным остовом. Аминокислотный остаток, имеющий свободную α-аминогруппу, называется N-концевым, а имеющий свободную α-карбоксильную группу – С-концевым. Пептиды пишутся и читаются с N-конца! Пептидные связи очень прочные, и для их химического неферментативного гидролиза требуются жесткие условия: высокие температуры и давление, кислая среда и длительное время. В живой клетке, где нет таких условий, пептидные связи могут разрываться с помощью протеолитических ферментов, называемых протеазами или пептидгидролазами. Наличие пептидных связей в белке можно определить с помощью биуретовой реакции. Свободное вращение в пептидном остове возможно между атомом азота пептидной группы и соседним α-углеродным атомом, а также между α-углеродным атомом и углеродом карбонильной группы. Благодаря этому линейная структура может приобретать более сложную пространственную конформацию.
Структура белков Первичная структура. Представляет собой линейную цепь аминокислот, расположенных в определенной последовательности и соединенных между собой пептидными связями. Первичная структура каждого индивидуального белка закодирована в молекуле ДНК (участке, называемом геном) и реализуется в ходе транскрипции (переписывании информации на м-РНК) и трансляции (синтез пептидной цепи). Конформация белков Линейные полипептидные цепи индивидуальных белков за счет взаимодействия функциональных групп аминокислот приобретают определенную пространственную трехмерную структуру, или конформацию. В глобулярных белках различают два основных типа конформации пептидных цепей: вторичную и третичную структуру. Вторичная структура белка – это пространственная структура, образующаяся в результате взаимодействий между функциональными группами аминокислот, входящих в состав белка. При этом пептидная цепь может приобретать регулярные структуры двух типов: a- спираль и b- структуры. Спирализация полипептидной цепи обеспечивается водородными связями, возникающими между амино- карбоксильными группами, пептидной связью, расположенной на противоположных витках спирали, а также гидроксильными группами тирозина и серина. Наиболее распространенной формой вторичной структуры является a- спираль (полипептидная цепь как бы накручена на воображаемый цилиндр по часовой стрелке, что обусловлено L-аминокислотным составом природных белков). Благодаря исследованиям Л. Полинга в структуре a- спиралей открыт ряд закономерностей (за это открытие Л. Полинг удостоен Нобелевской премии). На каждый виток (шаг) спирали приходится 3,6 аминокислотных остатка, шаг спирали 0,54 нм на виток, а на один аминокислотный остаток приходится 0,15 нм. Угол подъема спирали 260 , через 5 витков спирали (18 аминокислотных остатка или 2,7нм) структурная конфигурация полипептидной цепи повторяется. Не все глобулярные белки спирализованы на всем протяжении полипептидной цепи. В молекуле белка a- спиральные участки чередуются с линейными. В частности, если a- и b- цепи гемоглобина спирализованы, например, на 75%, то лизоцима – на 42%, а пепсина – всего на 30%.
Другой тип конфигурации полипептидных цепей, обнаруженный в белках волос, шелка, мышц и в других фибриллярных белках, получил название b- структуры. В этом случае две или более линейные полипептидные цепи, расположенные параллельно или, чаще, антипараллельно, прочно связываются межцепочечными водородными связями между NH- и СО-группами соседних цепей, образуя структуру типа складчатого слоя (плоская форма и похожа на меха гармошки). В природе существуют белки, строение которых, однако, не соответствует ни b-, ни a- структуре («колагеновая спираль»).Типичным примером таких белков является коллаген – фибриллярный белок, составляющий основу массы соединительной ткани в организме человека и животных. Третичная структура белка –это пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенный объем. В стабилизации пространственной структуры белков, помимо ковалентных связей (пептидные и дисульфидные), основную роль играют так называемые нековалентные связи (водородные, электростатического взаимодействия заряженных групп – т.н. солевой мостик, межмолекулярных ван-дер-ваальсовых сил, гидрофобные взаимодействия). Третичная структура белка после завершения его синтеза в рибосомах формируется автоматически, самопроизвольно и полностью предопределяется первичной структурой. Основной движущей силой в возникновении трехмерной структуры является взаимодействие радикалов аминокислот с молекулами воды. При этом неполярные гидрофобные радикалы аминокислот как бы погружаются внутрь белковой молекулы, образуя там «сухие зоны», в то время как полярные радикалы оказываются ориентированными в сторону воды. Т.о. третичная структура определяет форму белковой молекулы: - глобулярные белки (форма клубка с неровной поверхностью); - фибриллярные белки (форма вытянутых нитей, они выполняют опорные функции). Свои биологические функции белки проявляют на уровне третичной и четвертичной структуры. Четвертичная структура белка– это способ укладки в пространстве нескольких полипептидных цепей, имеющих первичную, вторичную и третичную структуры. Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных нековалентными связями. Каждая отдельно взятая полипептидная цепь, получившая название протомера, мономера или субъединицы, чаще всего не обладает биологической активностью. Эту способность белок приобретает при определенном способе пространственного объединения входящих в его состав протомеров, т.е. возникает новое качество, не свойственное мономерному белку. Образовавшуюся молекулу принято называть олигомером (или мультимером). Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами.
Пептиды Пептиды — органические молекулы, в состав которых входит несколько остатков аминокислот, связанных пептидной связью. В зависимости от количества остатков аминокислот и молекулярной массы различают:
Биологическое значение пептидов. Пептиды обладают значительной биологической активностью, являясь регуляторами ряда процессов жизнедеятельности. В зависимости от характера действия и происхождения пептиды делят на несколько групп:
Белки Белки — полимеры 22 природных аминокислот со специфической структурой. Первичная структура — последовательность аминокислотных остатков в полипептидной цепи, образуется за счет пептидных связей, возникающих за счет альфа-карбоксильной группы одной аминокислоты и альфа-аминогруппы последующей аминокислоты. Вторичная структура — способ укладки полипептидной цепи в альфа-спираль или b - структуру за счет менее прочных водородных связей (Нd+ …Оd-). Третичная структура — пространственная укладка a - спирали или полипептидной цепи в определенную конформацию за счет четырех видов связей: 1. 2. ионных (солеобразующих): —NH3 +..., 3. дисульфидных: —S—S—; 4. гидрофобных (сил Ван-дер-Ваальса). Третичная структура — субъединица. Четвертичная структура— «комплекс субъединиц способных к диссоциации, (Джон Бернал), или объединение в определенном порядке двух и большего количества субъединиц в молекулу олигомерного белка. Например, молекула гемоглобина состоит из четырех субъединиц (по 17000 Д каждая).
ФЕРМЕНТЫ
Ферменты (энзимы) – биологические катализаторы, ускоряющие химические реакции обмена веществ в организме. Катализ – это процесс изменения скорости химической реакции под действием различных веществ – катализаторов, участвующих в химическом процессе, но к концу реакции остающихся химически неизменными. Механизм действия катализаторов заключается в следующем. Молекулы вступают между собой в реакцию, если они находятся в т.н. «активном» или «возбужденном» состоянии, т.е. имеют определенный запас потенциальной энергии, которой достаточно для преодоления сил отталкивания или сцепления между ними, т.е. для преодоления «энергетического барьера». Скорость химической реакции можно увеличить 2-мя путями: - увеличить число активных молекул, сообщив определенное дополнительное количество энергии, которое называют «энергия активации». Активировать молекулы можно путем нагревания, повышения давления, облучения и т.д.; - уменьшить высоту энергетического барьера.. Сущность катализа заключается в том, что катализаторы снижают энергетический барьер, т.е. снижают уровень энергии активации реакции. Это справедливо как для неорганических катализаторов, так и для ферментов. Происходит это следующим образом. При наличии катализатора взаимодействие молекул происходит в несколько этапов. Энергетический барьер промежуточных реакций значительно ниже энергетического барьера исходной реакции.
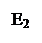
При введении катализатора:
F1 < F; Е1 < Е0
Более того, F1 + F2 < F и Е1 + Е2 < Е0, т.е. с энергетической точки зрения катализируемая реакция более выгодна, чем некатализируемая, т.к. снижается энергия активации, следовательно химическая реакция пойдет быстрее. Так, энергия активации разложения Н2О2 без катализатора составляет 75,6 кДж/моль, в присутствии неорганического катализатора (коллоидной платины) – 48,14 кДж/моль и скорость ее увеличивается в 2*104 раз. Рассмотренные закономерности неферментативного катализа справедливы и для действия ферментов. Однако, ферментативный катализ гораздо более интенсивен. Так, в присутствии фермента каталазы энергия активации разложения Н2О2 снижается до 23,1 кДж, а скорость реакции увеличивается в 2*1011 раз.
Общие черты ферментов и неорганических катализаторов : 1. Участвуют в реакции и остаются неизменными после завершения реакции (хотя в последние годы получены данные, что некоторые ферменты после реакции подвергаются модификации и даже распаду); 2. Действуют в малых количествах (например, 1 молекула фермента реннина в желудке теленка створаживает 106 молекул казеина за 10 мин.); 3. Не сдвигают химическое равновесие реакции и не влияют на величину свободной энергии.
Строение ферментов До последнего времени считалось, что абсолютно все ферменты являются веществами белковой природы. Но в 80-е годы была обнаружена каталитическая активность у некоторых низкомолекулярных РНК. Эти ферменты назвали рибозимами. Остальные, свыше 2000 известных в настоящее время ферментов, имеют белковую природу и характеризуются всеми свойствами белков. По строению ферменты делятся на: - простые или однокомпонентные; - сложные или двухкомпонентные (холоферменты). Простые ферменты представляют собой простые белки и при гидролизе распадаются только на аминокислоты. К числу простых ферментов относятся гидролитические ферменты (пепсин, трипсин, уреаза и др.). Сложные белки являются сложными белками и, помимо, полипептидных цепей содержат небелковый компонент ( кофактор ). К сложным белкам относится большинство ферментов. Белковая часть двухкомпонентного фермента называется апоферментом. Кофакторы могут иметь различную прочность связи с апоферментом. Если кофактор прочно связан с полипептидной цепью, он называется простетической группой. Между простетической группой и апоферментом – ковалентная связь. Если кофактор легко отделяется от апофермента и способен к самостоятельному существованию, то такой кофактор называется коферментом. Между апоферментом и коферментом связи слабые – водородные, электростатические и др.
Химическая природа кофакторов крайне разнообразна. Роль кофакторов в двухкомпонентных ферментах играют: 1 – большинство витаминов (Е, К, Q, С, Н, В1, В2, В6, В12 и др.); 2- соединения нуклеотидной природы (НАД,НАДФ, АТФ, КоА, ФАД, ФМН), а также целый ряд др. соединений; 3 – липолевая кислота; 4 – многие двухвалентные металлы (Мg2+, Mn2+,Ca2+и др.).
Активный центр ферментов. Ферменты – высокомолекулярные вещества, молекулярный вес которых достигает нескольких млн. Молекулы субстратов, взаимодействующих с ферментами обычно имеют гораздо меньший размер. Поэтому естественно предположить, что с субстратом взаимодействует не вся молекула фермента в целом, а только какая-то ее часть – так называемый “активный центр” фермента. Активный центр фермента – это часть его молекулы, непосредственно взаимодействующая с субстратами участвующая в акте катализа. Активный центр фермента формируется на уровне третичной структуры. Поэтому при денатурации, когда третичная структура нарушается, фермент теряет свою каталитическую активность! Активный центр в свою очередь состоит из: - каталитического центра, который осуществляет химическое превращение субстрата; - субстратного центра (“якорной” или контактной площадки), которая обеспечивает присоединение субстрата к ферменту, формирование фермент-субстратного комплекса. Четкую грань между каталитическим и субстратным центром провести можно не всегда – у некоторых ферментов они совпадают или перекрываются. Помимо активного центра, в молекуле фермента существует т.н. аллостерический центр. Это участок молекулы фермента, в результате присоединения к которому определенного низкомолекулярного вещества (эффектора), изменяется третичная структура фермента. Это приводит к изменению конфигурации активного центра и, следовательно, к изменению активности фермента. Это явление аллостерической регуляции активности фермента. Многие ферменты являются мультимерами (или олигомерами), т.е. состоят из двух и более субъединиц- протомеров (аналогично четвертичной структуре белка). Связи между субъединицами, в основном, не ковалентные. Максимальную каталитическую активность фермент проявляет именно в виде мультимера. Диссоциация на протомеры резко снижает активность фермента. Ферменты – мультимеры содержат обычно четкое число субъединиц (2-4), т.е. являются ди- и тетрамерами. Хотя известны гекса- и октамеры (6-8) и чрезвычайно редко встречаются тримеры и пентамеры (3-5). Ферменты-мультимеры могут быть построены как из одинаковых, так и из разных субъединиц. Если ферменты-мультимеры образованы из субъединиц различных типов, они могут существовать в виде нескольких изомеров. Множественные формы фермента называют изоферментами (изоэнзимами или изозимами). Например, фермент состоит из 4 субъединиц типов А и Б. Он может образовать 5 изомеров: АААА, АААБ, ААББ, АБББ, ББББ. Эти изомерные ферменты являются изоферментами. Изоферменты катализируют одну и ту же химическую реакцию, обычно воздействуют на один и тот же субстрат, но отличаются по некоторым физико-химическим свойствам (молекулярной массе, аминокислотному составу, электрофоретической подвижности и др.), по локализации в органах и тканях. Особую группу ферментов составляют т.н. мультимерные комплексы. Это системы ферментов, катализирующих последовательные стадии превращения какого-либо субстрат. Такие системы характеризуются прочностью связи и строгой пространственной организацией ферментов, обеспечивающей минимальный путь прохождения субстрата и максимальную скорость его превращения. Примером может служить мультиферментный комплекс, осуществляющий окислительное декарбоксилирование пировиноградной кислоты. Комплекс состоит из 3-х видов ферментов (М.в. = 4 500 000).
Механизм действия ферментов Механизм действия ферментов заключается в следующем. При соединении субстрат с ферментом образуется нестойкий фермент субстратный комплекс. В нем происходит активация молекулы субстрата за счет: 1. поляризации химических связей в молекуле субстрат и перераспределение электронной плотности; 2. деформации связей, вовлекаемых в реакцию; 3. сближения и необходимой взаимной ориентации молекул субстрата (S). Молекула субстрат фиксируется в активном центре фермента в напряженной конфигурации, в деформированном состоянии, что приводит к ослаблению прочности химических связей и снижает уровень энергетического барьера, т.е. субстрат активизируется.
В процессе ферментативной реакции различают 4 этапа: 1 – присоединение молекулы субстрат к ферменту и образование фермент-субстратного комплекса; 2 – изменение субстрата под действием фермента, делающее его доступным для химической реакции, т.е. активизация субстрата; 3 – химическая реакция; 4 – отделение продуктов реакции от фермента. Это можно записать в виде схемы: 1 2 3 4
где: Е – фермент, S – субстрат, S* - активизированный субстрат, Р – продукт реакции. На 1-ом этапе к субстратному центру присоединяется с помощью слабых взаимодействий та часть молекулы субстрата, которая не подвергается химическим превращениям. Для образования фермент-субстратного комплекса (ES) необходимо соблюдение трех условий, которые и определяют высокую специфичность действия фермента. Условия образования фермент-субстратного комплекса: 1 - структурное соответствие между субстратом и активным центром фермента. По выражению Фишера они должны подходить друг к другу, «как ключ к замку». Это подобие обеспечивается на уровне третичной структуры фермента, т.е. пространственного расположения функциональных групп активного центра. 2 Электростатическое соответствие активного центра фермента и субстрата, которое обусловлено взаимодействием противоположно заряженных групп. 3 Гибкость третичной структуры фермента – «индуцированное соответствие». Согласно теории вынужденного или индуцированного соответствия каталитически активная конфигурация молекулы фермента может возникать лишь в момент присоединения субстрата в результате его деформирующего воздействия по принципу «рука-перчатка». Механизм действия однокомпонентных и двухкомпонентных ферментов аналогичен. В образовании фермент-субстратного комплекса у сложных ферментов принимают участие и апофермент и кофермент. При этом субстратный центр располагается обычно на апоферменте, а кофермент принимает участие непосредственно в акте химического превращения субстрата. На последнем этапе реакции апофермент и кофермент выделяются в неизменном виде. На 2 и 3 этапе превращение молекулы субстрата связано с разрывом и замыканием ковалентных связей. После осуществления химических реакций фермент переходит в исходное состояние и происходит отделение продуктов реакции.
Специфичность Способность фермента катализировать определенный тип реакции называют специфичностью. Специфичность бывает трех видов: 1. - относительная или групповая специфичность – фермент действует на определенный вид химической связи (например, фермент пепсин расщепляет пептидную связь); 2. – абсолютная специфичность - фермент действует только на один строго определенный субстрат (например, фермент уреаза расщепляет амидную связь только в мочевине); 3. – стехиометрическая специфичность – фермент действует только на один из стереоизомеров (например, фермент глюкозидаза сбраживает только D-глюкозу, но не действует на L-глюкозу). Специфичность фермента обеспечивает упорядоченность протекания реакций обмена веществ.
Концентрация фермента Между скоростью ферментативной реакции и концентрацией фермента имеется прямопропорциональная связь.
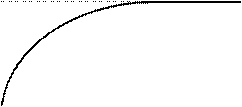
[E] Концентрация субстрата Для ферментативных реакций характерно явление насыщения фермента субстратом. Заключается оно в том, что при увеличении концентрации S скорость сначала увеличивается, достигает максимального значения при некоторой концентрации субстрата а и остается постоянной. Происходит это потому, что при концентрации а весь фермент связан в фермент-субстратный комплекс. Зависимость скорости ферментативной реакции от концентрации субстрата может быть описана уравнением:
υ = υmax/(1+ Kм/[S]), где: Км – константа Михаэлиса, которая соответствует концентрации субстрата, при которой скорость реакции равна 1/2 υmax. υ
υmax
Км [S]
υ
tº, С В интервале температур от 0 до 45-50ºС зависимость скорости реакции подчиняется правилу Вант-Гоффа (при увеличении температуры на каждые 10ºС скорость реакции увеличивается в 2-4 раза). При температуре выше 50ºС фермент начинает денатурировать, и скорость реакции снижается. При температуре выше 80ºС фермент теряет активность и при 100ºС полностью инактивируется. При температур около 0ºС фермент обычно не разрушается, но активность их падает до нуля. Температура при которой фермент наиболее активен, называют оптимумом действия фермента. Температурный оптимум действия большинства ферментов теплокровных животных – 37-40ºС, растительных ферментов – 50-60ºС.
4. рН среды Влияние изменения рН среды на молекулу фермента заключается в ионизации кислотных и основных групп активного центра, что сказывается на электростатическом соответствии между ферментом и субстратом и их способностью формировать фермент-субстратный комплекс. Значение рН при котором фермент имеет наибольшую активность называют рН оптимумом действия фермента. Для некоторых ферментов он резко выражен, для других граница рН более широкая. рН оптимум действия большинства ферментов лежит в области физиологических значений (6,0-8,0).
рНопт рН
5. Активирование ферментов Активаторы – увеличивают скорость ферментативных реакций. Активаторами могут быть вещества различной химической природы. Например, пепсин активируется НС1 панкреатическая липаза – желчными кислотами, амилаза слюны – NaCl1/ Наиболее часто активаторами ферментов являются ионы двухвалентных и иногда одновалентных металлов. Механизм активирующего действия может быть различным: 1. способствует присоединению субстрата к активному центру фермента и образованию ES-комплекса; 2. обеспечивают присоединение кофермента к апоферменту; 3. аллостерические активаторы – способствуют образованию более выгодной пространственной конфигурации активного центра; 4. активация частичным протеолизом и др.
Ингибирование. Ингибиторы – вещества, замедляющие химическую реакцию Ингибиторы ферментов также имеют различную природу и различный механизм действия. Основные виды ингибиторов: 1 – антиферменты – вещества белковой природы, образуют труднодиссоциируемые комплексы с ферментами (например, ингибиторы протеаз в растительном сырье);
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 381; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.178.133 (0.176 с.) |



 H2C CH2
H2C CH2


 водородных: Нd+ …Оd-,
водородных: Нd+ …Оd-,










 А+ В АВ Для этой некатализируемой реакции энергетический барьер F, энергия активации Е0.
А+ В АВ Для этой некатализируемой реакции энергетический барьер F, энергия активации Е0. А + К АК Энергетический барьер F1, энергия активации Е1.
А + К АК Энергетический барьер F1, энергия активации Е1. АК + В АВ + К Энергетический барьер F2< F, энергия активации Е2 < Е0.
АК + В АВ + К Энергетический барьер F2< F, энергия активации Е2 < Е0.






 E + S ES ES* EP E + P
E + S ES ES* EP E + P υ
υ


 1/2 υmax
1/2 υmax
 3. Температура. Зависимость скорости ферментативной реакции от температуры имеет следующий вид:
3. Температура. Зависимость скорости ферментативной реакции от температуры имеет следующий вид:
 t опт.
t опт.  20 40 60 80
20 40 60 80 υ
υ



