
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гистологическая классификация.Содержание книги
Поиск на нашем сайте
Диагностические мероприятия. 328.1. Детальный сбор анамнеза с особым вниманием к наличию симптомов интоксикации и темпу роста лимфатических узлов. Тщательное пальпаторное обследование всех групп периферических лимфатических узлов (подчелюстных, шейно-надключичных, подключичных, подмышечных, подвздошных, паховых, бедренных, локтевых, затылочных, кубитальных, брахиальных, подколенных), печени, селезенки. Осмотр ЛОР-врача (состояние небных миндалин и носоглотки) + фибролярингоскопия. УЗИ: всех групп периферических лимфатических узлов, включая шейные, над- и подключичные, подмышечные, паховые, бедренные; брюшной полости с исследованием печени, селезенки, парааортальных, подвздошных лимфатических узлов, мезентериальных. Компьютерная томография шеи, органов грудной клетки и брюшной полости, малого таза. Сцинтиграфия с галлием при лимфомах высокой степени злокачественности. Остеосцинтиграфия (по показаниям). Рентгенография костей при наличии жалоб у больного на боли, а также при выявлении изменений на сцинтиграммах. Группа крови и резус-фактор. Общий анализ крови, включая содержание эритроцитов, гемоглобина, тромбоцитов, лейкоцитарную формулу, СОЭ. Биохимическое исследование крови: креатинин, мочевина, билирубин, общий белок, альбумин, АСТ, АЛТ, ЛДГ, щелочная фосфатаза, K, Na, Ca, мочевая кислота (при агрессивном типе лимфом). Биопсия костного мозга (трепанобиопсия крыла подвздошной кости) и миелограмма. Цитологического исследования недостаточно. Анализ крови на ВИЧ, гепатит В и С (при планировании лечения с ритуксимабом). 328.2. При некоторых особых клинических вариантах НХЛ требуется проведение специфических дополнительных методов обследования. При поражении оболочек спинного и головного мозга: осмотр невролога; люмбальная пункция с определением клеточности ликвора, цитологическое и биохимическое исследование; КТ или МРТ головного и/или уровня поражения спинного мозга. При первичном поражении одного из отделов желудочно-кишечного тракта дополнительно должны быть обследованы все его отделы. При поражении яичка: УЗИ второго яичка; люмбальная пункция. Следует отметить, что риск поражения центральной нервной системы увеличивается при массивном поражении средостения, яичек, придаточных пазух, лейкемической трансформации костного мозга, лимфоме из клеток мантии, лимфобластной лимфоме и лимфоме Беркитта. В этих случаях всегда следует обсуждать вопрос о диагностической люмбальной пункции с одновременным введением метотрексата, цитарабина и дексаметазона.
Дополнительному исследованию должны быть подвергнуты органы, со стороны которых больной испытывает дискомфорт. Лечение НХЛ. Выбор тактики лечения больных НХЛ определяется на основании уточнения специфического типа лимфомы с учетом при необходимости клеточного подварианта опухоли, локализации очагов поражения. 329.1. Основным методом лечения НХЛ является химиотерапия, применяемая в виде комбинаций различных цитостатических препаратов. Лечение чаще всего проводится короткими курсами с интервалами 2–3 недели. Для определения чувствительности опухоли к каждому конкретному виду химиотерапии необходимо провести не менее двух циклов лечения. При отсутствии эффекта после двух циклов обоснован переход на другой режим химиотерапии. Изменение режима химиотерапии требуется и в ситуации, если после значительного уменьшения размеров лимфатических узлов после очередного курса лечения происходит их увеличение в интервале между курсами, что должно рассматриваться как резистентность опухоли к использовавшейся комбинации цитостатиков. При неэффективности стандартных режимов химиотерапии всегда следует обсуждать вопрос о возможности проведения высокодозной химиотерапии с трансплантацией стволовых гемопоэтических клеток. 329.2. Критерии оценки эффекта терапии. 329.2.1. Полная регрессия: - полное исчезновение всех ранее выявляемых клинически и рентгенологически проявлений заболевания и нормализация всех биохимических отклонений, включая ЛДГ; - все лимфоузлы должны регрессировать до нормального размера (< 1,5 см в наибольшем поперечном измерении для лимфоузлов размером более 1,5 см до начала лечения); пораженные лимфоузлы размером 1,1-1,5 см в наибольшем поперечном измерении должны уменьшиться до < 1 см или более чем на 75% от суммы измерений пораженных узлов; - селезенка, увеличенная до начала лечения, должна уменьшиться до нормальных размеров;
- пораженный костный мозг до начала лечения должен быть интактным при повторном выполнении биопсии из того же места, что и до начала лечения; проточная цитометрия, молекулярные или генетические методы не рассматриваются как рутинная оценка состояния костного мозга и могут использоваться только в рамках клинических исследований; 329.2.2. Неподтвержденная полная регрессия: - остаточные лимфоузлы размером более 1,5 см, которые уменьшились в размерах в процессе лечения более чем на 75%; - неопределенное состояние костного мозга (увеличение количества и размеров агрегатов без цитологическй или архитектурной атипии). 329.2.3. Частичная регрессия: - уменьшение более чем на 50% суммы наибольших размеров, по крайней мере, 6 опухолевых очагов; если очаг один, то его наибольший поперечный диаметр должен уменьшиться, по крайней мере, на 50%; - не должно быть новых очагов, ни один из старых очагов не должен увеличиться в размерах; - размеры печени и селезенки должны уменьшиться до нормальных; - размеры узлов в печени и селезенке должны уменьшиться более чем на 50%; - оценка состояние костного мозга не имеет значения, поскольку это является неизмеримым проявлением болезни; 329.2.4. Стабилизация болезни: - меньше чем частичная регрессия (см. выше) при отсутствии данных за прогрессирование заболевания (см. ниже). 329.2.5. Прогрессирование заболевания: - появление нового очага поражения или увеличение более чем на 50% ранее определяемого очага поражения; - увеличение более чем на 50% наибольшего диаметра любого ранее определяемого очага поражения размером более 1 см в поперечном измерении. Примечание: КТ-исследование должно быть выполнено не позднее чем через 2 месяца после завершения лечения. Повторное исследование костного мозга необходимо выполнять только у больных с исходным поражением костного мозга для подтверждения полной ремиссии или по клиническим показаниям в связи с выявлением «новых» отклонений в общем анализе крови или мазке крови. Фолликулярная лимфома. Степень злокачественности фолликулярной лимфомы определяется подсчетом числа бластов в 10 полях зрения при большом увеличении микроскопа (объектив х40). Grade 1. 0-5 центробластов в поле зрения. Grade 2. 6-15 центробластов в поле зрения. Grade 3. более 15 центробластов в поле зрения: 3а. имеются центроциты; 3b. нет центроцитов, имеются поля центробластов. Фолликулярная лимфома Grade 3 рассматривается как агрессивная лимфома и лечится по протоколу диффузной В-крупноклеточной лимфомы. 330.1. Международный прогностический индекс для фолликулярной лимфомы (FLIPI-1) (таблица 156). Таблица 156
Каждый параметр оценивается в 1 балл: низкий риск – 0-1 балл, промежуточный риск – 2 балла, высокий риск – 3-5 баллов. 330.2. Стадия I-II (Grade I и Grade II). Для небольшого числа больных с ограниченными I–II стадиями заболевания потенциально излечивающей может быть лучевая терапия, которую следует проводить расширенными полями. Режим облучения: разовая доза 1,8 Гр 5 раз в неделю, суммарная доза – 30-40 Гр. При наличии большого объема опухоли (размер отдельных лимфатических узлов более 10 см) лечение начинают с химиотерапии, используя режимы, применяемые при распространенных формах заболевания. После 4–6 курсов химиотерапии проводится облучение зон поражений и смежных областей в суммарной очаговой дозе 36 Гр.
330.3. III–IV стадии (Grade I и Grade II). Для большей части пациентов с распространенными III и IV стадиями излечивающей терапии в настоящее время не существует. Поскольку естественное течение болезни характеризуется спонтанными регрессиями до 25% случаев, химиотерапию следует начинать только при появлении В-симптомов, поражении костного мозга, наличии большого объема опухоли, компрессии жизненно важных органов, появлении плеврита/асцита. В 4-х рандомизированных исследованиях показано, что раннее начало лечения у асимптоматических больных не приводит к повышению выживаемости. Если целью терапии являются полная ремиссия или длительная безрецидивная выживаемость терапией выбора служат ритуксимаб в комбинации с химиотерапевтическими режимами: СHОР, СVР, FC или FM. Химиотерапия проводится до достижения максимального эффекта, и затем проводятся два дополнительных курса. Монотерапия моноклональными антителами (ритуксимаб) или монотерапия алкилирующими препаратами (хлорамбуцил) является альтернативой для пациентов низкого риска или при наличии противопоказаний к проведению более интенсивной химиоиммунотерапии. При наличии противопоказаний к проведению комбинированной химиотерапии может использоваться монохимиотерапия хлорамбуцилом. 330.4. Рецидив заболевания. Для исключения вторичной трансформации в агрессивную лимфому рекомендовано выполнение повторных биопсий. Выбор терапии второй линии зависит от эффективности предшествующего режима. При ранних рецидивах (<12 месяцев), предпочтительно применение схем химиотерапии, не обладающих перекрестной резистентностью (например, FCM после СНОР). Повторное использование ритуксимаба во второй линии рекомендуется в случае длительности первой ремиссии более 6 месяцев после использования препарата в первой линии. У пациентов с полной или частичной регрессией после проведения химиотерапии поддерживающая терапия ритуксимабом продолжительностью до 2-х лет не обладает выраженными побочными эффектами и, как показал системный мета-анализ, существенно увеличивает время до прогрессирования и показатель общей выживаемости. Может быть рассмотрено применение потенциально излечивающей трансплантации аллогенных стволовых клеток (в том числе с режимами кондиционирования пониженной токсичности).
При лечении хлорамбуцилом не исключается одновременное применение преднизолона. В качестве самостоятельного метода лечения у больных фолликулярными лимфомами с распространенными стадиями болезни может использоваться гормонотерапия преднизолоном (метилпреднизолоном), который назначается короткими курсами 7-14 дней в дозе 30-60 мг/м2 внутрь с быстрой отменой в течение 3-4 дней. Повторяют лечение каждые 3-4 недели. Мантийно-клеточная лимфома. Составляет 4-10% от всех вариантов НХЛ. Диагностируются, как правило, в распространенных стадиях с экстранодальным поражением, в том числе костного мозга, желудочно-кишечного тракта и центральной нервной системы. Возможен переход в лейкемическую (бластоидную) форму течения. Эта лимфома имеет неблагоприятный прогноз, стандартные терапевтические подходы не разработаны. При локальных стадиях заболевания допустимо использование только лучевого лечения. Облучение проводится на зоны поражения и смежные области в суммарной очаговой дозе 40 Гр, разовая доза 1,8 Гр с ритмом облучения 5 раз в неделю. Лечение больных с распространенным процессом начинается с химиотерапии по схемам EPOCH, DA-EPOCH или СНОР 6 – 8 курсов. Лучевая терапия после завершения химиотерапии проводится только на зоны с неполной регрессией опухоли и на очаги с исходно большой опухолевой массой в СОД 36-40 Гр. У всех больных независимо от стадии, при достижении полной ремиссии, необходимо обсуждать вопрос о проведении высокодозной терапии с целью консолидации. Для лечения больных старше 70 лет с тяжелым общим состоянием допустимо использование монотерапии кладрибином, флударабином или режима CVP. Лимфома Беркитта. Среди всех вариантов НХЛ этот тип опухоли составляет 2%. Отличается крайне агрессивным течением, наиболее частой локализацией опухоли у заболевших европейцев (спорадический тип) являются абдоминальные лимфатические узлы и толстая кишка с вторичным вовлечением мезентериальных лимфатических узлов, яичников, почек, молочных желез. Поражение костного мозга наблюдается примерно у 20% больных, центральной нервной системы – в 60-70% случаев. 339.1. Клиническая классификация лимфомы Беркитта (Jude/Murphy, 1980) (таблица 157). Таблица 157
339.2. Основным методом лечения лимфомы Беркитта является химиотерапия. К обязательным компонентам лечения относится профилактика поражения ЦНС, исключение составляют больные I стадии, а также случаи после радикального удаления интраабдоминальных опухолей. Учитывая неблагоприятный прогноз и склонность к ранней диссеминации, при лечении лимфомы Беркитта используется многокомпонентная химиотерапия с соблюдением принципов лечения острого лимфобластного лейкоза и использования высоких доз метотрексата. 339.3. При отсутствии соматических противопоказаний лечение осуществляется по модифицированному протоколу NHL-BFM для зрелых В-клеточных лимфом. Лечение должно начинаться как можно быстрее с момента установления диагноза. При локализации опухоли в брюшной полости производится максимально возможная циторедуктивная операция. Химиотерапия состоит из альтернирующих блоков, повторяемых каждые 3 недели. 339.3.1. Число блоков зависит от группы риска (таблица158). Таблица 158
339.3.2. Больные группы риска 1 получают два блока химиотерапии А-В. У больных группы риска 2 химиотерапия состоит из 4-х блоков: АА-ВВ-АА-ВВ. Больные группы риска 3 получают шесть блоков: АА-ВВ-АА-ВВ-АА-ВВ (рисунок 22).
Рисунок 22. Общий план лечения больных лимфомой Беркитта в зависимости от группы риска
339.3.3. При отсутствии эффекта на проводимую терапию (уменьшение опухолевой массы менее чем на 70% после 2-х блоков химиотерапии, прогрессирование процесса) дальнейшая терапия проводится по схеме: СС-АА-ВВ-СС. При отсутствии эффекта на блок СС обсуждается вопрос о проведении высокодозной химиотерапии с трансплантацией стволовых гемопоэтических клеток. 339.3.4. Перед началом основной химиотерапии всем больным с целью предупреждения синдрома лизиса опухоли обязательно проводится циторедуктивная предфаза (V) на фоне гидратации (1,5-2 л/м2), одновременно больные получают аллопуринол в дозе 560 мг в первые два дня и затем по 300 мг ежедневно. Предфаза (V): Циклофосфамид 200 мг/м2 внутривенно в течение 60 мин 1, 2, 3, 4, 5-й дни. Дексаметазон 16 мг внутрь 1, 2, 3, 4, 5-й дни. Дексаметазон (4 мг), метотрексат (15 мг), цитарабин (40 мг) интратекально 1 день. 339.3.5. Основные блоки химиотерапии начинаются сразу же после завершения предфазы. Введение цитостатиков осуществляется на фоне непрерывной гидратации (1,5-2 л/м2). При введении метотрексата помимо гипергидратации (инфузионная терапия 3 л/м2 в/в, прегидратация осуществляется не менее 6 ч) проводится ощелачивание мочи под контролем рН, который должен быть на уровне ³7,4 в течение всего периода введения и выведения препарата. Скорость инфузии метотрексата: в течение первых 30 мин вводится 10% от расчетной дозы препарата, затем в течение 23,5 ч вводится оставшаяся расчетная доза. В первом блоке АА доза метотрексата может быть снижена до 500 мг/м2 у больных старше 50 лет или при ограничении функции почек или при наличии у больных серозного выпота (асцит, плеврит). Через 42 ч от начала введения метотрексата начинается введение антидота – кальция фолината каждые 6 ч. Доза кальция фолината корригируется в зависимости от скорости выведения метотрексата (уровень метотрексата в сыворотке крови (рисунок 23). За 30 минут до начала каждого введения цитарабина в дозе 2 г/м2 (блок СС) показано внутривенное введение пиридоксина гидрохлорида в дозе 150 мг/м2, в дни введения цитарабина в указанной выше дозе обязательно назначаются глазные капли с кортикостероидами 6 раз в день, и физиологическим раствором в виде глазных капель, которые чередуются с каплями с кортикостероидами – 6 раз в день.
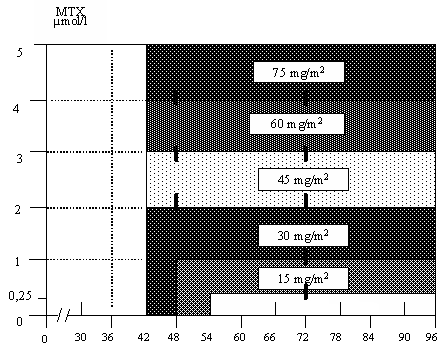
Рисунок 23. Схема назначения антидота – кальция фолината в зависимости от уровня МТХ в сыворотке крови
При проведении курсов химиотерапии обязательно назначение сопроводительной терапии: амоксициллин/клавулоновая кислота (по 375 мг 3 раза в день) или амоксициллин (по 500-750 мг 2 раза в день); ко-тримоксазол (по 480 мг 2 раза в день три дня в неделю); флуконазол (150 мг 1 раз в день). Профилактика мукозита осуществляется обработкой полости рта антисептическими растворами. Противовирусные препараты назначаются у всех пациентов с позитивной серологией Herpes Simplex и при неясных инфекционных состояниях. Рекомендуется также назначение внутривенного иммуноглобулина 1 раз в 3 недели в дозе 0,1-0,2 мг/кг. При развитии фебрильной нейтропении лечение проводится в соответствии с алгоритмами лечения данного состояния и результатами клинико-лабораторных исследований. 339.3.6. Блок А: Дексаметазон 10 мг/м2/день внутрь 1, 2, 3, 4, 5 дни. Этопозид 100 мг/м2 внутривенно в течение 60 мин 4, 5 дни. Цитарабин 150 мг/м2 внутривенно в течение 60 мин каждые 12 часов (всего 4 дозы) 4, 5 дни. Метотрексат 500 мг/м2 внутривенная 24-часовая инфузия 1-й день. Кальция фолинат 15 мг/м2 внутривенно струйно на 42, 48 и 54 ч от начала инфузии МТХ (с учетом режима выведения, рисунок 16). Ифосфамид 800 мг/м2 внутривенно в течение 60 мин 1, 2, 3, 4, 5 дни. Месна 200 мг/м2 внутривенно струйно (до введения ифосфамида, на 4 и 8 ч от начала введения ифосфамида). Mетотрексат (15 мг), цитарабин (40 мг), дексаметазон (4 мг) интратекально 1-й день. 339.3.7. Блок В: Дексаметазон 10 мг/м2 внутрь 1,2,3,4,5 дни. Винкристин 1,5 мг/м2 (max 2 мг) внутривенно струйно 1-й день. Доксорубицин 25 мг/м2 внутривенно в течение 60 мин 4,5 дни. Метотрексат 500 мг/м2 внутривенная 24-часовая инфузия 1-й день. Кальция фолинат 15 мг/м2 внутривенно струйно на 42, 48 и 54 ч от начала инфузии МТХ (с учетом режима выведения, рисунок 16). Циклофосфамид 200 мг/м2 внутривенно в течение 60 мин 1, 2, 3, 4, 5 дни. Mетотрексат (15 мг), цитарабин (40 мг), дексаметазон (10 мг) интратекально 1-й день. 339.3.8. Блок АА: Дексаметазон10 мг/м2 внутрь 1,2,3,4,5 дни. Винкристин 1,5 мг/м2 (max 2 мг) внутривенно струйно 1-й день. Этопозид 100 мг/м2 внутривенно в течение 60 мин 4, 5 дни. Цитарабин 150 мг/м2 внутривенно в течение 60 мин каждые 12 часов (всего 4 дозы) 4, 5 дни. Метотрексат 3000 мг/м2 внутривенная 24-х часовая инфузия 1-й день. Кальция фолинат 30 мг/м2 внутривенно струйно на 42, 48, 54, 60, 66, 72 ч от начала инфузии МТХ (с учетом режима выведения, рисунок 16). Ифосфамид 800 мг/м2 внутривенно в течение 60 мин 1, 2, 3, 4, 5 дни. Месна 200 мг/м2 внутривенно струйно (до введения ифосфамида, на 4 и 8 ч от начала введения ифосфамида). Mетотрексат (7,5 мг), цитарабин (20 мг), дексаметазон (2 мг) интратекально 1, 5 дни. 339.3.9. Блок ВВ: Дексаметазон 10 мг/м2 внутрь 1, 2, 3, 4, 5 дни. Винкристин 1,5 мг/м2 (max 2 мг) внутривенно струйно 1-й день. Доксорубицин 25 мг/м2 внутривенно в течение 60 мин 4, 5 дни. Метотрексат 3000 мг/м2 внутривенная 24-х часовая инфузия 1-й день. Кальция фолинат 30 мг/м2 внутривенно струйно на 42, 48, 54, 60, 66, 72 ч от начала инфузии МТХ (с учетом режима выведения, рисунок 16). Циклофосфамид 200 мг/м2 внутривенно в течение 60 мин 1, 2, 3, 4, 5 дни. Mетотрексат (7,5 мг), цитарабин (20 мг), дексаметазон (2 мг) интратекально 1,5 дни. 339.3.10. Блок CС: Дексаметазон 20 мг/м2 внутрь 1,2,3,4,5 дни. Винкристин 1,5 мг/м2 (max 2 мг) внутривенно струйно 1-й день. Цитарабин 2 г/м2 внутривенно в течение 3-х часов каждые 12 часов (всего 4 дозы) 4,5 дни. Этопозид 150 мг/м2 внутривенно в течение 60 мин 1,2 дни. Mетотрексат (7,5 мг), цитарабин (20 мг), дексаметазон (2 мг) интратекально 1,5 дни. Гистологическая классификация. Диагноз заболевания устанавливается на основании морфологического исследования опухолевой ткани. Для гистологической диагностики рекомендуется проводить эксцизионную биопсию лимфоузла. На исследование берется самый ранний из появившихся лимфатических узлов, который удаляется полностью. При удалении узел не должен быть поврежден механически. Нежелательно для гистологического исследования использовать паховые лимфатические узлы, если имеются вовлеченные в процесс другие группы лимфатических узлов. Пункционная биопсия для верификации диагноза у первичных больных недостаточна. Однако у пациентов, требующих немедленного лечения, допустимо на первом этапе руководствоваться результатами цитологического исследования. Проводится гистологическое исследование и иммунофенотипирование опухоли, а также молекулярно-генетическое исследование. Иммунофенотипирование опухоли может проводиться с помощью проточной цитометрии или иммуногистохимических методов. Преимуществом проточной цитометрии является возможность быстрого получения результата и оценка большого числа антигенов, недостаок метода – отсутствие корреляции с гистоархитектурой и клеточными характеристиками опухоли. Преимуществом иммуногистохимического исследования является возможность оценки экспрессии антигенов с учетом морфологических признаков, также иммуногистохимическое исследование позволяет работать с фиксированной и архивной тканью (из парафиновых блоков). 326.1. Для иммуногистохимического исследования (на срезах из парафиновых блоков) рекомендуется следующий набор антител: CD1a, CD2, CD3, CD4, CD5, CD7, CD8, CD10, CD15, CD20, CD21, CD23, CD30, CD43, CD45, CD56, CD68, CD79A, CD138, CD246 (ALK), bcl-2, bcl-6, PAX5, EMA, cyclin D1, TdT, Ki 67, MPO, EBV, Fascin, granzyme B, Ig легких и тяжелых цепей. Целью иммунофенотипирования является определение линейной принадлежности опухоли (В- или Т-клеточной), а также уровня нарушения клеточной дифференцировки и сродства опухолевой ткани определенной анатомической зоне нормального лимфатического узла. Этот метод исследования рассматривается как наиболее высокоинформативный компонент комплексной диагностики НХЛ. 326.2. В настоящее время в клинической практике для характеристики вариантов НХЛ используется классификация Всемирной организации здравоохранения (ВОЗ) 2008 года (таблица 143). Назначение проведения иммуногистохимического исследования и количество используемых маркеров в каждой конкретной ситуации определяет морфолог и только на основании данных световой микроскопии микропрепаратов, окрашенных гематоксилином и эозином, с учетом результатов клинико-лабораторных исследований. В каждом конкретном случае нет необходимости использовать полный набор иммуногистохимических маркеров. Назначение молекулярно-генетического исследования также проводится морфологом, который интерпретирует полученные данные с результатами морфологии и иммунофенотипа и дает последующее заключение. Молекулярно-генетическое исследование выполняется только высококвалифицированными специалистами и может проводиться только в условиях лабораторий, оснащенных специальным оборудованием. Классификация ВОЗ неходжкинских лимфом (2008 год) (таблица 143).
Таблица 143
326.3. Иммунофенотипирование и генетическое исследование для дифференциальной диагностики лимфом из мелких (зрелых) В-лимфоцитов (таблица 144) Таблица 144
Иммунофенотипирование и генетическое исследование для дифференциальной диагностики лимфом из средних В-лимфоцитов (таблица 145). Таблица 145
Иммунофенотипирование и генетическое исследование для дифференциальной диагностики лимфом из крупных В-лимфоцитов (таблица 146). Таблица 146
Иммунофенотипирование и генетическое исследование для дифференциальной диагностики лимфом из крупных нецентрофолликулярных/постцентрофолликулярных В-лимфоцитов (таблица 147) Таблица 147
Иммунофенотипирование и генетическое исследование для дифференциальной диагностики В-клеточных лимфом кожной локализации (таблица 148) Таблица 148
|





