Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Любое избыточное количество сахара, съеденного животным и не израсходованное сразу на энергетические нужды, быстро превращается в жиры.Содержание книги
Поиск на нашем сайте
Фосфолипиды - сложные соединения глицерина и жирных кислот, которые содержат остаток фосфорной кислоты. Фосфолипиды имеют полярную (гидрофильную) головку и неполярные (гидрофобные) хвосты, что и определяет их ключевую роль в организации биологических мембран. Гликолипиды – соединения липидов с углеводами. Входят в состав тканей головного мозга и нервных волокон. Воски – покрывают кожу, волосы у млекопитающих, перья у птиц и делают их более эластичными, предохраняют от влаги. Стероиды (стиролы)- построены на основе спирта холестерола. К стероидам относят желчные кислоты, витамин Д, гормоны коры надпочечников, половые гормоны, холестерол (холестерин) и др. Стероид холестерол – играет важную роль в процессах образования стероидных половых гормонов, кортикостероидов, желчных кислот и др. У ряда животных уровень холестерина в организме регулируется по принципу обратной связи. У человека этот механизм отсутствует. Поэтому при употреблении пищи богатой жирами, холестерин в крови резко возрастает, что может привести к образованию желчных камней и к заболеваниям сердечнососудистой системы.
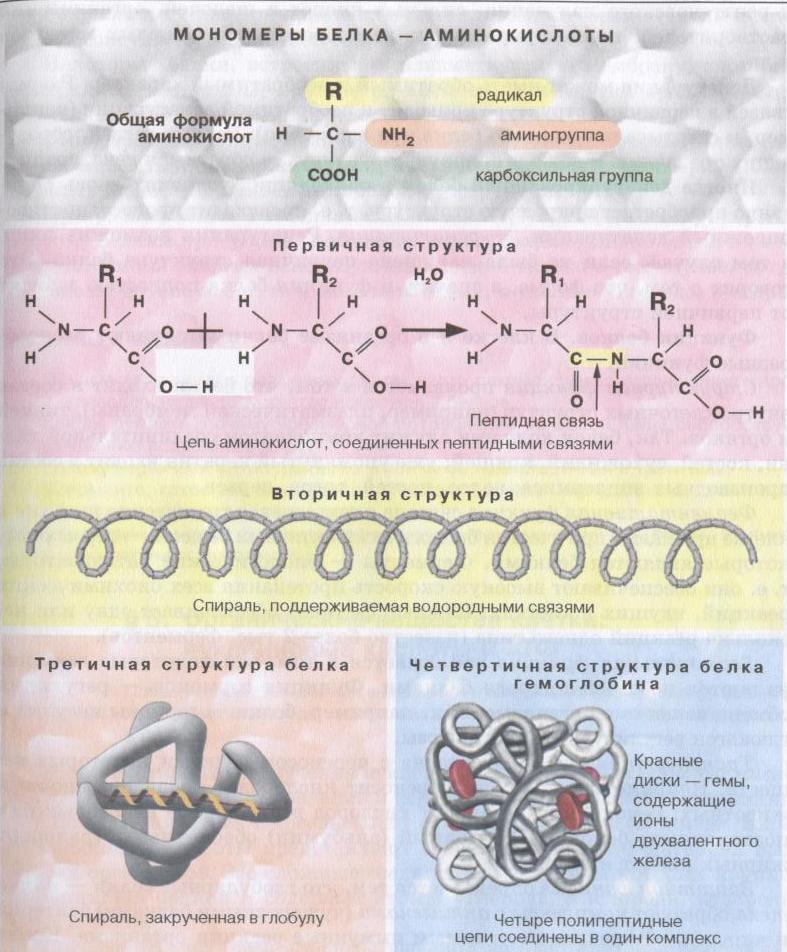
СТРОЕНИЕ И ФУНКЦИИ БЕЛКОВ Белки – это высокомолекулярные гетерополимеры, мономерами которых являются аминокислоты, связанные пептидными связями. В различных объектах живой природы обнаружено около 200 аминокислот, однако только 20 из них входят в состав белков. Их называют основными, или белок образующими (протеиногенными). Основные аминокислоты разделяют на заменимые (синтезируются в самом организме) и незаменимые, которые организм получает из пищи. Некоторые аминокислоты (аргинин, гистидин) являются незаменимыми для детей, но синтезируются в организме взрослого человека.
Общее строение аминокислоты можно представить следующим образом:
Как видно из формулы, каждая аминокислота состоит из группы - NH2, которая называется аминогруппой и обладает основными свойствами, и группы – СООН, которая называется карбоксильной и имеет кислотные свойства. Аминокислоты отличаются друг от друга своими радикалами (R), которыми могут быть самые различные соединения. Аминогруппа одной аминокислоты способна вступать в реакцию с карбоксильной группой другой аминокислоты, в результате чего выделяется вода, а аминокислоты соединяются между собой ковалентной – пептидной связью O H || |
Схема образования пептидной связи Соединения двух аминокислот называют дипептидом, трех – трипептидом, из 20 и более аминокислотных остатков – полипептидом.
Рис.4.3. Уровни структурной организации белковой молекулы: 1-первичный;2- вторичный; 3- третичный; 4 –четвертичный. Первичная структура закодирована в ДНК и определяется последовательностью, видом и количеством аминокислот в полипептидной цепи. Вторичная структура. Как правило это α-спираль напоминающая растянутую пружину, которая удерживается множеством водородных связей, возникающих внутри одной полипептидной цепи. Другой тип вторичной структуры – это β-слой, или складчатый слой, который образует две параллельные полипептидные цепи, связанные водородными связями. Полностью α-спиральную конфигурацию имеют белки кератина из которых состоят волоссы, ногти, когти, роги, копыта, клюв. Для других белков (например, белков шелка) характерны β-складчастые слои. Функционирование в виде закрученной спирали характерно для некоторых фибриллярных белков – фибриноген, актин, миозин и коллаген. Третичная структура белковой молекулы – это пространственное трехмерное образование, напоминающее глобулу. Она образуется вследствие закручивания полипептидной спирали в трехмерное образование шаровидной формы – глобулу. Третичная структура белков поддерживается ковалентными, дисульфидными (S=S), ионными, водородными связями, а также гидрофобными взаимодействиями. Глобулярную структуру имеют большинство белков (альбумины, глобулины и др.) Четвертичная структура представляет собой комплексное соединение из нескольких глобулярных белковых молекул, которые в совокупности составляют единую функциональную единицу. Так, например, молекула гемоглобина состоит из четырех белковых субъединиц и небелковой части – гема, содержащего Ферум. Устойчивость четвертичной структуры определяется водородными и электростатичными связями, гидрофобными взаимодействиями. В последние годы была сформулирована теория доменной структуры белка. Доменом называют часть пептидной цепи, образующей как бы самостоятельную глобулу, причем на одной пептидной цепи может быть два или больше доменов. Домены в одном белке могут быть одинаковыми или различными как по структуре, так и по функции. Домен – это функциональный модуль, рабочая поверхность отдельного белка. То есть белок – это полифункциональный модуль, состоящий из нескольких доменов. Было установлено, что белки выполняющие одну и ту же функцию, но выделенные из разных веществ, имеют сходное строение. Домены друг относительно друга могут смещаться благодаря “ гибкости” белковой молекулы. Смещение происходит под действием температуры, факторов внешней среды, фосфорилирования, метилирования, и это отражается на свойствах и функциях белка. По своему химическому составу белки делятся на простые и сложные. Простые белки (протеины) состоят только из аминокислот (например, альбумины, глобулины сыворотки крови). Сложные белки (протеиды) имеют в своем составе, кроме аминокислот, соединения небелковой природы – так называемую простетическую группу. Сложными белками являются: 1. Нуклеопротеиды хромосом – белки связанные с нуклеиновыми кислотами; 2. Металлопротеиды – белки связанные с металлами (большинство ферментов); 3. Липопротеиды – белки, содержащие липиды (входят в состав мембран); 4. Гликопротеиды – белки в соединении с углеводами (некоторые гормоны, антитела); 5. Фосфолипиды – белки содержащие остатки фосфорной кислоты (белки казеин молока, яичного желтка). Под влиянием высокой температуры, ионизирующего излучения, кислот, спирта, щелочей, тяжелых металлов и других факторов происходит нарушение вторичной, третичной и четвертичной структуры белка вследствие разрыва водородных и ионных связей. Процесс нарушения нативной (естественной) структуре белка без разрушения пептидных связей называется денатурацией. В некоторых случаях после прекращения неблагоприятного действия факторов среды на белок его структура восстанавливается. Процесс восстановления денатурированной структуры белка называется ренатурацией. Разрушение первичной структуры белка, вследствие разрыва пептидных связей всегда носит необратимый характер и называется деградацией. Изменение структуры белка происходит и в естественных условиях. При выполнении ими многих жизненно-важных функций (ферментативной, регуляторной, сигнальной и др.) Белки выполняют следующие функции: 1. Строительная (структурная). Белки входят в состав мембран и органоидов клетки, а также в состав вне клеточных структур (например, коллаген соединительной ткани); 2. Ферментативная (каталитическая). Каталитическую функцию выполняют белки-ферменты, ускоряющие в десятки и тысячи раз течение биохимических реакций. Действие ферментов строго специфично: каждый фермент катализирует только одну реакцию, действует только на одно вещество (один тип связи). Активность ферментов зависит от температуры, pH среды и других факторов; 3. Транспортная. Транспортные белки переносят различные вещества, например, гемоглобин переносит О2 и СО2, альбумины крови – жирные кислоты, глобулины – ионы металлов и гормоны. Белки плазматических мембран принимают участие в транспорте веществ в клетку. 4. Защитная. Белки образуют антитела и антигены иммунной системы, белок фибриноген и тромбин участвуют в свертывании крови и предотвращают кровотечение. 5. Двигательная. Актин и миозин обеспечивают сокращение мышц, тубулин – движение ресничек и жгутиков; 6. Регуляторная. Многие гормоны, регулирующие обменные процессы имеют белковую природу (например, инсулин, глюкагон); 7. Энергетическая. При окислении 1г белка освобождается 17,6 кДж энергии. 8. Сигнальная (рецепторная). Белки плазматических мембран при контакте с определенным веществом изменяют свою структуру и передают сигнал в соответствующий компартмент клетки; 9. Запасающая. Белок яйца, альбумин, белки эндосперма семян являются резервными и используются на ранних этапах развития организма. ГЛАВА 5
|
|||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 676; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.96 (0.007 с.) |


 (-С- N-)
(-С- N-)