
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Получение разветвленных полиэфиров поликонденсацией фталевого ангидрида и глицеринаСодержание книги
Поиск на нашем сайте
1. Цель работы
Получить полиэфир на основе фталевогоангидрида и глицерина, определить его состав, молекулярную массу и растворимость в различных растворителях.
2. Содержание работы
Поликонденсация - ступенчатый процесс взаимодействия молекул, содержащих функциональные группы, приводящий в результате химического взаимодействия этих групп к образованию высокомолекулярного соединения и сопровождающийся в ряде случаев выделением низкомолекулярного вещества (воды, спирта, аммиака и т.д.). В зависимости от характера взаимодействующих функциональных групп могут быть осуществлены различные типы реакций поликонденсации: полиэтерификация, полиамидирование, полисульфидирование, образование уретанов и др. Для реакции поликонденсации характерно быстрое исчерпание исходных реагентов (мономеров) на сравнительно ранних стадиях процесса, когда молекулярная масса полимера еще очень мала. Реакция поликонденсации протекает ступенчато через образование димеров, тримеров, тетрамеров и т.д., образовавшихся на начальной стадии реакции Поэтому основной реакцией роста является взаимодействие п - меров. При полимеризации же наряду с высокомолекулярным полимером, образующимся на начальной стадии, присутствует мономер. Молекулярная масса не зависит от степени завершенности реакции, которая влияет только на выход полимера. При поликонденсации образование полимера происходит на стадии очень высокой степени завершенности реакции (более 98%), и выход и молекулярная масса полимера зависят от продолжительности реакции. Поэтому при рассмотрении кинетики поликонденсации пользуются понятием «глубина превращения» - доля прореагировавших к данному времени функциональных групп. Процесс поликонденсации может быть равновесным (обратимым) и неравновесным (практически необратимым). При равновесной поликонденсации наряду с реакцией роста полимерной цепи, протекают процессы ее распада под влиянием низкомолекулярных продуктов реакции, реакций межцепного обмена и других факторов. При рассмотрении кинетики поликонденсации принимают, что реакционная способность функциональных групп одинакова, не зависит от размера молекул (принцип Флори, согласно которому активность реагирующих групп не зависит от длинны присоединенной к ним части макромолекулы) и вязкости реакционной среды. Скорость реакции поликонденсации можно выразить через скорость изменения концентрации одной из функциональных групп (А или В):
d [A]/ dt = - d [B]/ dt = k [A][B],
где k - константа скорости реакции; [A] и [B] - концентрации реагирующих групп в данный момент времени. При эквимолекулярном соотношении реагирующих групп в любой момент времени [A] = [B], тогда: d [A]/ dt = k [A]2или - d [A]/[A]2 = k dt. Интегрируя это уравнение в пределах от А0 до А и от нуля до данного времени t и вводя глубину превращения х, получим: k×t× [A0] = х /(1 - х), (1)
где х = (А0 - А)/ А0; А0 - начальная концентрация функциональных групп в мономерах; А - текущая концентрация функциональных групп в продуктах взаимодействия мономеров. Это уравнение справедливо для необратимых процессов и для начальных стадий обратимых процессов, когда можно пренебречь обратной реакцией. Среднее число звеньев мономера, приходящееся на одну молекулу полимера в данный момент времени t, будет равно средней степени поликондесации в данный момент времени. Средняя степень поликонденсации образующегося полимера
где Как видно из уравнения (2) величина
Рис.1.Зависимость степени линейной поликонденсации ( Необходимое условие образования высокомолекулярных полимеров при линейной поликонденсации является эквивалентность реагирующих между собой исходных соединений. При избытке одного из исходных веществ все образовавшиеся макромолекулы будут иметь на концах цепи одинаковые функциональные группы, что приведет к остановке процесса поликонденсации. В случае неравенства функциональных групп в исходной смеси предельное значение
где r = [А0]/[В0] - отношения начальных концентраций функциональных групп. Выделяющиеся в процессе поликонденсации низкомолекулярные вещества способны реагировать с образовавшимися макромолекулами. Зависимость предельной степени поликонденсации от концентрации низкомолекулярного вещества выражается уравнением поликонденсационного равновесия
где [z] - концентрация низкомолекулярного вещества в реакционной системе; k - константа поликонденсационного равновесия. Следовательно, для получения высокомолекулярных продуктов процесс необходимо проводить в условиях, когда в системе не накапливается низкомолекулярный продукт, т.е. в вакууме, при высокой температуре, в тонком слое реагирующих веществ.
3. Реактивы, приборы и посуда
Реактивы: фталевый ангидрид, глицерин (безводный), ацетон, 0,1 Н раствор гидрооксида калия. Приборы и посуда: фарфоровый стакан, стеклянная воронка, баня со сплавом Вуда, тигли (6 шт), контактный термометр, колбы Эрленмейера (3 шт.), шпатель, часовое стекло.
4. Порядок работы 1. Проведение поликонденсации фталевого ангидрида и глицерина. 2. Определение кислотного числа и молекулярной массы полимера в пробах реакционной смеси. 3. Построение кривых зависимости кислотных чисел и молекулярной массы от продолжительности поликонденсации. 4. Определение растворимости полиэфира.
5. Методика работы
В фарфоровый стакан помещают 11,0 г фталевого ангидрида и 6,7 г глицерина и прикрывают его опрокинутой стеклянной воронкой. Смесь быстро нагревают на воздушной бане или в бане со сплавом Вуда (возможна вазелиновая или силиконовая баня) до температуры 180°С и поддерживают эту температуру в течение двух часов. Затем реакционную смесь нагревают до 200-220°С и выдерживают при этой температуре до образования полимера трудно растворимого в ацетоне. В процессе синтеза полиэфира отбирают пробы реакционной смеси для определения кислотного числа. Первую пробу отбирают сразу после плавления фталевого ангидрида, следующие через 15, 30, 45 мин и через 1, 2, 3 ч. Фталевый ангидрид при нагревании возгоняется и кристаллизуется на холодных стенках воронки, перед отбором пробы его счищают в реакционный сосуд и тщательно перемешивают реакционную смесь. По мере отбора проб определяют в них кислотные числа. Затем определяют растворимость полученного полиэфира.
5.1. Определение растворимости Небольшие количества полиэфира (около 0,5 г) помешают в пробирки с пришлифованными пробками. В каждую пробирку приливают по 5 см3 растворителей различной природы и оставляют пробирки в штативе при комнатной температуре, периодически наблюдая за изменениями, происходящими в них. При этом возможно либо полное растворение, либо ограниченное набухание полимера.
5.2. Определение кислотного числа Определение основано на взаимодействии карбоксильных групп со щелочью: ~ СООН + КОН ®~ СООК + Н2О В зависимости от растворимости полимера и применяемого растворителя используют спиртовый или водный раствор щелочи. В качестве растворителей можно применять спирт, ацетон, диоксан, воду, смеси органических растворителей и т.д. Две навески полученного полиэфира (0,3 - 1,0 г), взвешенного с точностью до четвёртого знака, помещают в конические колбы, приливают 15 - 20 см3 растворителя и после растворения оттитровывают 0,1 н. раствором КОН в присутствии фенолфталеина до появления розовой окраски. Параллельно ставят контрольный опыт (без навески полимера) и рассчитывают кислотное число (К.Ч.). Из анализа результатов двух проб принимают среднее значение. Кислотное число характеризуется количеством мг КОН, необходимым для нейтрализации карбоксильных групп, содержащихся в 1 г анализируемого вещества:
где V1 и V2 - объем 0,1 н. раствора КОН, израсходованного на титрование пробы с навеской полимера и контрольной пробы, см3; f – поправочный коэффициент 0,1 н. раствора КОН; g - навеска вещества, г; 0,00561 - титр 0,1 н. раствора КОН, г/см3.
6. Обработка результатов
Определение молекулярной массы полиэфиров.
Молекулярную массу полиэфиров, имеющих карбоксильные и гидроксильные концевые группы, находят по кислотному и гидроксильному числам. В настоящей работе среднечисловая молекулярная масса определяется по кислотному числу по формуле
Обычно химический метод позволяет определить Данные по определению кислотных чисел и молекулярной массы полиэфира вносят в таблицу 6.1.
Таблица 6.1.
Данные наблюдений за растворимостью полученного полиэфира вносят в таблицу 6.2 Таблица 6.2.
На основании полученных данных строят кривые изменения кислотного числа и молекулярной массы от продолжительности поликонденсации. Написать схему реакции образования разветвленного полиэфира, проанализировать изменение состава и молекулярной массы в ходе поликонденсации.
7. Содержание отчета
2. Название работы. 3. Цель работы. 4. Теоретическая часть работы. 5. Описание методики проведения эксперимента. 6. Полученные и обработанные результаты эксперимента. 7. Схема проведенной реакции поликонденсации. Выводы по результатам эксперимента.
8. Контрольные вопросы
1. Указать отличия реакции поликонденсации от полимеризации. 2. Уравнение скорости реакции поликонденсации, чем определяется скорость реакции поликонденсации. 3. При каких условиях возможно получение высокомолекулярного полиэфира. 4. Степень поликонденсации. Выражение степени поликонденсации для различных условий проведения реакции. 5. «Глубина превращения» - смысл данного понятия. Зависимость молекулярной массы от степени поликонденсации и глубины превращения
СПИСОК ЛИТЕРАТУРЫ.
1. Практикум по химии и физике полимеров: Учеб.изд./ Н.И. Аввакумова, Л.А. Бударина, С.М. Дивгун и др.; Под ред. В.Ф. Куренкова. - М.: Химия, 1990. - С.73-96. 2. Кирпичников П.А., Аверко-Антонович Л.А., Аверко-Антонович Ю.О. Химия и технология синтетического каучука: Учебник для вузов. - 3-е изд., перераб. - Л.: Химия, 1987. - С 182 -200. 3. Основы физики и химии полимеров: Учеб. Пособие для вузов. / Н.В. Михайлов, В.А. Шершнев, Т.А. Шарай и др. Под ред. В.Н. Кулезнева. - М.: Высшая школа, 1977. - С 25-29.
Составители: Александр Федорович Пучков Екатерина Витальевна Черняк
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 1001; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.133.18 (0.01 с.) |

 равна:
равна: , (2)
, (2)
 ) от глубины их превращения (х)
) от глубины их превращения (х)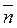 при х =1 определяют по уравнению
при х =1 определяют по уравнению = (1 + r)/(1- r),
= (1 + r)/(1- r), ,
, ,
, ,
, .
.


