
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение атома. Понятие радиоактивности. Период полураспада.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Все вещества, окружающие нас, - жидкие, твердые, газообразные - состоят из различного рода атомов. Атом состоит из ядра и пространства вокруг ядра, в котором находятся электроны. Размеры ядра примерно на четыре порядка (то есть примерно в 10 000 раз) меньше размеров атома, при этом практически вся масса атома (более 99,9%) сосредоточена именно в ядре. Атом можно представить в виде шара с размытыми границами, размер которого составляет примерно 10-10 м. Атом электронейтрален, то есть не имеет электрического заряда. Ядро атома состоит из двух типов элементарных частиц — протонов и нейтронов, имеющих общее название нуклоны (от «nucleus» - ядро). Электрон, так же как и нуклоны, относится к элементарным частицам. Его масса примерно в 1800 раз меньше массы протона или нейтрона, поэтому огромная, по сравнению с ядром, электронная оболочка атома практически не имеет массы (примерно 0,03% от массы атома). Электрон обладает элементарным отрицательным зарядом, равным заряду протона и противоположным ему по знаку: -1. Число электронов в атоме равно числу протонов, что обеспечивает электронейтральность (то есть отсутствие заряда) атома. Порядковый номер элемента в периодической системе Д. И. Менделеева равен зарядовому числу атома Z, а значит, числу протонов в ядре Nр, числу электронов в атоме Ne. Другими словами, элемент — это совокупность атомов с одинаковым Z. Символ элемента и его порядковый номер, по сути, означают одно и то же — число протонов в ядре атома. Например, все атомы с зарядом ядра +6 (Z = 6) называются атомами углерода и обозначаются символом «С». Фосфор - это атомы с Z = 15, которые обозначаются символом «Р», и так далее. Самое простое строение имеет ядро атома водорода, которое состоит из одной элементарной частицы - протона. Ядра всех остальных элементов состоят из протонов и нейтронов, называемых нуклонами. Количество протонов соответствует номеру химического элемента в периодической таблице Д.И. Менделеева и определяет зарядовое число Z. Общее число нуклонов в ядре обозначается буквой А и называется округленным массовым числом ядра. Количество нейтронов N равно разности между массовым числом и зарядовым числом: N = А – Z.
Для обозначения ядер применяется следующий символ: Массовые числа большинства химических элементов выражаются не целыми числами. Например, массовое число хлора равно 35,5. Это объясняется тем, что природный хлор состоит из двух видов атомов, в ядрах которых содержится по 18 или 20 нейтронов (соответственно 75,4 % и 24,6 %).Количество протонов при этом остается постоянным (17). Такие ядра с одинаковым зарядом и разными массовыми числами и называются изотопами. Таким образом, изотопы хлора будут обозначаться: У многих элементов (особенно наиболее распространенных в природе) существует, как правило, основной (доминирующий) изотоп, доля которого значительно больше доли других изотопов. Например, подавляющее большинство атомов углерода в природе - это Любая осязаемая материя вокруг нас и мы сами состоим из нуклидов, которые по своей природе могут быть стабильными или нестабильными. Стабильные нуклиды в отсутствие специфических воздействий на них могут существовать сколь угодно долго. Нестабильные нуклиды (а именно - их ядра) рано или поздно претерпевают самопроизвольное (то есть не вызванное никакими внешними воздействиями) превращение. Его называют радиоактивным распадом. Нуклиды, ядра которых способны претерпевать самопроизвольное превращение называют радиоактивными нуклидами или радионуклидами. Радиоактивность — это присущая некоторым ядрам способность самопроизвольно превращаться в другие, сопровождающаяся испусканием особого рода лучей. Открытие излучения, испускаемого солями урана без какого-либо внешнего воздействия, обладающего высокой проникающей способностью и названного впоследствии радиоактивным, принадлежит французскому ученому Антуану Анри Беккерелю (1896 год). Подобное излучение, только не самопроизвольное, а созданное в аппарате, открыл годом раньше немецкий физик Вильгельм Конрад Рентген. Новое явление активно исследовали Пьер и Мария Кюри, которые обнаружили и выделили в чистом виде первые радиоактивные изотопы - полоний и радий - и заложили основы учения о радиоактивности и радионуклидах. Количественным описанием интенсивности распада ядер (а значит, соответствующего излучения) является активность источника (материала, пробы, объекта биосферы и т. д.) — это отношение числа спонтанных ядерных превращений радионуклида dN (то есть радиоактивных распадов) в этом источнике, происходящих за время dt, к этому времени: Другими словами, активность (или радиоактивность) - это число радиоактивных распадов в единицу времени. Активность в СИ измеряется в беккерелях (Бк). 1 Бк = 1 с-1 (1 Беккерель равен одному ядерному превращению в секунду). Внесистемная единица активности - кюри (Ки). 1Ки = 3,7∙1010 Бк. 1 Ки - это активность 1 г радия-226. Радиоактивность подразделяется на естественную и искусственную, в зависимости от того, существуют распадающиеся ядра в природе, или получены посредством искусственных ядерных реакций. Так ядра естественного радиоактивного элемента урана могут спонтанно делиться без внешнего воздействия. Процесс радиоактивного превращения можно вызвать и искусственно путем бомбардировки ядер нестабильных изотопов нейтронами. Время Т, в течение которого спонтанно распадается половина первоначального количества ядер, называется периодом полураспада данного элемента. Например, период полураспада урана - 235 равен 7,1 ∙ 108 лет. Период полураспада выражают в зависимости от его величины в удобных для восприятия единицах времени - секундах, минутах, часах, сутках или годах. Период полураспада разных радионуклидов отличается на много порядков. Радионуклиды с большим Т1/2 принято называть долгоживущими радионуклидами, с малым - короткоживущими. Радионуклиды с очень большим периодом полураспада (например 238U) крайне малорадиоактивны. Активность одинакового количества радионуклидов обратно пропорциональна их периоду полураспада. Например, Для некоторых природных радионуклидов периоды полураспада могут составлять от миллионных долей секунды (и менее) до 1024 лет! Период полураспада удобен для быстрой оценки количества (значит, и активности) радионуклида по истечении определенного времени. За время, равное Т1/2, его количество станет вдвое меньше, за 2Т1/2 - в четыре раза меньше, а за 10Т1/2 количество радионуклида и его активность уменьшится примерно в тысячу раз.
Обычно из каждого распадающегося атома материнского вещества образуется один атом дочернего. Наряду с этим постоянно происходит распад дочернего элемента. В этом процессе распада различают два случая: 1) Первое (материнское) вещество распадается быстрее второго (дочернего). В этом случае по истечении определенного отрезка времени остается только второе вещество. 2) Материнское вещество распадается медленнее, чем дочернее. В этом случае оба вещества сосуществуют вплоть до полного их распада, причем их количественное соотношение стремится к некоторому постоянному пределу. Если сосуществуют несколько последовательно распадающихся радиоактивных элементов, представляющих собой радиоактивное семейство, то за единицу времени распадается столько ядер любого члена семейства, сколько распадается ядер родоначальника семейства. Такое состояние сосуществующих радиоизотопов называется устойчивым радиоактивным равновесием. Например, в урановой руде всегда присутствуют кроме материнского вещества (урана) все дочерние элементы, в том числе радий. На один килограмм урана приходится всего 0,34 миллиграмма радия. Радиоактивное равновесие между ураном и радием наступает по истечении длительного промежутка времени и наблюдается в древних горных породах.
|
||||
|
Последнее изменение этой страницы: 2016-12-11; просмотров: 1514; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.205.149 (0.009 с.) |


 где X означает химический элемент. Атомы с определенным числом протонов и нейтронов называют нуклидами. Нуклиды одного и того же химического элемента называют изотопами.
где X означает химический элемент. Атомы с определенным числом протонов и нейтронов называют нуклидами. Нуклиды одного и того же химического элемента называют изотопами. и
и  CI. Изотопы занимают одно и то же место в периодической таблице. Они отличаются только массой, а их химические свойства почти тождественны.
CI. Изотопы занимают одно и то же место в периодической таблице. Они отличаются только массой, а их химические свойства почти тождественны. , а атомов водорода - это
, а атомов водорода - это  .
.
 примерно в триллион раз (1000 миллиардов) менее радиоактивен, чем
примерно в триллион раз (1000 миллиардов) менее радиоактивен, чем 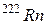 .
.



