
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Последовательность проведения процесса экстрагированияСодержание книги
Поиск на нашем сайте
1. Контакт исходного раствора и экстрагента. а) В колбу с притертой пробкой внести, отмерив цилиндром, 25 мл раствора J2 в воде и добавить, отмерив пипеткой, 10 мл органического растворителя – выбранного экстрагента. б) Колбу плотно закрыть пробкой и в течение 15 минут встряхивать. При встряхивании придерживать пробку, изредка осторожно ее открывая.
2. Механическое разделение образовавшихся двух равновесных фаз –экстракта и рафината. а) Содержимое колбы перенести в делительную воронку с хорошо притертым и слегка смазанным вазелином краном. Добиться в течение 20 минут полного расслоения эмульсии. б) Отделить э к с т р а к т от р а ф и н а т а, открыв пробку делительной воронки и слив нижний водный слой (рафинат) через кран, а верхний толуольный слой (экстракт) через горлышко воронки в отдельные сухие колбы.
3. Сделать вывод о результатах экстрагирования. а) Сопоставить окраску исходного водного раствора и рафината. б) Сопоставить окраску растворов рафината и экстракта. ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Определение процессу "экстрагирования".
6. Экстрагент должен иметь низкую вязкость; 7. Экстрагент существенно должен отличаться по плотности от первого растворителя?
ЗАНЯТИЕ №3
I. ТЕМА ЗАНЯТИЯ: "Свойства буферных растворов. Буферная емкость. Электродные потенциалы и электродвижущая сила".
II. ПЛАН ИЗУЧЕНИЯ ТЕМЫ: 1. Ионное произведение воды. Водородный показатель (рН). 2. Нейтральная, кислая, щелочная среды. Значение рН в кислой, щелочной и нейтральной средах при 25 С. 3. Общая, активная и потенциальная кислотность (щелочность) в растворах слабых кислот (оснований). 4. Буферные растворы - определение понятия. Состав буферных растворов. 5. Уравнение для расчета рН кислотного или основного буферных растворов (уравнение Гендерсона-Гассельбаха). Вывод уравнения. 6. Факторы, определяющие рН буферных растворов. 7. Механизм буферного действия при добавлении кислот, щелочей и при разведении. 8. Зона буферного действия. Буферная емкость. 9. Факторы, влияющие на величину буферной емкости. Буферные кривые. 10. Практическое использование буферных растворов. 11. Электродный потенциал - определение понятия. Механизм возникновения электродного потенциала на металлической пластинке, погруженной в раствор своей соли. 12. Схематическая запись электрода (полуэлемента). Уравнение окислительно-восстановительной реакции, сопровождающей образование электродного потенциала. Уравнение Нернста для расчета величины электродного потенциала. 13. Факторы, от которых зависит величина электродного потенциала. Стандартный электродный потенциал. 14. Классификация электродов по механизму возникновения электродного потенциала и по применению. 15. Гальванический элемент. Устройство, принцип работы. 16. Уравнение химической реакции, сопровождающей работу химического гальванического элемента. 17. ЭДС гальванического элемента, ее расчет: а) по уравнению Нернста; б) по величинам электродных потенциалов электродов, образующих гальванический элемент; Определение ЭДС с помощью иономера универсального ЭВ-74.
18. Экспериментальное определение величины электродного потенциала. 19. Стандартный водородный электрод. Устройство, механизм действия. 20. Электроды сравнения: хлорсеребряный и каломельный. Устройство, механизм действия. 21. Электроды определения (индикаторные), используемые для измерения рН: а) водородный; б) хингидронный; в) стеклянный. Устройство, механизм их действия. 22. Потенциометрия. Потенциометрическое определение рН, принцип метода.
III. ЛИТЕРАТУРА: 1. К. И. Евстратова, Н. А. Купина, Е. Е. Малахова. Физическая и коллоидная химия, М., 1990, с.114-116, 124-125, 128-131,160-185, 1880189. 2. М. И. Равич-Щербо, В. В. Новиков. Физическая и коллоидная химия, М., 1975, с.90-100. 3. В. А. Киреев. Краткий курс физической химии. М., 1978, с.409-431, 433-438.
IV. ТЕМЫ ПРАКТИЧЕСКИХ РАБОТ: 1. "Зависимость рН буферных растворов от соотношения концентраций компонентов и разведения буфера". 1. Приготовить три ацетатных буферных раствора с различным соотношением концентраций компонентов. В три одинаковые по диаметру пробирки внести, отмерив пипеткой, заданные объемы растворов уксусной кислоты с концентрацией 0, 2 моль/л и соли ацетата натрия с концентрацией 0, 2 моль/л по схеме.
2. Рассчитать рН в каждом из трех буферных растворов. Для расчета рН использовать уравнение:
где
Т.к.
Для расчетов принять К = 1, 75 10-5
3. Каждый из приготовленных буферных растворов развести в 9 раз. В другие три одинаковые по диаметру пробирки отобрать по 1 мл каждого из приготовленных на первом этапе буфера и добавить по 8 мл дистиллированной воды. Содержимое пробирок тщательно перемешать. 4. Оценить значение рН буферных растворов, приготовленных на первом этапе (отличающихся по соотношению концентраций компонентов), по окраске индикатора. В каждую из трех пробирок первого ряда внести по 5 капель индикатора метилового красного (метил-рот). Содержимое перемешать. Сопоставить окраску индикатора в трех растворах. Сделать вывод о зависимости рН буфера от соотношения концентрации компонентов. 5. Оценить значение рН буферных растворов до и после разведения буферов в 9 раз по окраске индикатора. В каждую из 3 пробирок второго ряда внести по 5 капель индикатора метилового красного. Содержимое перемешать. Со- поставить окраску индикатора в растворах с заданным соотношением концентраций компонентов до и после разведения. Сделать вывод о влиянии разведения на рН буферного раствора.
2. "Потенциометрическое измерение рН с помощью стеклянного электрода"(Практический навык). рН – отрицательный десятичный логарифм активности (концентрации) ионов водорода. рН = -lg аН+. Потенциометрическое измерение рН основано на определении потенциала электрода, потенциал которого зависит от активности (концентрации) ионов водорода, или на измерении ЭДС гальванического элемента, составленного из электрода сравнения и индикаторного электрода (электрода определения, измерительного), потенциал которого зависит от активности или концентрации ионов водорода.
В рН-метрии в качестве индикаторных электродов используют водородный электрод определения, хингидронный, стеклянный и др.электроды. В работе используется стеклянный электрод. Измерение рН проводят при помощи прибора "Иономера универсального ЭВ-74". ОПИСАНИЕ ПРИБОРА. Прибор состоит из 2-х узлов: гальванического элемента и потенциометра. Гальванический элемент собран из индикаторного стеклянного электрода, опущенного в исследуемый раствор, и электрода сравнения – насыщенного хлорсеребряного электрода. Потенциометр служит для измерения ЭДС гальванического элемента. На передней панели потенциометра имеется шкала прибора, позволяющая сделать отсчет рН раствора(рХ) или ЭДС гальванического элемента. Шкала прибора имеет две подшкалы – нижнюю, позволяющую определить приблизительное значение рН(или Е) и рассчитанную на 20 единиц, и верхнюю, разбитую на 5 единиц, с помощью которой измеряют точное значение рН(или Е). Верхняя шкала имеет 3 ряда цифр: верхний ряд – измерение температуры раствора от 00 до 1000С; нижний ряд – от 0 до 5; им пользуются, eсли измеряют рН (рХ) в интервалах от 4 до 9, от 9 до 14, от 14 до 19. Отсчет по этому ряду цифр производят следующим образом: определяют положение стрелки и к показанию стрелки прибавляют первую цифру предела. Например, интервал от 4 до 9; стрелка прибора дает показание 1,8; следовательно рН = 1,8 + 4 = 5,8. Средним рядом цифр пользуются при измерении рН в интервале от -1 до 4. На передней панели прибора находятся также следующие органы управления: 1. Тумблер "сеть". 2. Ручки переменных резисторов. "Калибровка"(ее используют для настройки прибора по буферным растворам с известным значением рН). 3. Ручка "Температура раствора". 4. 5 клавиш выбора рода работы. Анионы + /Катионы – При нажатом положении этой клавиши производят измерение активности катионов или отрицательных потенциалов (измерительного электрода гальванического элемента). При отжатом положении измеряют активность анионов или положительных потенциалов
"рХ(рН)" – При нажатом положении этой клавиши измеряют рН или активность ионов (рХ = – lgах+)
Пять клавиш выбора диапазона измерений I. Диапазон приблизительного измерения: -1–19 II. Диапазоны точных измерений от -1 до 4; от 4 до 9; от 9 до 14; от 14 до 19 Корректор нуля.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 344; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.134.53 (0.01 с.) |


 - концентрация кислоты в растворе, взятом для приготовления буфера
- концентрация кислоты в растворе, взятом для приготовления буфера - концентрация соли в растворе, взятом для приготовления буфера.
- концентрация соли в растворе, взятом для приготовления буфера.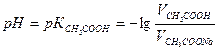 или
или



