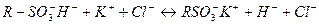Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Последовательность измеренияСодержание книги
Поиск на нашем сайте 1. Собрать прибор: Стеклянный измерительный электрод подключить к гнезду "изм" на задней панели прибора; хлорсеребряный электрод сравнения – к гнезду "всп". Автоматический термокомпенсатор подключить к разъему "Термокомпенсатор". Два электрода гальванического элемента и термокомпенсатор погрузить в стаканчик с дистиллированной водой. 2. Подготовить прибор к работе. Перед началом работы прибор заземлить. Переключатели прибора установить в положение "t0" и "-1–19", после чего прибор включить в сеть и прогреть в течение 20 мин. Электроды промыть дистиллированной водой, осторожно удалить остатки воды фильтровальной бумагой. 3. Провести калибровку прибора по буферному раствору Для калибровки прибора при измерении рН применяют стандартные буферные растворы. Налить в стакан стандартный буферный раствор с выбранным значением рН и погрузить в него стеклянный электрод, хлорсеребряный электрод и термокомпенсатор. Нажать клавишу катионы/анионы и для грубой настройки клавишу диапазона "-1–19". Затем нажать клавишу "рХ". Ручкой "калибровка" установить стрелку прибора на приблизительное значение рН по нижней шкале прибора. Для точного измерения рН нажать клавишу выбранного диапазона точного измерения рН. По верхней шкале ручкой "калибровка" установить стрелку на точное значение рН буферного раствора. Нажать клавишу "t0". 4. Измерить рН исследуемого раствора. Электроды промыть дистиллированной водой и удалить фильтровальной бумагой избыток воды. Электроды погрузить в исследуемый раствор. Нажать клавишу диапазона приблизительного измерения рН "-1–19", далее клавишу "рХ" и по нижней шкале определить приблизительное значение рН исследуемого раствора. Зная приблизительное значение рН, нажать клавишу выбранного диапазона точного измерения. Определить точное значение рН по верхней шкале прибора. После измерения рН исследуемого раствора нажать клавишу "t0". Электроды погрузить в дистиллированную воду.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ. 1. Какие растворы называют буферными? 2. Назначение буферных растворов. 3. Каков состав буферных растворов? 4. Привести уравнение для расчета рН буфера, состоящего а) из слабой кислоты и соли, образованной этой кислотой и сильным основанием; б) из слабого основания и соли, образованной этим основанием и сильной кислотой; 5. От каких двух факторов зависит рН буферного раствора? 6. Какие величины можно определить, используя уравнение для расчета рН буферного раствора? 7. Какими двумя способами можно приготовить буферные растворы? 8. Как рассчитать объемы растворов кислоты (например CH3COOH) и соли (например CH3COONa), имеющих одинаковую исходную концентрацию, которые нужно смешать, чтобы приготовить определенный объем буферного раствора с заданным значением рН? 9. Зона буферного действия: качественная и количественная характеристики. 10. Буферная емкость. Зависимость ее от концентрации буфера и соотношения концентраций компонентов. 11. Имеется два буферных раствора. Значение рК слабого электролита в первом буферном растворе рК1= 4,76, во втором рК2= 3,8. Зоны буферного действия соответственно равны 3,76 - 5,76 и 2,8 - 4,8. Какой буферный раствор следует выбрать, если необходимо создать среду с рН = 4, 6? Ответ обосновать. 12. Дать определение понятию "водородный показатель" – рН. 13.Сформулировать принцип потенциометрического определения рН. 14. По какому признаку выбирают индикаторные электроды (электроды определения, измерительные) в рН-метрии. 15. Перечислить электроды, используемые в рН-метрии как индикаторные. 16. Из каких электродов состоит гальванический элемент, используемый в приборе "Иономер универсальный" при измерении рН раствора? Указать электрод определения и электрод сравнения в этом гальваническом элементе. 17. Как устроен стеклянный электрод? Для какого интервала значений рН он может быть использован? 18. К какой группе электродов по механизму возникновения потенциала относится стеклянный электрод? Каков механизм возникновения электродного потенциала стеклянного электрода? 19. Привести уравнения для расчета потенциала стеклянного электрода. Обозначить величины, входящие в это уравнение. 20. Преимущества и недостатки стеклянного электрода. 21. К какой группе электродов по механизму возникновения потенциала относится хлорсеребряный электрод? Как он устроен? 22. Из каких двух узлов состоит "Иономер универсальный"? Каково назначение потенциометра? 23. Какие органы управления находятся на передней панели прибора? Каково назначение каждого? 24. Шкала прибора: отсчет приблизительного и точного значения рН по шкале прибора. Точность отсчета рН по нижней и верхней шкале. 25. Каков диапазон шкалы приблизительного измерения рН. Каковы диапазоны шкалы точного измерения рН? 26. Основные этапы работы с прибором. 27. Как настроить иономер по температуре при ручной термокомпенсации? 28. Как провести калибровку прибора по буферному раствору? 29. Как определить рН исследуемого раствора, если прибор
ЗАНЯТИЕ №4
I. ТЕМА ЗАНЯТИЯ: "Адсорбция на границе твердое тело-газ, твердое тело-жидкость. Адсорбция из растворов электролитов. Ионообменная адсорбция."
II. ПЛАН ИЗУЧЕНИЯ ТЕМЫ: 1. Понятия "адсорбция", "адсорбент", "адсорбтив", "равновесная концентрация". 2. Способы количественного выражения адсорбции на твердом адсорбенте. Единицы измерения величины адсорбции. Экспериментальное измерение адсорбции на твердом адсорбенте. 3. Природа сил адсорбционного взаимодействия. Физическая и химическая (хемосорбция) адсорбция. 4. Изотерма адсорбции по Фрейндлиху. Уравнение Фрейндлиха. Константы в уравнении Фрейндлиха: их физический смысл и способ нахождения. 5. Изотерма мономолекулярной адсорбции по Ленгмюру. Уравнение Ленгмюра, физический смысл констант в этом уравнении. 6. Нахождение констант в уравнении Ленгмюра (по изотерме адсорбции и путем преобразования уравнения Ленгмюра в уравнение прямой). 7. Факторы, влияющие на величину адсорбции на твердом адсорбенте из газов или растворов. 8. Практическое использование процесса адсорбции в фармации. 9. Разновидности и особенности адсорбции из растворов электролитов. 10. Эквивалентная и избирательная адсорбция из растворов электролитов. 11. Правило Панета-Фаянса. 12. Зависимость адсорбции ионов от величины заряда и размера ионов. Лиотропные ряды. 13. Ионообменная адсорбция, ее особенности. Уравнение Никольского. 14. Иониты: классификация по химической природе матрицы, способу получения (по происхождению), по специфичности ионного обмена (по механизму ионного обмена). 15. Структура и свойства матрицы ионитов. 16. Функциональная (ионогенная) группа ионита. Функциональные группы катионитов и анионитов. Противоионы.. Схема ионного обмена, идущего на катионите и анионите. 17. Использование ионообменной адсорбции для деионизации воды, разделения смеси ионов. 18. Обменная емкость ионитов. 19. Использование ионообменной адсорбции в фармации и медицине.
III. ЛИТЕРАТУРА: 1. С. С. Воюцкий. Курс коллоидной химии, М., 1975, с.81-92, 137-145,146-153, 479-481. 2. К. И. Евстратова, Н. А. Купина, Е. Е. Малахова. Физическая и коллоидная химия, М., 1990, с.302, 325-329, 331-337, 338-346.
IV. ТЕМЫ ПРАКТИЧЕСКИХ РАБОТ: 1. "Адсорбция красителя активированным углем".
I. Провести адсорбцию фуксина на активированном угле. 1. В две колбы на 50 мл внести по 5 мл раствора фуксина и по 0, 25 г растертого активированного угля. 2. Провести адсорбцию в течение 5 минут, периодически встряхивая содержимое колб. 3. Отфильтровать содержимое колб, собрав фильтраты в две отдельные сухие пробирки. 4. Сравнив фильтраты с окраской исходного раствора фуксина, сделать вывод об адсорбции фуксина активированным углем.
II. Провести десорбцию фуксина. 1. После завершения фильтрования на первом этапе перенести воронки с фильтрами и активированным углем, на котором адсорбирован фуксин, в две другие сухие пробирки. На один из фильтров нанести 1 мл дистиллированной воды, на другой - 1 мл этилового спирта. 2. Собрать фильтраты. Сопоставить окраски полученных фильтратов с фильтратами, полученными на первом этапе. 3. Сделать вывод о десорбции фуксина.
2. "Деионизация воды"(Практический навык). Воду можно освободить от присутствующих в ней солей с помощью ионообменной адсорбции, последовательно пропустив воду через катионит в Н+-форме и анионит в ОН--форме (или наоборот). Этот процесс называется деионизацией или обессоливанием. Процесс деионизации воды, содержащей, например, хлорид калия, с помощью сульфо-катионита в Н+-форме и амино-анионита в ОН--форме можно представить следующей схемой: а) на катионите:
элюат I или
б) на анионите:
элюат I или
ПОСЛЕДОВАТЕЛЬНОСТЬ ПРОВЕДЕНИЯ ДЕИОНИЗАЦИИ ВОДЫ. 1. Зарядить катионит в колонке Н+-ионами (перевести в Н+-форму). Для этого, через колонку, заполненную набухшим катионитом, медленно пропустить 10 мл 1М раствора HCl. Промыть катионит дистиллированной водой до желтой окраски элюата по метиловому оранжевому. Контроль рН элюата проводить, нанося каплю элюата на предметное стекло и добавляя к ней каплю индикатора метилового оранжевого. 2. Зарядить анионит в колонке ОН--ионами (перевести в ОН--форму). Для этого через колонку, заполненную набухшим анионитом, медленно пропустить 10 мл 1М раствора NaOH. Промыть анионит дистиллированной водой до бесцветной окраски элюата по фенолфталеину. Контроль рН элюата проводить, нанося каплю элюата на предметное стекло и добавляя к ней каплю индикатора. 3. Слить слой воды над катионитом в Н+-форме и медленно пропустить через катионит 10 мл воды, в которой содержатся примеси соли (например, водный раствор суфьфата меди). Элюат (I) собрать в пробирку. 4. Слить слой воды над анионитом в ОН--форме и медленно пропустить элюат (I) через анионит. Элюат (II), выходящий из колонки с анионитом, собрать в чистую пробирку. 5. Проверить качество воды, подвергнутой деионизации. Для этого в порциях элюата (II) провести соответствующие качественные реакции на анион SО42-и катион Cu2+, присутствовавшие в загрязненной воде.
2. "Разделение ионов меди и железа методом круговой хроматографии на бумаге". I. Разделить смесь ионов Fe3+и Cu2+ хроматографией на бумаге. 1. Взять круг хроматографической бумаги диаметром 10 см с вырезанной к центру круга полоской шириной 2 см. Полоску бумаги отогнуть в вертикальное положение. 2. На место сгиба нанести каплю раствора, приготовленного из равных объемов 2% растворов сульфата меди и хлорида железа. 3. Бумагу подсушить и поместить между одинаковыми по диаметру чашками Петри таким образом, чтобы отогнутая полоска бумаги была погружена в растворитель (вода), налитый в чашку. 4. Проследить за движением растворителя по бумаге. Когда фронт растворителя приблизится к краям чашки Петри, процесс прекратить, хроматографическую бумагу просушить.
II. Проявить хроматограмму. 1. Обработать хроматограмму раствором K4[Fe(CN)6]. В зоне распределения ионов железа образуется голубой осадок берлинской лазури, в зоне распределения ионов меди - красновато-коричневый осадок железистосинеродистой меди.
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ 1. Сформулировать принцип деионизации воды. 2. Назначение метода. 3. Явление, лежащее в основе метода. 4. Как приготовить катионит в Н+-форме? 5. Как приготовить анионит в ОН--форме? 6. Привести схему деионизации воды, содержащей ионы SO42- и Cu2+ с помощью сульфо-катионита в Н+-форме и амино-анионита в ОН--форме. 7. Этапы проведения деионизации воды, содержащей ионы SO42- и Cu2+. 8. Как провести проверку качества очистки воды деионизацией? ЗАНЯТИЕ №5 I. ТЕМА ЗАНЯТИЯ: "Получение коллоидных растворов. Устойчивость и коагуляция коллоидных растворов". "Высокомолекулярные соединения: получение и свойства растворов ВМС. Полиэлектролиты".
II. ПЛАН ИЗУЧЕНИЯ ТЕМЫ: 1. Природа коллоидного состояния вещества. 2. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды, по размерам частиц дисперсной фазы, по степени взаимодействия дисперсной фазы с дисперсионной средой, по наличию или отсутствию взаимодействия между частицами дисперсной фазы. 3. Условия образования коллоидных растворов. 4. Методы получения коллоидных растворов. 5. Методы очистки коллоидных растворов: диализ, ультрафильтрация. 6. Строение коллоидной мицеллы. 7. Строение двойного электрического слоя на границе раздела фаз в коллоидной системе. Теории Гельмгольца, Гуи-Чепмена, Штерна. 8. Поверхностный и электрокинетический потенциалы. 9. Электрокинетические явления в коллоидных растворах, их классификация. Электрофорез и электроосмос. 10. Агрегативная устойчивость коллоидных растворов. Факторы устойчивости. 11. Коагуляция. Факторы, вызывающие коагуляцию. 12. Коагуляция золей электролитами. Количественная характеристика коагулирующей способности электролита: порог коагуляции, концентрация коагуляции. 13. Правило Шульце-Гарди. 14. Теория коагуляции лиофобных коллоидов Дерягина-Ландау-Фервея-Овербека (теория ДЛФО). 15. Определение понятия "высокомолекулярные соединения". Две основные особенности высокомолекулярных соединений, определяющие их специфические свойства. 16. Классификация ВМС. 17. Общие свойства растворов ВМС. 18. Набухание и растворение ВМС. Особенности получения растворов ВМС. 19. Вязкость растворов ВМС. Уравнение Штаудингера. 20. Относительная, удельная, приведенная и характеристическая вязкость. 21. Определение молярной массы ВМС вискозиметрически. 22. Полиэлектролиты 23. Полиэлектролиты. Классификация полиэлектролитов. 24. Зависимость заряда частиц полиэлектролитов в растворе от рН среды. Изоэлектрическая точка. 25. Методы определения изоэлектрической точки белков.
III. ЛИТЕРАТУРА: 1. С. С. Воюцкий. Курс коллоидной химии. М., 1975, с.9-32, 169-219, 223-258, 259-312. 2. К. И. Евстратова, Н. А. Купина, Е. Е. Малахова. Физическая и коллоидная химия, М., 1990, с.365-370, 396-423, 424-440. 3. М. И. Равич-Щербо, В. В. Новиков. Физическая и коллоидная химия, М., 1975, с.196-207, 213, 215-217.
IV. ТЕМЫ ПРАКТИЧЕСКИХ РАБОТ:
1. "Получение золей гидроксида железа (III), канифоли"(Практический навык). а) Получение золя гидроксида железа (III) методом гидролиза. В основе получения золя гидроксида железа (III) лежит химическая реакция гидролиза, уравнение которой t0 имеет вид: t 50 FeCl3 + 3H2O → Fe (OH)3 ↓+ 3HCl Электролитами стабилизаторами могут быть FeOCl и FeCl3. В первом случае формула коллоидной мицеллы имеет вид: { m[Fe (OH)3] n FeO+ (n-x) Cl-}x+ xCl- во втором: { m[Fe (OH)3] n Fe3+3 (n-x) Cl-}3x+ 3xCl- Получение золя гидроксида железа (III). 1. В колбу внести 20-30 мл дистиллированной воды и нагреть ее до кипения. 2. В кипящую воду внести по каплям 2% раствор хлорида железа (III) до появления красно-коричневого окрашивания. б) Получение золя канифоли методом замены растворителя. 1. В пробирку с 3-5 мл дистиллированной воды добавить раствор канифоли в спирте. 2. В полученном золе обнаружить явление опалесценции.
2. "Определение порога коагуляции золя гидроксида железа (III) для электролита K2CrO4". Порог коагуляции (ПК или См) - минимальное количество электролита (моль или ммоль), которое необходимо добавить к 1 л коллоидного раствора, чтобы вызвать явную коагуляцию. Определить порог коагуляции золя гидроксида железа (III) для электролита K2CrO4. 1. В колбу пипеткой внести 10 мл золя гидроксида железа (III) – VЭ. 2. Заполнить бюретку раствором электролита K2CrO4 с концентрацией 0, 01 моль/л (Сэ). 3. Медленно, порциями при перемешивании добавлять в коллоидный раствор из бюретки раствор K2CrO4. Добавление электролита прекратить при появлении первых признаков явной коагуляции (помутнения). Отметить объем добавленного электролита (Vэ). 4. Рассчитать по формуле ПК, выразив его в ммоль/л:
|
||
|
Последнее изменение этой страницы: 2016-12-09; просмотров: 359; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.01 с.) |