Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Базальная холинергическая система переднего мозгаСодержание книги
Поиск на нашем сайте Недавно было показано, что магноцеллюлярные нейроны, содержащие АХ и локализованные в базальном переднем мозге (БПМ; Basal Forebrain), моносинаптически проецируются на кору. Они участвуют в регуляции сна (см. гл. 13) и бодрствования и причастны к возникновению реакции активации. Холинергическая часть переднего мозга в основном представлена базальным ядром Мейнерта (n. basalis – NB). Электрическая стимуляция базального ядра (NB) и SI (substancia innominata) высвобождает в коре АХ у наркотизированной крысы [Kurosawa et al., 1989] и увеличивает кровоток в коре. Эффект блокируется антагонистами мускариновых рецепторов, т.е. существует холинергическая иннервация сосудов коры, которая обусловливает их расширение [Sato, Sato, 1992]. Активирующая система холинергических нейронов переднего мозга представлена нейронами, связанными с бодрствованием. Уровень их возбуждения меняется параллельно с поведенческой активностью животного. Частота их спайковых разрядов увеличивается во время бодрствования и особенно во время движения, а также в парадоксальном сне [Szymusiak, 1995]. В медленном сне их активность уменьшается. При этом, как и в таламусе, режим одиночных потенциалов действия сменяется пачечной активностью. Состояние нейронов БПМ, связанных с бодрствованием, находится под контролем неспецифических систем активации среднего мозга и моста через глутаматовые рецепторы, а также со стороны заднего латерального гипоталамуса, который также имеет проекцию на кору и принимает участие в ЭЭГ- и поведенческой активации. На нейроны бодрствования БПМ конвергируют серотонинергические нейроны дорзального ядра шва (n.Raphe) и клетки синего пятна (locus coeruleus), вызывающие их инактивацию. Кортикальные проекции на БПМ сравнительно ограничены, их мало от первичных сенсорных и моторных областей. Большинство их идет от орбитофронтальной, инсулярной и особенно из префронтальной коры. Кортикофугальные влияния на БПМ идут по мультисинаптическим путям через стриатум и прилегающее ядро (n.accumbens). Концепция холинергических нейронов БПМ как источника кортикальной активации, поддерживающего бодрствование, должна быть дополнена представлением о существовании специального холинергического механизма, обеспечивающего дополнительное высвобождение АХ в локальных участках коры, которые реагируют на стимулы, связанные с подкреплением. Показано, что значительная часть нейронов БПМ реагирует активацией на условные раздражители, связанные с наградой, и не реагирует на условные сигналы наказания [Whalen et al., 1994]. Это механизм избирательного внимания к значимым стимулам, который обеспечивает их обработку в соответствующих областях коры [Wilson, Rolls, 1990; Metherate, Asht, 1993]. Можно предположить, что дефицит когнитивных функций, наблюдающийся при болезни Альцгеймера, которую связывают с поражением холинергической системы БПМ [Bartus et al., 1982], скорее опосредован нарушением именно механизма избирательной активации [Szymusiak, 1995]. Опыты с формакологическим отключением БПМ у животных показали нарушение поведения. Животные не могут выполнять приобретенные ими навыки, включая прохождение различных лабиринтов, заученное пассивное и активное избегание [Dekker, Connor, 1991]. Создавая локальную активацию в коре, холинергические нейроны БПМ, по-видимому, взаимодействуют с таламо-кортикальной неспецифической системой. Показано, что помимо прямого влияния на кору, холинергические нейроны бодрствования БПМ проецируются к ограниченному количеству таламических ядер. Предполагают, что, параллельно влияя на кору и таламус, они могут модулировать, в том числе усиливать реакции активации, определяемые механизмом таламо-кортикальной неспецифической системы. Холинергические активирующие влияния из БПМ распространяются также на лимбическую систему, в частности на гиппокамп, вызывая гиппокампальный тета-ритм – признак активации гиппокампа; электрическая стимуляция РФ ствола мозга модулирует гиппокампальный тета-ритм. В БПМ функция регуляции активации сосуществует с функцией управления сном. Активирующая холинергическая система БПМ находится под тормозным контролем гипногенного механизма. Кроме того, медиальная преоптическая область и передний гиппоталамус, которые часто рассматриваются как часть вентральной гипногенной системы переднего мозга, контролируя сон, действуют на холинергическую систему БПМ через тормозные синапсы. Каудо-таламо-кортикальная система К регуляции уровня активности организма имеют отношение и базальные ганглии. Другое их название – стриопаллидарная система, которая представляет собой комплекс нейрональных узлов, центрально расположенных в белом веществе больших полушарий головного мозга. Мысль о причастности стриопаллидарной системы к регуляции функционального состояния впервые была высказана в 60-е гг. Н. Бухвальдом и М. Деметреску, которые, опираясь на эксперименты с регистрацией ЭЭГ, предположили существование в хвостатом ядре стриопаллидума самостоятельных активирующей и тормозной систем. В связи с этим стали говорить о роли хвостатого ядра в регуляции уровня «готовности», «внимания» и «бодрствования». Позже, в 70-х гг., С. Гросберг внес уточнение в понимание связи стриопаллидума с активацией, высказав мысль о причастности стриарных ядер к регуляции активационных процессов в мозге в связи с требованиями, поставленными в задаче, которую необходимо решить, или поведением, которое должно быть реализовано. С. Гросберг видел в этом основу для нейрофизиологического механизма произвольного внимания. Данный механизм обеспечивает избирательную готовность афферентного, ассоциативного и эфферентного звеньев для выполнения конкретного целенаправленного поведения. В 80-е гг. эта идея получила развитие в работах Н.Ф. Суворова и О.П. Таирова [1985]. Они считают, что любому состоянию человека или любому виду деятельности соответствует своя картина распределения активации по участкам неокортекса, которую можно наблюдать по ЭЭГ. При этом ведущая роль в формировании избирательной активации неокортекса, определяющей избирательность восприятия и действий, принадлежит стриопаллидарной системе, которая сама находится под контролем коры. Именно она распределяет активационные ресурсы мозга, которые не безграничны. Большое количество экспериментальных данных позволяет предполагать, что ключевой структурой базальных ганглиев является неостриатум, или хвостатое ядро (n.caudatus). Он находится под контролем коры, получая проекции практически от всех ее зон. С другой стороны, уровень активности стриатума находится под влиянием активности систем подкрепления, так как на нем конвергируют проекции дофаминергических и норадреналинергических структур ствола мозга, представляющих системы положительного и отрицательного подкрепления. Выходы стриатума участвуют в регуляции мышечного тонуса через нисходящие пути в спинной мозг и в распределении восходящей в кору неспецифической активации. Последнее достигается через влияние стриатума на таламус, который выполняет функцию контролируемого стриатумом фильтра, стоящего на пути восходящей к коре неспецифической активации. В результате влияния стриатума на таламус картина распределения активации в нем соответствует мотивационному возбуждению и кортикофугальным сигналам, поступающим в стриатум. На уровне коры это трансформируется в распределение активации, которое отвечает требованиям поставленной задачи и реализации целенаправленного поведения. Модулирующие нейроны В нервной системе выделена особая группа клеток – модулирующих нейронов, которые сами не вызывают реакции, но регулируют активность других нейронов. Они образуют контакты с другими нейронами типа «синапс на синапсе». Модулирующие нейроны причастны к регуляции болевой чувствительности. Схема взаимодействия модулирующего нейрона с сенсорным, проводящим сигналы о болевом раздражении, описана Л. Иверсон (1984) следующим образом. Синаптическая передача болевых сигналов в головной мозг, опосредуемая веществом Р, находится под контролем нейропептидов, подавляющих болевые сигналы. В задних рогах спинного мозга вставочные модулирующие нейроны, выделяющие нейропептид–энкефалин, образуют синапсы на аксонных окончаниях болевых нейронов. Энкефалин тормозит выход вещества Р, что уменьшает возбуждение постсинаптического нейрона, посылающего в головной мозг сигналы о боли. Функции модулирующих нейронов наиболее хорошо изучены на моллюсках. Показана причастность модулирующих серотонинергических нейронов виноградной улитки к регуляции состояния организма. Улитку, которая ползала по шару, плавающему в воде, в течение 8 дней подвергали сильному электрическому раздражению вне сочетания с тестирующим стимулом – слабым тактильным раздражением. Это увеличивало величину реакции улитки на тактильный стимул – втягивание глазных щупалец. Эффект сохранялся в течение многих дней. Однако он проявлялся только в той обстановке, в которой применялось болевое раздражение (на шаре в воде) и отсутствовал, когда улитка тестировалась в других условиях – на стеклянной крышке аквариума. Применение нейротоксина, избирательно нарушающего работу серотонинергических нейронов, устраняло его проявление. Это одна из форм долговременной сенситизации, проявляющая себя как обстановочный условный рефлекс и требующая участия модулирующих серотонинергических нейронов. Предполагается, что данный обстановочный условный рефлекс реализуется на входах модулирующих нейронов, которые являются нейронами «состояния» [Балабан и др., 1992]. Модулирующие нейроны участвуют в процессе научения (см. гл. 15), изменяя проводимость синапса на пресинаптическом уровне. Эффект пресинаптической пластичности, создаваемый модулирующими нейронами, может быть начальным звеном в цепи событий, приводящих к пластической модификации поведения, связанной с выработкой условных рефлексов. Безусловное подкрепление как очень сильный раздражитель нейрона также возбуждает модулирующие нейроны и тем самым инициирует процесс пресинаптических изменений. За последним следует этап клеточных и молекулярных преобразований постсинаптического нейрона, характеризующий ассоциативное обучение. Однако пресинаптическое облегчение, создаваемое модулирующими нейронами, может возникать и вне ситуации ассоциативного обучения только за счет активации модулирующих нейронов сильными сенсорными раздражителями. Э. Кэндел и Р. Хокинс [1992] рассматривают его как результат «премодулирующего совпадения», которое на пресинаптическом уровне повышает проводимость, а само это повышение зависит от активности. Другое название этого явления – сенситизация, или неассоциативное обучение. Оно отличается от ассоциативного обучения, основанного на «пре-постсинаптическом совпадении» (рис. 8.1) Эффект пресинаптического облегчения с участием модулирующих нейронов хорошо изучен при формировании оборонительного рефлекса у виноградной улитки. Внутриклеточная стимуляция ее модулирующих нейронов, которые представлены пулом серотонинергических клеток педального ганглия, вызывает в командном нейроне оборонительной реакции появление деполяризационной волны и увеличение амплитуды суммарного ВПСП. Эти изменения превращают сенсорное подпороговое раздражение командного нейрона в пороговое, что выражается в появлении у него спайковой активности.
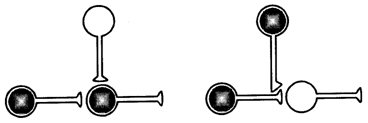
Рис. 8.1. Два механизма изменения силы связи между нейронами. Один требует совпадения активности пресинаптического и постсинаптического нейронов во времени. Другой основан на совпадении активности пресинаптической клетки и модулирующей. Нейроны, участвующие в научении, заштрихованы [Кэндел, Хокинс, 1992] Описаны два механизма длительного пресинаптического облегчения (фасилитации) под влиянием серотонина за счет фосфорилирования двух типов ионных каналов: кальциевых и калиевых (рис. 8.2). Участие кальциевых каналов в механизме повышения проводимости через синапс выглядит следующим образом. Во время потенциала действия ионы кальция и натрия входят в клетку, а ионы калия выходят из нее. Когда нейрон находится в активном состоянии, в нем увеличивается уровень содержания ионов кальция. Кальций, вошедший в клетку, действует на нее после того, как связывается с белком – кальмодулином. Этот комплекс так же, как и серотонин, активирует аденилатциклазу. За счет двойного воздействия на нее резко увеличивается образование CAMP из аденозиттрифосфата (АТФ), который служит в клетке универсальным источником энергии для биохимических процессов; CAMP действует как вторичный посредник и активирует протеинкиназу. Протеинкиназа фосфорилирует рецепторные белки кальциевых каналов (присоединяет к ним фосфор). Это переводит кальциевые каналы в активное состояние – в клетку входит больше кальция, что увеличивает выделение из нее медиатора. Одновременно протеинкиназа фосфорилирует белки калиевых каналов. Это ведет к уменьшению проводимости для ионов калия, т.е. к уменьшению калиевого тока, что ограничивает калиевую гиперполяризацию, следующую за ВПСП и потенциалом действия. Таким образом, потенциал действия продлевается, а это, в свою очередь, увеличивает продолжительность активного состояния кальциевых каналов. Особую функцию в модуляции возбудимости нервной системы выполняют пейсмекерные нейроны (см. гл. 1). Будучи активированными, они своими длительными разрядами могут повышать проводимость сигнала через синапс. Специальный тип пейсмекерных нейронов, генерирующих разряды на частоте гамма-колебаний, которые, по-видимому, отражают колебания кальциевого тока на дендритах клеток таламуса, синхронизирует активность больших массивов нейронов, объединенных общими резонансными свойствами.
Рис. 8.2. Схема молекулярных реакций в пресинаптическом нейроне под влиянием возбуждения модулирующего серотонинергического нейрона – научение, зависимое от активности [Кэндел, Хокинс, 1992]
|
||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 509; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.014 с.) |