
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
III. Биологически важные реакции a- аминокислотСодержание книги
Поиск на нашем сайте
1. Способность к образованию внутренних солей (биполярных, или «цвиттер» – ионов). Карбоксильная группа проявляет кислотные свойства, диссоциирует с отщеплением протона. Амино-группа, которая проявляет основные свойства, способна протонироваться по неподеленной электронной паре атома азота. В результате в водных растворах и в кристаллическом состоянии аминокислоты существуют в виде внутренних солей:
NH2-CH-COOH NH3-CH-COO- ½ ® ½ R R
Суммарный заряд молекулы зависит от строения радикала R и рН среды: а) моноаминомонокарбоновая кислота:
OH- + H+ + [NH2-CH2-COO-] -1 ® [NH3-CH2-COO -]0 ®[ NH3-CH2-COOH]+1
б) моноаминодикарбоновая кислота:
NH2-CH-COO- -2 NH3-CH-COO- -1 NH3-CH-COO- ° ½ HO- ½ Н+ ½ CH2 ® CH2 ® CH2 ½ ½ ½ COO- COO- COOН
2Н+
NH3-CH-COOH +1 ½ CH2 ½ СOOH в) диаминомонокарбоновая кислота:
NH2-CH-COO- ° + NH3-CH-COO- +1 + NH3-CH-COOH +2 ½ HO- ½ Н+ ½ (CH2 )4 ® (CH2)4 ® (CH2)4 - ½ ½ ½ + NH3 +NH3 +NH3
¯2НО-
NH2-CH-COO- -1 ½ (CH2)4 ½ NH2 Свойство аминокислот изменять заряд при определенном значении рН, а следовательно, двигаться в электрическом поле к разным электродам лежит в основе метода электрофореза, который используется для разделения смесей аминокислот и белков. Значение рН среды, при котором суммарный заряд молекулы равен нулю, называется изоэлектрической точкой (ИЭТ, или рНi , или pI). В ИЭТ молекула теряет электрофоретическую подвижность, снижается растворимость белка в воде, он может выпадать в осадок. 2. Реакция декарбоксилирования:
декарбоксилаза CO2 +
t°, Ba(OH)2 гистидин гистамин
триптофан триптамин
В результате реакции декарбоксилирования a- аминокислот образуются биогенные амины, обладающие сильной физиологической активностью, многие из них являются аллергенами, большинство обладает сосудосуживающими свойствами (исключение – гистамин), участвуют в регуляции жизненно важных функций организма. 3. Реакции дезаминирования: а) дезаминирование по Ван-Слайку in vitro:
глицин гликолевая кислота По объему выделяющегося газообразного азота судят о количестве аминокислоты в растворе. б) неокислительное дезаминирование in vivo протекает у низших организмов (бактерий, грибов): -NH3
¯ фумаровая кислота NH2 аспарагиновая кислота
в) окислительное дезаминирование in vivo: фермент, НАД+
½ -НАД.H;-H+ NH 2 NH глутаминовая кислота H2O
O a- кетоглутаровая кислота Реакция протекает под действием фермента глутаматдегидрогеназы и кофермента НАД+.
4. Реакция трансаминирования (переаминирования) in vivo: фермент трансфераза
½ пиридоксальфосфат CH3 (вит. В6) аланин a- кетоглутаровая кислота
½ ½ CH3 NH2 пировиноградная глутаминовая кислота кислота
-H2O
½ ½ ½ ½ R 1 OH R2 OH Дипептид Последовательность аминокислот, соединенных между собой пептидными связями, является первичной структурой белков. Процесс, обратный образованию пептида, называется гидролизом. Существуют три вида гидролиза белка: кислотный, щелочной и ферментативный. Результатом является образование смеси аминокислот, которые могут быть разделены и идентифицированы методами хроматографии или электрофореза. Таким образом определяют аминокислотный состав белка.
Рассмотрим пример: Составить трипептид Глу-Асн-Про и дать ему полную характеристику.
глутамил-аспарагинил-пролин
В названии пептида окончания аминокислот меняются на «ил», кроме последней аминокислоты. Характеристика пептида. 1. Реакция пептида на индикатор – кислотная, так как в пептиде две кислотные группы – СOOH и одна основная –NH2
(группа – С=О не проявляет основных свойств – см. классификацию) ½ NH2 2. Суммарный заряд пептида в водной среде:
+
4. Изоэлектрическая точка пептида (определение см. выше) лежит в слабокислой среде. 5. Поверхностные свойства пептида зависят от соотношения гидрофильных и гидрофобных боковых радикалов и концевых групп. В пептиде содержатся 4 гидрофильные группы: 2-СOOH, -C=O, +NH3 и одна гидрофобная: радикал пролина ½ NH2 Гидрофильных групп больше, поэтому поверхность пептида гидрофильна, он растворим в воде. Пептиды являются продуктом частичного гидролиза белков. Но многие пептиды присутствуют в свободном состоянии в клетках и тканях и выполняют специфические биологические функции. К ним относятся гормоны, антибиотики и другие соединения, обладающие высокой биологической активностью. Самостоятельное значение пептидов в процессах жизнедеятельности человеческого организма велико. В нервной ткани выделены нейропептиды, влияющие на функции нервной системы: энкефалины, эндорфины – «опиоидные» пептиды, аналогично морфину подавляющие боль; пептиды, действующие на сон; пептиды памяти и др. Известны гормоны пептидной природы: окситоцин, вазопрессин (гормоны задней доли гипофиза), меланоцитстимулирующий гормон (выделяется средней долей гипофиза), адренокортикотропный гормон (АКТГ) (передней доли гипофиза), глюкагон (поджелудочной железы), гормоны желудочно-кишечного тракта и др. К пептидам относятся токсины, выделенные из бледной поганки, токсины яда пчел, змей, скорпионов, морских позвоночных. В медицине используются пептиды-антибиотики: грамицидин S, актиномицин и др.; пептиды-регуляторы иммунитета: тафцин; пептиды – заменители сахара: аспартам и т.д.
Строение пептидной связи
¾ ¾ N ¾ ½ H
В результате связь C-N приобретает характер двоесвязанности, становится «полуторной». Вращение вокруг этой связи затруднено. В большинстве природных белков и пептидов имеет место транс-конфигурация пептидной связи, что важно для стабилизации вторичной структуры.
½
½ H лактам лактим
За счет лактимной формы пептиды дают качественную цветную реакцию с ионами Сu2+ аналогично биурету – веществу, получаемому из 2 молекул мочевины:
-NH3
мочевина биурет
лактамная форма биурета лактимная форма биурета
Эта реакция называется биуретовой. Она используется как качественная реакция для обнаружения пептидов и белков.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 383; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.239.70 (0.008 с.) |








 +
+






 in vivo
in vivo

 in vitro
in vitro


 СО2 +
СО2 + NH2-CH2-COOH + HONO N2 + HO-CH2-COOH + H2O
NH2-CH2-COOH + HONO N2 + HO-CH2-COOH + H2O HOOCCH-CH 2 ®COOH HOOC –CH=CH-COOH
HOOCCH-CH 2 ®COOH HOOC –CH=CH-COOH


 HOOC – (CH2)2 – C H _ COOH HOOC-(CH2)2-C-COOH
HOOC – (CH2)2 – C H _ COOH HOOC-(CH2)2-C-COOH HOOC-(CH2)2-C-COOH
HOOC-(CH2)2-C-COOH
 -NH3
-NH3
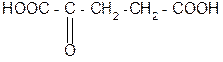 NH2-CH-COOH +
NH2-CH-COOH + О=С-СOOH + НООС-СH-(СH2)2-СOOH
О=С-СOOH + НООС-СH-(СH2)2-СOOH 5. Способность к образованию полипептидов. Карбоксильная группа одной аминокислоты может реагировать с аминогруппой другой аминокислоты с образованием пептидной связи:
5. Способность к образованию полипептидов. Карбоксильная группа одной аминокислоты может реагировать с аминогруппой другой аминокислоты с образованием пептидной связи: NH2-CH-C=O + H -NH-CH-C=O
NH2-CH-C=O + H -NH-CH-C=O
 -2H2O
-2H2O
 + +
+ +




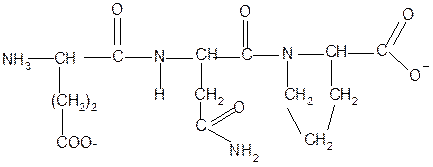 -1
-1
 3. Изменение суммарного заряда с изменением рН среды. Запишем пептид в упрощенном виде, выделив лишь заряженные группы и обозначив остальную часть пептида радикалом R: +
3. Изменение суммарного заряда с изменением рН среды. Запишем пептид в упрощенном виде, выделив лишь заряженные группы и обозначив остальную часть пептида радикалом R: +
 0 +1
0 +1 

 -1 H+ + H+
-1 H+ + H+ 


 +
+  OH-
OH-

 -2
-2

 ..
.. Атом углерода пептидной связи находится в sp2 –гибридизации. Неподеленная электронная пара атома азота вступает в сопряжение с p- связью. Таким образом, пептидная связь представляет собой трехцентровую r,p- сопряженную систему.
Атом углерода пептидной связи находится в sp2 –гибридизации. Неподеленная электронная пара атома азота вступает в сопряжение с p- связью. Таким образом, пептидная связь представляет собой трехцентровую r,p- сопряженную систему.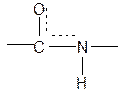
 Для пептидной связи характерно явление лактам-лактимной таутомерии:
Для пептидной связи характерно явление лактам-лактимной таутомерии:
 OH
OH
 N ¾ ¾ C = N ¾
N ¾ ¾ C = N ¾

 +
+







