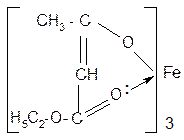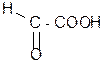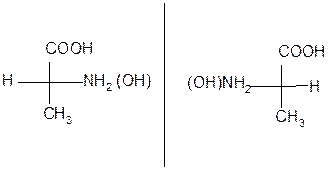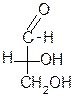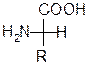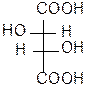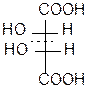Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
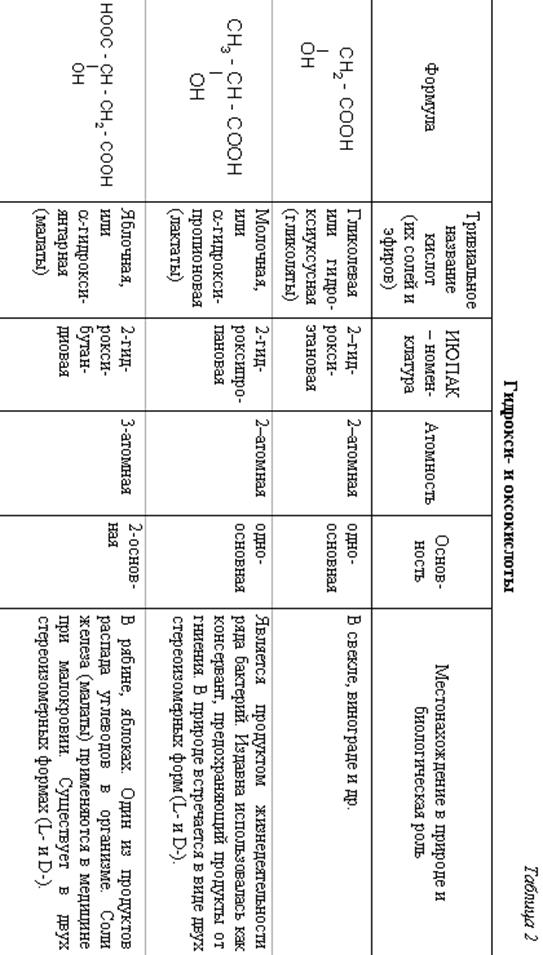
По атомности по основности по взаимному расположениюСодержание книги
Поиск на нашем сайте
Двух функциональных групп
Виды изомерии: структурная – по положению 2-й функциональной ОН – группы относительно – СООН; стереоизомерия (энантиомерия, диастереомерия) Химические свойства I Гидроксикислоты проявляют общие свойства спиртов и кислот. В зависимости от реагентов и условий проведения реакций взаимодействует ОН или -СООН группа или обе одновременно. Как кислоты они более сильны, чем соответствующие карбоновые кислоты (сказывается –I эффект ОН- группы). П. Гидроксикислоты проявляют специфические свойства, которые обусловлены взаимным влиянием ОН- и СООН- групп.
1. Например, своеобразная реакция отщепления воды при нагревании. Она позволяет отличить a-, b-, g- и другие гидроксикислоты.
a t°
гидролиз + 2H2O + H+ или OH-
a лактиды (циклические
б) b a t°
-H2O
b -оксимасляная кротоновая кислота кислота
гидролиз g H+
g-гидроксимасляная g - бутиролактон кислота (ГОМК) ГОМК обладает наркотическим действием, нетоксична, применяется в виде натриевой соли как снотворное средство и при неингаляционном наркозе при операциях. г)
t°
гидролиз H+ d d-гидроксивалериановая d - валеролактон лактон
Лактиды и лактоны могут гидролизоваться в кислой среде с образованием исходных гидроксикислот. 2. Разложение a-гидроксикислот при нагревании в присутствии H2SO4:
a t°, H2SO4
Многоосновные кислоты ведут себя так же. Например,
а) при нагревании лимонная кислота будет вести себя как b-гидроксикислоты:
t°
-Н2О
+ Н2О
против правила Марковникова изолимонная кислота
б) при действии H2SO4 и нагревании она ведет себя как a-гидроксикислота, т.е. разлагается с выделением муравьиной кислоты:
ацетондикарбоновая
Таблица 1 Гидрокси – и оксоальдегиды и кетоны
Оксокислоты
Наиболее важные природные оксокислоты представлены в Таблице 3 Химические свойства I. Они проявляют общие свойства, присущие альдегидам или кетонам и кислотам, но как кислоты они сильнее соответствующих карбоновых кислот (сказывается –I эффект карбонильной группы) П Специфические свойства, обусловленные взаимным влиянием >C=O и -COOH групп: 1. Расщепление a- и b- оксокислот при нагревании – декарбоксилирование:
dˉ
: –d
кето-форма енольная форма ацетоуксусная кислота (АУК)
Обе формы известны в свободном состоянии и могут быть при определенных условиях выделены. Однако они обе неустойчивы – легко превращаются в равновесную смесь с содержанием кето-формы (93%) и енольной (17%). Стойкость енола по сравнению с другими енольными формами возрастает из-за сопряжения. Для доказательства существования обеих форм пользуются соответствующими реакциями. Например, как кетон АУК восстанавливается до вторичного спирта, реагирует с HCN, фенилгидразином и т.д. Как енол АУК или ее этиловый эфир (ацетоуксусный эфир) дает окрашивание при действии разбавленного водного раствора FeCl3 вследствие образования комплексной железной соли (хелата):
Таблица 3 Оксокислоты
Стереоизомерия Стереоизомеры отличаются друг от друга пространственным расположением атомов или групп атомов. Стереоизомеры
Энантиомеры Диастереомеры (оптические, или зеркальные, изомеры)
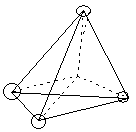
Знание стереоизомерии очень важно для изучения строения природных соединений (биорегуляторов и лекарственных средств – гормонов, витаминов, антибиотиков), так как все они существуют в строго определенных пространственных формах и их биологическая активность тесно связана с пространственным строением. Так, для построения белковой молекулы используется один вид энантиомеров – L– аминокислоты, а в классе углеводов большее распространение имеют D–сахара. Из двух энантиомерных форм гормона адреналина большей фармакологической активностью обладает D(-)–форма. Стереоспецифично протекают многие биохимические реакции, так как они катализируются ферментами – белковыми молекулами. Приведем некоторые примеры значения диастереомерии. Бутендиовая кислота существует в виде двух геометрических изомеров (цис- и транс-), но только один из них – фумаровая кислота (транс–изомер) – служит субстратом для действия фермента. Ретинол с транс–расположением всех двойных связей более эффективен в процессах зрения, чем его цис–изомер. В липиды клеточных мембран в качестве структурных составляющих входят также только цис-формы высших жирных кислот. Энантиомерия осуществляется у так называемых «хиральных» молекул. Хиральными, или асимметрическими, молекулами называются те, которые не могут быть совмещены со своим зеркальным отражением; у них отсутствует плоскость симметрии:
Термин «хиральность» произошел от греческого слова «хиро» – рука. Самым простым наглядным примером хиральных объектов являются правая и левая руки. Атом углерод с четырьмя различными группами называется асимметрическим, или хиральным, центром.
Для изображения энантиомеров на плоскости используются проекционные формулы Фишера, называемые проекциями Фишера:
Энантиомеры
Относительная и абсолютная конфигурация. Определение абсолютной конфигурации стало возможным только с появлением современных физико-химических методов (рентгеноструктурного анализа) в 50-х годах. Однако нет необходимости устанавливать ее для каждого соединения. Можно охарактеризовать их путем сравнения конфигураций с абсолютной конфигурацией эталонных (ключевых) соединений, т. е. определить их относительную конфигурацию. За такой эталон условно принят глицериновый альдегид, предложенный в 1906 г. Н.А. Розановым:
D- глицериновый L-глицериновый альдегид альдегид
Считается, что все вещества, родственные глицериновому альдегиду по конфигурации хирального центра, т.е. с расположением групп – ОН, -NH2, - Hal справа, относятся к D–ряду, слева – к L– ряду.
Например:
D - аминокислота L – аминокислота
Запомним, что D и L указывают на относительную конфигурацию молекулы. Познакомимся с некоторыми свойствами подобных молекул. Хиральным соединениям свойственна способность вращать плоскость поляризованного света вправо (+) или влево (-), что называется оптической активностью. Отсюда и другое название энантиомеров – оптические изомеры. Условиями оптической активности являются:
Мерой оптической активности является [a]D - удельное вращения; характеризует угол и направление вращения плоскости поляризованного света. Знак вращения (+) или (-) не связан с конфигурацией D и L и определяется только инструментально на приборе – поляриметре или сахариметре (для сахаров). Например,
D(-) –молочная D(+)- глицериновый кислота альдегид
Многие биологически важные вещества содержат в молекуле более одного центра хиральности. Подсчет числа стереоизомеров производится по формуле N= 2n, где n – число хиральных центров. Представителем соединений с двумя центрами хиральности служит винная кислота. Рассмотрим этот пример подробнее. У винной кислоты n=2, т.е. N= 22 = 4.
1 2 3 4
1. D–винная кислота; 2. L-винная кислота; 3 и 4 – мезовинная кислота
1 и 2 – это энантиомеры (D и L). Они отличаются не по физическим и химическим свойствам, а только знаком вращения плоскости поляризованного света. Формулы 3 и 4 являются идентичными. Формулы 1 и 3, 2 и 3 являются пространственными изомерами, но не зеркальными, это диастереомеры. Они отличаются по физическим и химическим свойствам. При отнесении энантиомеров к D– или L-ряду пользуются «оксикислотным ключом», т.е. сравнивают со стандартом тот хиральный центр, который остался без изменения при переходе от него. В данном случае это верхний хиральный центр (приведите путь превращения глицеринового альдегида в винную кислоту). D– и L- энантиомеры проявляют оптическую активность. Мезовинная кислота – типичный пример молекулы, содержащей центры хиральности, но в целом являющейся ахиральной из-за наличия плоскости симметрии и потому не проявляющей оптическую активность. Рацемат – это смесь равных количеств энантиомеров. Оптической активностью не обладает, вследствие компенсации вращения. Таким образом, у винной кислоты существуют 4 формы: 2 энантиомера (D- и L-), 1 мезо-форма и 1 рацемическая смесь. Рацемические смеси получаются синтетическим путем. Поскольку природные источники не могут удовлетворить потребности современной биоорганической и биологической химии в разнообразных оптически активных соединениях, то либо расщепляют рацематы, либо ведут асимметрический синтез. Существует несколько способов расщепления рацематов: а) механический отбор кристаллов по их форме – исторически первый метод, примененный Луи Пастером; б) биохимический (ферментативный) метод; в) химический – через диастереомеры; г) хроматографический на оптически активных сорбентах.
Глоссарий Лактон – внутренний циклический сложный эфир, образующийся при нагревании g- и d-гидроксикислот. Лактид – циклический сложный диэфир, образующийся при нагревании a- гидроксикислот; имеет две сложноэфирные связи. Ацетоуксусный эфир – этиловый эфир ацетоуксусной кислоты. Таутомерия – явление существования в растворе равновесных изомерных форм, способных переходить в друг в друга; равновесная динамическая изомерия. Кето-енольная таутомерия – равновесие между кетонной и енольной формами Стереоизомеры – это изомеры, отличающиеся пространственным расположением атомов в молекуле. Плоскость симметрии – это воображаемая плоскость, проходящая через молекулу или атом углерода с его заместителями и делящая молекулу на две симметричные части. Оптическая активность – способность вещества вращать плоскость поляризованного света вправо или влево. Хиральность – отсутствие плоскости симметрии, несовместимость со своим зеркальным изображением. Энантиомеры – это стереоизомеры, молекулы которых относятся между собой как предмет и несовместимое с ним зеркальное изображение. Диастереомеры – стереоизомеры, не являющиеся зеркальным отражением друг друга, обладающие различными физико-химическими свойствами. Рацемическая смесь (рацемат) – эквимолярная смесь энантиомеров (1:1)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-19; просмотров: 477; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.104.18 (0.014 с.) |

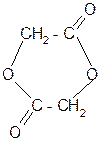
 а)
а)
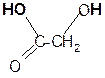
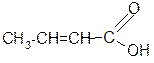
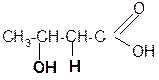 сложные эфиры)
сложные эфиры)
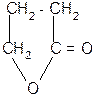 в) b a t°
в) b a t°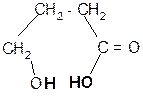
 + H2O
+ H2O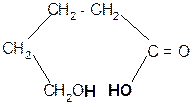
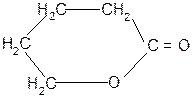 b a
b a
 g + H2O
g + H2O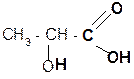
 CH3–CHO + HCOOH
CH3–CHO + HCOOH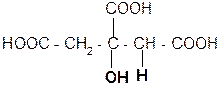
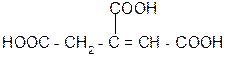

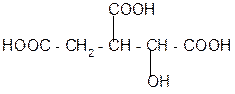 лимонная кислота цис-аконитовая к-та
лимонная кислота цис-аконитовая к-та

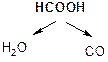
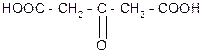 t°, H2SO4
t°, H2SO4 +
+



 кислота
кислота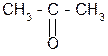 2СO2 +
2СO2 +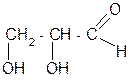
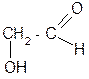

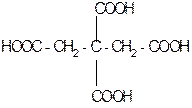 Продолжение таблицы 2
Продолжение таблицы 2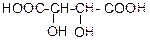
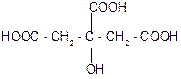
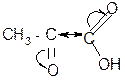 dˉ
dˉ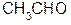 d+ d+ t°, H2SO4разб.
d+ d+ t°, H2SO4разб. а) + CO2
а) + CO2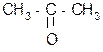 b t° комн.
b t° комн.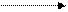
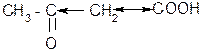 б) + CO2
б) + CO2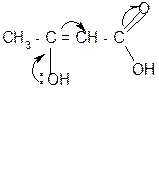 2. Кето-енольная таутомерия b-оксокислот.
2. Кето-енольная таутомерия b-оксокислот. d+ a
d+ a