
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Перехід від вищих моносахаридів до нижчих.Содержание книги
Поиск на нашем сайте
Існує декілька методів переходу від вищих моносахаридів до нижчих. Заслуговують на увагу взаємодія з гідроксиламіном (розщеплення за А. Волем, 1893 р.) і окиснювальна деградація за О. Руффом (1899 р.) Під дією гідроксиламіну з альдогексози утворюється відповідний оксим, який за допомогою оцтового ангідриду дегідратується до гідроксинітрилу. Реакція супроводжується також ацилюваниям вільних гідроксильних груп глюкози. Нітрильна група в ацильованому гідроксинітрилі вилучається при обробці аміачним розчином оксиду срібла. Одночасно під дією аміаку відбувається амоноліз ацетоксильних груп моносахариду з регенерацією гідроксильних груп. В результаті утворюється альдопентоза з меншою кількістю вуглецевих атомів:
Деградація (розщеплення) за Руффом полягає в окислювальному декарбоксилюванні солей альдонових кислот, наприклад глюконової під дією суміші пероксиду водню та солі заліза (III):
Дія лугів (епімеризація). Луги за нормальних умов викликають кето-енольну таутомерію біля С1 і С2 атомів вуглецю моносахаридів, що зумовлює їх епімеризацію. При цьому з одного моносахариду утворюються відповідні епімери. Наприклад, при дії на D-глюкозу розчином лугу вона на 2-3% перетворюється в D-манозу і на 31% у D-фруктозу через стадію проміжного ендіолу:
Взаємодія з фенілгідразином. Дія фенілгідразину на моносахариди дозволяє виділяти їх у чистому вигляді, встановлювати будову і головне переходити від альдоз до кетоз. Фенілгідразин взаємодіє спочатку з альдозою, як із звичайним альдегідом з утворенням фенілгідразону, здатного таутомеріно ізомеризуватися в енгідразин. Останній у результаті відщеплення аніліну утворює моноімін кетальдегіду. При взаємодії з наступними двома молекулами фенілгідразину синтезується озазон – кристалічна речовина, за допoмогою якої можна ідентифікувати вихідні моносахариди. У кислому середовищі озазони утворюють кетальдегіди - озони, з яких за допомогою відновлення добувають відповідну кетозу:
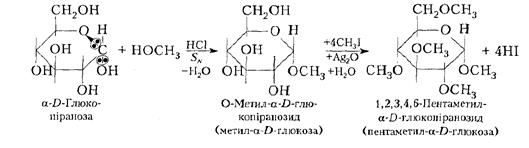
Моносахариди беруть участь у хімічних реакціях також і в напівацетальній формі. Алкілювання моносахаридів. При алкілюванні, наприклад, глюкози слабким алкілюючим агентом, як СН3ОН, у присутності розчину НСІ реагує тільки глікозидний гідроксил з утворенням відповідного глікозиду, чи ацеталю. Глікозид – ацепшль або кеталь моносахариду, який існує в α- і ß-формах. Інші чотири ОН-групи глюкози при цьому в реакції участь не беруть. До глікозидів відносяться похідні моносахаридів, в яких глікозидний гідроксил заміщений будь-яким невуглеводним залишком – агліконом і сполучений з циклом моносахариду через атом кисню, азоту або вуглецю. Ацеталі глюкози (глікозиди) прийнято називати глюкозидами, галактози - галактозидами тощо, а кеталі фруктози - фруктозидами. Підвищену реакційну здатність глікозидного гідроксилу пояснюють впливом етерового атома кисню, який зміщує частково електрони суміжних С-О-зв'язків на себе. Таке зміщення електронної густини збільшує полярність зв'язку між атомом вуглецю і ОН-групою:
Глікозиди на зразок метил-α- D-глюкози не здатні до мутаротації у водних розчинах, не відновлюють аміачний розчин оксиду срібла до металічного срібла або Сu(ОН)2 до Сu2О і тому є невідновлюючими сахаридами. При дії надлишку сильніших алкілюючих агентів (алкілгалогенідів, діалкіл-сульфатів (RО)2 SО2 тощо) алкілюються інші чотири гідроксили з утворенням повного етеру. Механізм алкілювання за глікозидним гідроксилом полягає в заміщенні його СН3О-групою. При алкілюванні інших гідроксильних груп галоген алкілами механізм реакції полягає в заміщенні атомів водню ОН-груп алкілами СН3- і подібний до механізму утворення етерів:
При гідролізі повністю алкільованих моносахаридів у м'яких умовах у першу чергу гідролізується ацетальна група, утворена завдяки глікозидному гідроксилу. Для діалкілових етерів R—О —R при цьоот гідроліз не спостерігається. У жорсткіших умовах гідролізуються інші чотири етерові зв'язки до вихідного моносахариду. Таким чином, повністю метильована глюкоза містить ацетальний і етерні зв'язки, що утворилися різними шляхами і гідролізуються в різних умовах. Ацилювання моносахаридів. Моносахариди ацилюються звичайними ацилюючими агентами до естерів:
Аналогічно етерам моносахаридів при гідролізі естерів у першу чергу гідролізується естерова група, утворена глікозидним гідроксилом. Це використовують для синтезу інших похідних моносахаридів, а також дисахаридів. Наприклад, при дії бромоводню в умовах м'якого гідролізу пентацетил-α-D-глюкози виникає тільки монобромопохідна, оскільки гідролізується лише естерний зв'язок, утворений глікозидні гідроксилом:
Бродіння моносахаридів. При анаеробному (без доступу повітря) бродіння гексоз (пентозам бродіння не властиве) відбувається розщеплення моносахаридів на простіші речовини з основному під впливом мікроорганізмів. Хімізм бродіння досить складний, багатоплановий і до кінця ще не вивчений. Для деяких гексоз характерне розщеплення молекул до спирту і вуглекислого під дією ферментів на зразок зимази - спиртове бродіння. Цю суміш ферментів виробляють дріжджові гриби. При спиртовому бродінні процес перетворення глюкози в етиловий пирт можна уявити у вигляді спрощеної схеми (глюкоза → гліцериновий альдегід → гліцеринова кислота → піровиноградна кислота → оцтовий альдегід→ етиловий спирт) та спрощеного рівняння: С6Н12О6 → 2С2Н5ОН + 2СО2 Гексоза Етиловий спирт під дією ферментів утворюється лише з D-глюкози, D-фруктози та D-манози. При зміні природи мікроорганізмів та інших умов процесу для моносахаридів крім спиртового відомі декілька видів бродіння. Молочнокисле бродіння (лактатне) відбувається під дією молочнокислих бактерій, і з глюкози добувають до 90% рацемічної суміші молочної кислоти за спрощеними схемою і рівнянням аналогічно глюкозі: Глюкоза → гліцериновий альдегід →гліцеринова кислота→ піровиноградна кислота → молочна кислота:
Фермент
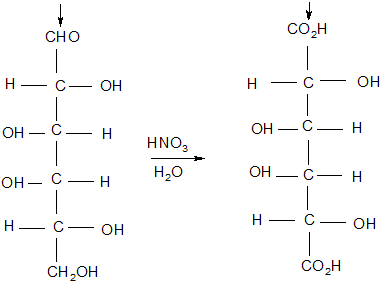
С6Н12О6 → 2СН3–СН– СООН | ОН Крім молочної кислоти у реакційному середовищі одержується також оцтова кислота, етиловий спирт, вуглекислий газ. Молочна кислота в процесі бродіння утворюється при виготовленні сиру, квашеної капусти, силосуванні кормів. Гліцеринове бродіння за хімізмом являє собою відхилення від маршруту спир-тового бродіння: глюкоза → гліцериновий альдегід → гліцерин: Фермент С6Н12О6 → 2СН2–СН– СН2 | | | ОН ОН ОН Для запобігання перебігу процесу по спиртовому маршруту до реакції суміші додають гідросульфіт натрію або амонію з метою зв'язування оцтового альдегіду, який виникає на відповідному етапі з піровиноградної кислоти. Пропіоновокисле бродіння проходить через низку хімічних перетворень за участю таких сполук: глюкоза → гліцериновий альдегід → гліцеринова кислота → піровиног-радна кислота → щавлевооцтова кислота → яблучна кислота → фумарова кислота → бурштинова кисло → пропіонова кислота: С6Н12О6 → СН3 – СН2 – СООН + СО2 Бутиратнокисле (маслянокисле) бродіння за хімізмом відбува ся анна-логічно спиртовому до утворення піровиноградної кислоти далі перетворює-ться в бутиратну: глюкоза → піровиноградна кислота → бутиратна кислота: С6Н12О6 → СН3 – СН2 – СООН + СО2 Ацетонобутанолове бродіння на перших стадіях відбувається аналогічно спиртовому. Одержана піровиноградна кислота при цьому перетворюється в бутиратний альдегід (відновлення його приводить до виникнення 1-бутанолу) або в ацетоцтову кислоту (декарбоксилювання її викликає появу ацетону) (X. Вейцман): фермент С6Н12О6 → С4Н9ОН + СН3–С– СН3 + СО2 || О 1.3.2.Доказ сруктури D-(+)глюкози Майже сто років назад (в 1888 р.)Еміль Фішер почав свою блискучу роботу,яка привела до встановленню стереохімії (+) - глюкози. Але він тоді не мав обладнання,без якої зараз ми не уявляємо собі хімічну лабораторію. Найбільш складним приладом в той час був, поляриметр. Фішер розумів,що він зможе розрізнити енантіомери моносахаридів.Оскільки він знав,що (+)-глюкоза є альдогексозою, Фішер обмежив круг своїх дослідів восьми енантіомерами, віднесених до D-ряду.Нижче в спрощеному вигляді перечислені стадії, які в кінцевому результаті дозволили встановити конфігурацію (+)-глюкози. 1 .(+)-Глюкоза окислюється до оптично активної альдаривої кислоти під дією азотної килоти. Внаслідок, продукт реакції – глюкрова кислота – не може володіти плоскістю симетрії. В іншому випадку вона була б ахіральною,але н оптично активною. І так,структури, відомі зараз під назвою аллози і галактози, повинні бути відкинуті. Обидві вони призвели б до утворення мезо- альдарових кислот.
Не може бути глюкозою мезо- дикарбонова кислота
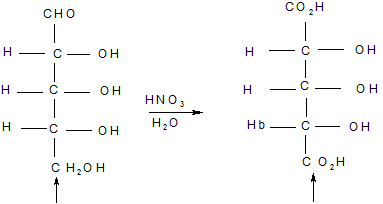
2. В результаті деградації (+) -глюкози утворюється (-) -арабіноза. Але структура (-) -арабінози не відома, встановлено, що вона окислюється до оптично активної альдарової кислоти під дією азотної кислоти. Відповідно, (-)-арабіноза не може володіти структурами, які ми в наш час приписуємо рибозі або ксилозі, так, як їх окисення дало б мезо –дикарбонову кислоту.
Це не може бути арабінозою мезо-дикарбонова кислота
Оскільки (-)-арабіноза не може володіти ні однією з двох приведених вище структур, їй потрібно приписати першу або другу з двох структур,показаних нижче,так як вони являють собою дві альдопентози,які можуть дати оптично активну альдарову кислоту:
На цій стадії Фішер знав,що (-)-арабінозі притаманна одна з цих двох структур Отже, (+)-глюкоза утворює при дегідратації (-)-арабінозу,яка повинна володіти одною з двох можливих структур.Відповідно,глюкозі потрібно приписати одну з чотирьох представлених нижче структур: 1 2
Якщо це (-)-арабіноза,тоді одне з цих з’єднань -(+)-глюкоза.
Якщо це (-)-арабіноза,то одне з цих з’єднань –(+)-глюкоза. Однак структура 3 (см. вище) дасть в результаті окиснення оптично неактивну альдорову кислоту.Продуктом окислення глюкози служить оптично активна альдорова кислота.Внаслідок,залишається зробити вибір між структурами 1,2 і 4. 3.Якщо проводити синтез по Кіліані-Фішеру,виходячи з (-)-арабінози,утворююься дві альдогексози: (*+)-глюкоза і (+)-маноза.Їх окислення під дією азотної кислоти дає оптично активні альдарові кисоти. Якщо (-)-арабінозі належить конфігурація, показана нижче,вона дасть дві альдогексози. Однак окиснення однієї з них (5) приведуть до виникненню оптично неактивної альдарової кислоти.Внаслідок, (-)-арабіноза не може мати цю структуру.Синтез за Кіліані-Фішеру:
Якщо б це була (-) – арабіноза,вона дала б ці дві альдогексози Так як ми уже показали,що (-)-арабіноза може володіти однією з двох альтернативних структур, залишається віддати перевагу структурі, приведеній нижче.
Правильна структура (-)-арабінози На увазі того,що структура (-)- арабінози уже з’ясована, (+)-глюкоза повинна мати одну із показаних нижче структур,а (+)-маноза-іншу.
Одна із цих структур відноситься до (+)-глюкози, а інша- до (+)-манозі. Так, як правильне вирішення потрібно прийняти на даній стадії.Як це нам зробити? Звертаючись до структур альдогексоз ми побачимо, що Ŀ-гулоза дає ті ж кислоти,що й (+)-глюкоза, якщо у глюкози буде структура,приведена нижче.
L-гулоза 4. Фішер синтезував L-(+)-гулозу, вона дала при окисненні ту ж альдарову кислоту, що і (+)- глюкоза. Тим самим, Фішер довів вдносну конфігурацію всіх хоральних центрів в (+)-глюкозі. Поступово він встановив структуру (+)-манози. Фішер розробив також синтез L-(+)-галози. Це з’єднання було відомо до того, як Фішер почав свої дослідження.Не дивно,тому, що за свої блискучі роботи Фішер був нагороджений в 1902 році Нобелівською премією з хімії. + Розділ 2. Дисахариди Сполуки, які складаються з двох залишків моносахаридів, сполучених між собою глікозидним зв'язком, називаються дисахаридами. Вони бувають відновлюючими і невідновлюючими залежно від: 1) природи моносахаридів, що їх складають, 2) будови циклічної форми (піранозної або фуранозної), 3) α- або ß-аномерної конформації моносахаридів, 4) природи гідроксилу, що бере участь в утворенні глікозидного зв'язку між молекулами моносахаридів. Якщо для виникнення кисневого містка в молекулі дисахариду використовується глікозидний гідроксил лише одного моносахариду, то такий дисахарид називається відновлюючим, оскільки глікозидна ОН-група другого моносахариду, що залишилася, здатна до циклоланцюгової таутомерії з одержанням альдегідної групи. Такого типу дисахариди відновлюють деякі метали з їх оксидів (тому їх назвали відновлюючими), схильні до мутаротації та існують у відповідних α - і ß-формах. До них відносяться мальтоза, целобіоза, лактоза тощо. Якщо кисневий місток між молекулами моносахаридів утворени за участю двох глікозидних ОН-груп, то дисахариди називаютьс невідновлюючими, оскі-льки вони не відновлюють оксидів металів, не здатні до мутаротації та існують тільки в циклічній формі. До них належать сахароза, трегалоза тощо. 2.1. Відновлюючі дисахариди. 2.1.1Мальтоза (солодовий цукор) – продукт неповного гідролізу крохмалю. Кристалічна мальтоза існує переважно в ß-формі, що визначається відповідним розташуванням глікозидного гідроксилу, який у структурній формулі обведено прямокутником. Умовно структуру мальтози, подібно до інших дисахаридів, можна уявити як результат взаємодії двох молекул D-глюкопіранози з різними аномерними формами:
Кисневий місток для її молекули утворюється за участю гідроксилів при 1-му і 4'-му атомах вуглецю і називається α-1,4'-глікозидним зв'язком. У водних розчинах мальтоза здатна до цикло-ланцюгової таутомерії, внаслідок чого проявляє всі властивості карбонільної групи. Так, при окисненні синтезується мальтобіонова кислота (альдобіонові кислоти), при відновленні альдегідної групи виникає спиртова група тощо:
При гідролізі мальтози одержують D-глюкопіранозу в α- і ß-формах. Мальтоза значно менш солодка, ніж сахароза. 2.1.2 Лактоза (молочний цукор) побудована із залишків ß-D-галактопіранози і α-D-глюкопіранози, існує в основному в α-формі. При її гідролізі утворюються D-галактопіраноза і D-глюкопіраноза в обох α- і ß-формах. Хімічні властивості лактози подібні до властивостей мальтози і целобіози. Вона окиснюється до лактобіонової кислоти:
Лактозу добувають з молока, у коров'ячому її міститься до 5%, у жіночому – 8%. Лактоза менш солодка, ніж сахароза. Відрізняється від інших дисахаридів відсутністю гігроскопічності (стійкістю до вологи). ЇЇ використовують для дитячого харчування, при виготовленні фармацевтичних препаратів. 2. Невідновлюючі дисахариди. 2.2.1 Целобіоза – проміжний продукт гідролізу целюлози. Для кристалічної цело-біози характерна також ß-форма. Целобіоза побудована з ß-D-глюкози і відріз-няється від мальтози наявністю ß-1,4'-глікозидного зв’язку:
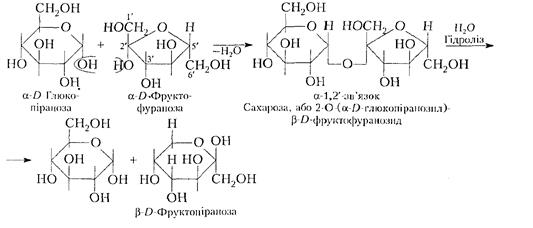
У водних розчинах при мутаротації виникає також α-форма целобіози. Для целобіози аналогічно мальтозі характерні реакції альдегідної групи (утворення при окисленні целобіонової кислоти, відновлення тощо). При гідролізі целобіоза дає D-глюкопіранозу, як і у випадку гідролізу мальтози. Целобіоза майже не солодка на відміну від сахарози і лактози. 2.2.2.Сахароза (буряковий або тростиновий цукор) –кристалічна солодка на смак речовина, яка широко ооистовується в харчовій промисловості. Молекули сахарози побувані із залишків α-D-глюкопіранози і ß- D-фруктофуранози, сполучених між собою α-1,2'-глікозидним зв'язком, в якому беруть участь обидва глікозидних гідроксили. Тому сахароза відновлюючих властивостей не проявляє:
Утворення структури сахарози як результат взаємодії двох молекул моносахаридів аналогічно іншим дисахаридам показано умовно. У дійсності препаративний синтез сахарози складніший. При гідролізі сахарози добувають суміш D-глюкози і D-фруктози в піранозній формі, яка є стійкішою. Реакцію гідролізу сахарози можна записати так:
Сахароза має правий кут обертання (+66,5°), а кінцева суміш глюкози і фруктози набуває лівого обертання (52,7° - 92° = -39,3°). Така зміна кута обертання з правого на лівий називається інверсією (віт лат. іnversia - перевертання). Суміш глюкози і фруктози після інверсії називають інвертованим цукром, або штучним медом. 2.2.3.Трегалоза місить залишки α-D-глюкози, сполучених між собою α-1,1'-глікозидним зв'язком також за участю обох глікозидних гідроксилів:
Трегалоза - це типово невідновлюючий дисахарид і при гідролізі дає D-глюкопіранозу. Більшість дисахаридів входить до складу полісахаридів. З перелічених дисахаридів лише сахароза, лактоза і трегалоза існують природі у вільному стані. Крім дисахаридів відомі також трисахариди, наприклад рафіноза (невідновлююча) і генціаноза, побудовані із залишків трьох моносахаридів. Наприклад, рафіноза, що міститься у цукрових буряках, складається з D-глюкози, D-фруктози і D-галактози. У природі існують і складніші олігосахариди, побудовані з чотирьох моносахаридів (тетрасахарид стахіоза) тощо. Розділ 3. Полісахариди Полісахариди - високомолекулярні нецукроподібні природні вуглеводи. Вони являють собою продукти конденсації великої кількості моносахаридів аналогічно дисахаридам. Залишки моносахаридів сполучені глікозидними зв'язками, утвореними завдяки глікозидному гідроксилу одного моносахариду і здебільшого четвертому гідроксилу іншоп моносахариду в α- або ß-формі. Основні представники полісахаридів – крохмаль, целюлоза (клітковина) і глікоген. Всі вони побудовані з ланок D-глюкози і відповідають загальній формулі (С6Н10О5)n, причому майже не проявляють властивостей відновника. Крохмаль - резервний полісахарид рослин, який нагромаджується в насінні, бульбах картоплі, коренях, листках тощо. Крохмаль у воді набухає й утворює колоїдний розчин. Він складається в основному з двох полісахаридних компонентів: амілози (20-30%) і амілопектину (70-80%). Амілоза побудована з молекул α- D-глюкози, сполучених аналогічно мальтозі α-1,4'-глікозидними зв'язками, характеризується практично лінійною будовою макромолекул, які здатні закручуватисьу спіралеподібні структури:
де n=300÷1000. Амілопектин – високомолекулярний полісахарид з розгалуженою структурою, який складається із залишків α- D-глюкози, з'єднаних α-1,4'-глікозидними зв'язками. Розгалуження виникає внаслідок сполучення деяких молекул α- D-глюкози за шостим атомом вуглецю (α-1,6'-глікозидні зв'язки):
Ступінь поліконденсації (п) для амілопектину досягає приблизно 600-5000. Крохмаль вважається основним джерелом вуглеводів і широко
Целюлоза (клітковина) – природний полісахарид, побудований із залишків ß-D-глюкози за участю ß-1,4'-глікозидних зв'язків аналогічно целобіозі. Прикладом майже чистої целюлози є бавовна (очищена вата) і фільтрувальний папір. Завдяки ß-1,4'-зв'язкам макромолекули целюлози мають лінійну будову:
де п = 500÷2000. Між макромолекулами виникають численні водневі зв'язки, і вони, на відміну від крохмалю, не характеризуються спіралеподібною структурою, а утворюють довгі жорсткі волокна. Це надає певної міцності та еластичності оболонкам рослин (волокнам), для яких целюлоза є основним будівельним матеріалом. Завдяки численним водневим зв'язкам целюлоза у воді не розчиняється, але розчиняється в аміачному розчині Сu(ОН)2 (реактив Швейцера), в концентрованому розчині ZnСl2, в концентрованій Н2SO4. Гідроліз целюлози проходить важче, ніж для крохмалю, з утворенням ряду продуктів: (С6Н10О5) n Целюлоза Амілоїд(m<n) Целобіоза D-Глюкоза Унаслідок відсутності в організмі людини ферментів, здатних рощеплювати ß-1,4'-зв'язки целюлози при шлунковому гідролізі, вона не може бути використана як харчовий продукт, на відміну від крохмалю з α-1,4'-зв'язками, для якого такі ферменти існують. Целюлоза широко застосовується для виготовлення штучних волокон, лаків, пластмас, вибухівки, етилового спирту тощо. Целюлоза містить у кожній ланці три гідроксильні групи, її формула [С6Н7О2(ОН)3]n. Дія лугів (мерсеризація целюлози). Целюлоза розчиняє в концентрованому розчині лугу з утворенням лужної целюлози, або алкоголяту целюлози: [С6Н7О2(ОН)3] n + nNаОН → [С6Н7О2(ОН)2ОNа] n + nН2О При дії сірковуглецю на алкоголят целюлози отримують натрієву сіль естеру ксантогенової кислоти – ксантогенат целюлози: S δ- δ+ δ- δ+ || [С6Н702(ОН)2ОNа] n + nС=S → [С6Н7О2(ОН)2 –O–C–S–Na]n || S Ксантогенат целюлози Лужний розчин ксантогенату целюлози називається віскозою і при його продавлюванні крізь фільєри (дрібні отвори) у водний розчин Н2SО4 целюлоза регенерується (гідроліз ксантогенату) вже у вигляді ниток штучного віскозного волокна (віскозний шовк): [С6Н7О2(ОН)2 –O–CS–SNa]n + nН2SO→ [С6Н7О2(ОН)3] n + nCS2 + nNaHSO4 Віскозне волокно Якщо продавлювати крізь тонкі щілини в розчин сульфатної кислоти суміш целюлози з гліцерином, можна добувати тонкий прозорий матеріал – целофан. Нітрування целюлози. Целюлоза легко нітрується нітратною кислотою в присутності сульфатної. Залежно від кількості нітратної кислоти одержують відповідні моно-, ди- або тринітрати целюлози:
У промисловості, як правило, утворюються не індивідуальні нітропохідні целюлози з точно заданою кількістю нітрогруп, а складна суміш з перевагою однієї з них залежно від умов реакції. Суміш моно- і динітроцелюлози називається колоксиліном і застосовується як нітролак, колодій. Із суміші колоксиліну з камфорою виготовляють целулоїд. Максимально нітрована целюлоза (тринітрат) називається піроксиліном і використовується для добування бездимного пороху. Ацилювання целюлози. При дії на целюлозу оцтового ангідриду як ацилюючого агента утворюються відповідні естери: моно-, ди- або триацетат целюлози:
[С6Н7О2(ОН)3]n+n3(СН3СО)2O Триацетат целюлози Суміш моно- і діацетату целюлози використовують для виробництва лаків, кіно- і фотоплівки. З ди- і триацетату виготовляють ацетатний шовк (ацетатне волокно). Алкілювання целюлози. При алкілуванні целюлози метилхлоридом або диметилсульфатом утворюються етери різного складу:
[С6Н702(ОН)3]n+Зn(СН3O)2SO2 Триметилцелюлоза Найпоширеніші з продуктів алкільованої целюлози – метил-, етил- і бензилцелюлоза, що застосовуються як основа лаків, плівко утворювачів, загущувачів тощо. Розділ 4.Аміноцукри Довгий час хіміки,вивчаючі вуглеводи, вважали, що аміноцукри можуть представляти тільки чисто теоретичний інтерес. Зараз, ми знаєм, що аміноцукри мають важливе значення для багатьох тварин, в тому числі савців та членистоногих. Хітин. Ракоподібні мають міцний, твердий зовнішній скелет, скліючий в основному з хітину- полімеру 2-ацетамідо-2-дезокси-D-глюкози. По мірі росту ракоподібні періодично скидають його в час ліньки, так, як на відміну від тканин,зростаючих в результаті ділення клітин, жорсткий полімер зберігає постійні розміри. Хітин не тільки виконує опорні функції, але й роль шкірки, регулюючої надходження або втрату води. Цікаво, що хітин ракоподібних відрізняється від хітина комах. В першому випадку цей полімер покритий карбонатом кальцію і іншими солями, по-друге – сумішшю речовин під загальною назвою «Віск комах». І тут і там відбувається заповненн пор в полімерній матриці – свого роду біологічне шліхтування.
Прекрасним джерелом 2-аміно-2-дезокси-D-глюкози слугує панцир крабів, даючий цей аміноцукор з виходом близько 70% при гідролізі в концентровані хлоридній кислоті. Як видно з малюнка, приведеного вище, хітин дуже подібний до целюлози. Хондроїтин. З’єднані тканини складаютьсяз волокон колагену, занурений в білково-полісахаридний комплекс – білок, ковалентно зв’заний з вуглеводом. Найбільш пошиеним є полімер, відомимй під назвою хондроітина. На відміну від глікогену вуглеводневий ланцюг хондроїтина не розгалужена, а мономери з’єднаі в нім β-глікозидними зв’язками.Ходрїтин сильно відрізяється від інших полісахаридів тим, що представляє собою гетерополімер, побудований з чергуючих залишків D-глюкоринової кислоти і N-ацетил- D- галактозаміна, несучих сульфатну групу. Так називаючий «Хондроїтин А» містить цю групу при томі С4 аміноцукру;в даний час, для нього прийнято назву хондроїтин-4-сульфат. Аналогічно «Хондроїтин С»- це хондроїтин-6-сульфат.
Полімер хондроїтин, А(R=SO3H, R’=H), хондроїтин C(R=H, R’=SO3H) Ксантанова камедь (камедь кукурудзяного цукру), (C35H49O29)n, мол. м. 2 000 000–50 000 000 – являє собою суміш полісахаридів, які утворюються як вторинні метаболіти при аеробній ензимації цукру бактеріями Xanthomonas campestris. Макромолекула такого гетерополісахариду складається з трьох моноз: β-D-глюкози, α-D-манози і α-D-глюкуронової кислоти при співвідношенні 2:2:1 відповідно. При цьому основний ланцюг ксантанової смоли утворює β-D-глюкоза, сполучена 1,4-глікозидними зв’язками, формула якої зображена на першій схемі [7].
(1)
Ксантанова смола. Ксантанова камедь (КСА). Ксантанова смола, камедь (КСА) має слідуючі аналітичні характеристики: рН(1%водний розчин) = 6,0–8,0; tзам. (1%водний розчин = 0 ˚С; теплота згоряння рівна 14,6 Дж/г; tпл. = 270˚С; nD20(1% водний розчин) = 1,333; в’язкість (динамічна 1% водного розчину при 25 ˚С) рівна 1200–1600 МПа∙с; розмір часток світло-жовтого порошку (КСА) ≤ 180 мкм (залежить від марки камеді); вологість ≤ 15%; практично не розчиняється в етанолі та етері, розчиняється в холодній та гарячій воді. Властивості (КСА) регулюють, змінюючи умови життя бактерій ксантану [8]. Карбоксиметилцелюлоза (целюлозогліколева кислота, простий ефір целюлози та гліколевої кислоти, тилоза, валоцел, едіфас), [С6Н7О2(ОН)3х(ОСН2СООН)x]n, де х = 0,08-1,5 мол. м. 90 000 –700 000 – аморфна безколірна речовина, слабка кислота (К = 5,25*10-7 - 5,0*10-5 [7].
(2)
Натрієва сіль полікарбоксиметилового етеру целюлози (КМЦ) Розділ 5. Хімія вина Основним завданням хімії вина — науки про хімічний склад винограду і його перетворення в процесі перероблення на вино — є наукове обґрунтування технологічних процесів, організація і здійснення контролю за їх протіканням, створення нових технологій. Хімія вина вивчає за допомогою сучасних методів дослідження суть процесів, які складають основу виготовлення вин, що дозволяє найправильніше робити вибір оптимальних режимів і створювати нові прогресивні технологічні схеми. Важливим аспектом у розв’язанні цього завдання є організація чіткого контролю за ходом технологічних процесів, якістю сировини та готового продукту. Такий контроль може бути найбільш ефективним під час виконання найсучасніших методів аналізу. Безперервне вдосконалення існуючих методів аналізу, їх уніфікація, створення нових аналітичних методів є основою вирішення технологічних завдань. Ось чому Міжнародна організація виноградарства і виноробства (MOB) багато уваги приділяє розробленню єдиних методів аналізу. Їх повсюдне застосування дозволить отримувати надійні результати аналітичних досліджень. Разом з розвитком методів хімічних і біологічних досліджень постійно удосконалюються і методи аналізу вин. Широке розповсюдження у виноробстві під час наукових дослідженнях знайшли хроматографічні методи аналізу (паперова, тонкошарова, газорідинна хроматографія), електрофорез, гельфільтрування, спектрофотометрія, полярографія, у ряді досліджень застосовуються ядерно-магнітний резонанс, радіоактивні ізотопи. Все це привело до того, що значно розширилися наші уявлення про хімічний склад винограду і вина. В даний час в цих продуктах виявлено і ідентифіковано більше 500 хімічних сполук, що відносяться до різних класів.
|
||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 1316; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.129.241 (0.014 с.) |


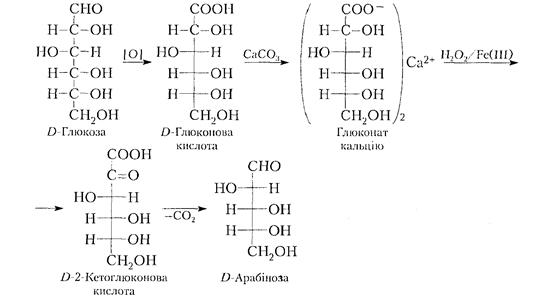


 Перетворення такого типу відбуваються і для D-фруктози або D-манози. Доказом наведених процесів є те, що всі три згадані сахариди однаково реагують з фенілгідразином і відрізняють між собою лише конфігурацією біля другого атома вуглецю (С2).
Перетворення такого типу відбуваються і для D-фруктози або D-манози. Доказом наведених процесів є те, що всі три згадані сахариди однаково реагують з фенілгідразином і відрізняють між собою лише конфігурацією біля другого атома вуглецю (С2).






















 Глікоген (тваринний крохмаль) побудований з D-глюкози. Він служить резервним полісахаридом, і енергія, яка виділяється при його розщепленні, використовується для проходження життєдіяльних процесів (робота м'язів, печінки тощо). За структурою він нагадує амілопектин, тільки має розгалуженіші макромолекули.
Глікоген (тваринний крохмаль) побудований з D-глюкози. Він служить резервним полісахаридом, і енергія, яка виділяється при його розщепленні, використовується для проходження життєдіяльних процесів (робота м'язів, печінки тощо). За структурою він нагадує амілопектин, тільки має розгалуженіші макромолекули.
 (С6Н10О5)m
(С6Н10О5)m  n/2 С12Н22О11
n/2 С12Н22О11 
 [С6Н7О2(OСOСН3)3]n+ЗnСН3СООН
[С6Н7О2(OСOСН3)3]n+ЗnСН3СООН [С6Н7O2(ОСН3)3]n+ЗnСН3OSO2ОН
[С6Н7O2(ОСН3)3]n+ЗnСН3OSO2ОН
 Хітин
Хітин



 Натрію карбоксиметилцелюлоза розчинна (синоніми: натрію-КМЦ, натрієва сіль полікарбоксиметилового етеру целюлози; Nа-КМЦ, Carmellosum natricum, Carmellose, Carboxymethycellulose sodium, Cellulose, Carboxymethyl ether, Acucell, Aguacorb; cellulose gum, CMC sodium, E466), - білий, без запаху, гранульований порошок, має такі характерні ознаки: щільність — 0,52 г/см3, насипна щільність (сипучість) — 780 г/л, константа дисоціації у воді рКа = 4,30; рН(1%водний розчин) = 5,0–6,0 Tпл = при~ 227 °С (темніє), при~ 252 °С (обвуглюється); гігроскопічна (містить до 10% води), може поглинати значну кількість води при температурі до 37 °С і відносній вологості приблизно 80%; практично не розчиняється в ацетоні, спирті (95%), етері, толуолі; легко розчиняється у воді при будь-якій температурі, утворюючи колоїдний розчин, [ 9,10], формула якої зображена на другій схемі:
Натрію карбоксиметилцелюлоза розчинна (синоніми: натрію-КМЦ, натрієва сіль полікарбоксиметилового етеру целюлози; Nа-КМЦ, Carmellosum natricum, Carmellose, Carboxymethycellulose sodium, Cellulose, Carboxymethyl ether, Acucell, Aguacorb; cellulose gum, CMC sodium, E466), - білий, без запаху, гранульований порошок, має такі характерні ознаки: щільність — 0,52 г/см3, насипна щільність (сипучість) — 780 г/л, константа дисоціації у воді рКа = 4,30; рН(1%водний розчин) = 5,0–6,0 Tпл = при~ 227 °С (темніє), при~ 252 °С (обвуглюється); гігроскопічна (містить до 10% води), може поглинати значну кількість води при температурі до 37 °С і відносній вологості приблизно 80%; практично не розчиняється в ацетоні, спирті (95%), етері, толуолі; легко розчиняється у воді при будь-якій температурі, утворюючи колоїдний розчин, [ 9,10], формула якої зображена на другій схемі:


