Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окиснення до глікарових кислот.Содержание книги
Поиск на нашем сайте
В простих цурках міститься більше число функціональних груп, які можуть бути окислені різними агентами. Азотна кислота окислює альдозу і кетозу до дикарбонових кислот- глікарових (або цукрових) кислот.
Так, із D-глюкози утворюється при цьому D-глюкарова кислота.
D-глюкоза D-глюкарова кислота В результаті подібної реакції відбувається окислення первинних гідроксильних груп і альдегідних груп моносахариди. Окислення до гліконових кислот. Якщо взяти більш м’ягкий, ніж азотна кислота, окисняючий агент, окиснення функціональних груп буде більш вибірковим. Бромна вода(Br2/H2О), наприклад, окиснює тільки альдегідні групи альдозу до карбоксильних груп. Монокарбонові кислоти називаються гліконовими або альдоновими.Часто реакцію проводять в присутності невеликої кількості основ.
Утворення гліконової кислоти Під дією бромної води, D-глюкоза окислюється до D-глюконової кислоти, вихід який може перевищувати 75%.
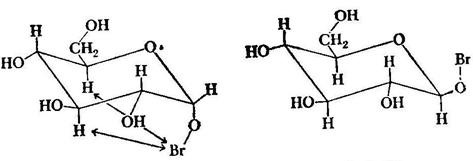
Насправді, при окисленні утворюється не сама гліконова кислота, а відповідний їй лактон. Відповідно, окисненню підлаштовуються не карбонільні, а півацетальні з’єднання. Роль основ зводиться до утворення алкоксид-аніона, атакуючого бром. Потім відбувається відщеплення бромистого водню по механізму Е2. Нижче наведений приклад подібних реакцій.
D-глюконолактон α-D-Глюкопіраноза окислюється повільніше β-аномера, через несприятливі аксіальних взаємодій в тому конформері α-аномера,який необхідний для протікання транс-ламінування, В конформері β-аномера, який потрібний для того, щоб ішла ця реакція, подібні взаємодії не відбуваються.Відповідно, β-аномер потребує меншої енергії активації для транс-ламінування,ніж α-аномер.
Конформер α-аномера конформер β-аномеру, в Е2-реакції в Е2-реакції Реактиви Бенедикта, Феленга (феленгова рідина) і Толленса окислюють альдоза до гліконових кислот. Кожен з цих реактивів містить кетон металу, який відновлюється альдозами (звідки і назва цих цукрів – відновлюючи цукри), Реактив Толленса готують, змішуючи розчини їдкого натрія і нітрата срібла, в результаті чого випадає осад оксиду срібла. 2Ag + 2ОН→ Аg2О+ Н2О При обережному добавленні водного розчину амоніаку осад розчиняється і утворюється іон Аg(NН3)2 (в осад не випадають). Цей розчин являється реактивом Толленса. Добавлення альдози до реактиву Толленса осаджує металічне срібло, нерідко у вигляді дзеркального покриття на стінках пробірки (звідки і назва-реакція «срібного дзеркала»). В якості прикладу показано окиснення D-глюкози до D-глюконової кислоти. Ag(NH3)2 + D-глюкоза → D-глюконова кислота + Ag↓ Фруктоза теж дає позитивну реакцію з реактивом Толленса, хоча в ній немає альдегідної групи.Справа в тім, що між глюкозою, манозою і фруктозою існує рівновага, яке каталізується основами. Ця рівновага включає ендиол
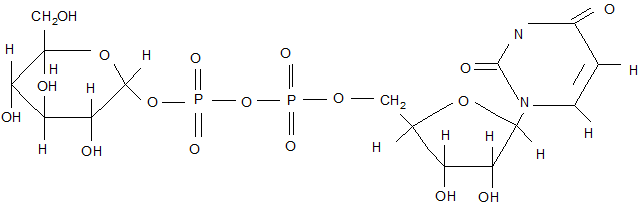
D-фруктоза проміжний ендиол D-глюкоза і D-маноза Таким чином, з реактивом Толленса реагує не фруктоза, а утворена з неї, під дією лугу, маноза та глюкоза. Окислення до глікоронових кислот. Глікуронові (уронові) кислоти-це з’єднання, в яких кінцева первинна гідроксильна група моносахарида окислена до карбоксильної, в той час як карбонільна група не зазнала змін. Їх досить тяжко синтезувати в лабораторії, хоча вони поширені в природніх умовах, особливо D-глюкоронова кислота, яка утворюється від vіvо при ферментативному окисленні складної молекули уридиндифосфат-α-Dглюкози (УДФ-глюкози).Важлива біологічна роль D-глюкоронової кислоти полягає в тому, що багато токсичних речовин виділяється з мочою у вигляді –глюкоронідів.
D-глюкоза урідин
УДФ
α-D-глюкуронова кислота (написана у вигляді півацеталя) Окиснена дегідратація цукрів. Окиснення діолів перйодат-іоном ІО4, ця реакція часто використовується при аналізі вуглеводнів, приведена нижче.
При окисленні глюкози метаперйодатом натрію, наприклад утворюється 5 молів мурашиної кислоти і 1 моль формальдегіду. Який,з вуглеводних атомів глюкози переходить в формальдегід.
|
||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 839; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.46.174 (0.008 с.) |






 в якості проміжного продукту, і відомого під назвою перегрупування Лобрі де Брюйна – ван Екенштейна.
в якості проміжного продукту, і відомого під назвою перегрупування Лобрі де Брюйна – ван Екенштейна.