
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Циклічна структура моносахаридівСодержание книги
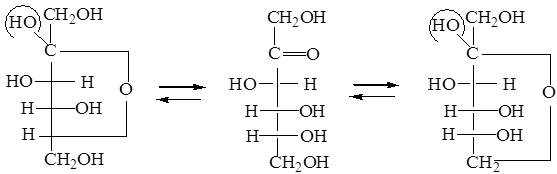
Поиск на нашем сайте Напівацеталь глюкози утворюється внутрішньомолекулярним способом при взаємодії карбонільної групи з гідроксилом біля δ-вуглецевого атома, а фруктози - при взаємодії карбонілу з гідроксилом біля γ- або δ-вуглецевих атомів за схемою:
D-Глюкоза D-Глюкопіраноза
D-Фруктофураноза D-Фруктоза D-Фруктопіраноза При цьому виникає новий хіральний центр, або аномерний атом вуглецю. Напівацетальний гідроксил відрізняється за хімічними властивостями від чотирьох інших гідроксилів. Його називають глікозидним гідроксилом (у формулі він обведений колом). Таутомерія циклічної та відкритої форм називається цикло-ланцюговою таутомерією. Напівацеталі існують у шестичленній піранозній формі (δ-формі), назва якої походить від циклу пірану, і п'ятичленній фуранозній (γ-формі) - від циклу фурану:
γ-Піран Фуран Напівацетальна форма характерна для кристалічного стану гексоз. В ІЧ-спектрах кристалічної глюкози відсутні смуги поглинання У водних розчинах утворюється рівноважна суміш циклічної і відкритої форм, оскільки таутомерія проходить лише у водних розчинах, тобто моносахариди вступають в реакції як у циклічній, так і у відкритій формі. При цьому згідно з принципом Ле-Шательє, якщо тільки відкрита форма починає реагувати з яким-небудь реагентом, таутомерна рівновага зсувається в бік відновлення концентрації сполук відкритої форми. Загалом циклічна будова моносахаридів являє собою α- або ß-форми, які називаються аномерами (від грецьк. апо — зверху). Аномери — діастереоізомери, що розрізняються між собою лише конфігурацією при аномерному, або напівацетальному, атомі вуглецю. Аномери мають різні температури топлення, різні кути обертання площини поляризованого світла і є діастереоізомерами між собою, але не енантіомерами. Для α-форми характерне розташування глікозидного гідроксилу з того самого боку, що і гідроксил, який визначає конфігурацію моносахариду в цілому (D- або L-) і бере участь в утворенні циклу. ß-форма існує при розміщенні даних гідроксилів по різні боки циклу. Рентгеноструктурний аналіз підтвердив, що група ОН при аномерному атомі вуглецю С1 розташована з правого боку для α- D-ряду і з лівого - для ß-D-ряду:
α-D-Глюкопіраноза D-Глюкоза ß-D-Глюкопіраноза + ст. 425-429 Мутаротація Відомо, що свіжоприготовлений розчин α-D-глюкози обертає площину поляризованого світла вправо на кут 112º, а розчин ß-D-глюкози також вправо, але на 19º. При розчиненні однієї з цих форм у воді завжди відбувається часткова ізомеризація одного аномеру в інший через стадію відкритої форми до встановлення рівноваги між ними з кінцевим кутом обертання 52,7°. Така зміна значення кута обертання моносахаридів у часі називається мутаротацією (від лат. mutare – змінювати, rotatio - обертання), або аномеризацією. Встановлено, що у водному розчині глюкози при 25°С міститься36% α-D-глюкопіранози і 64% ß- D-глюкопіранози. Тільки приблизно 0,02% D-глюкози у таких розчинах існує у відкритій формі, але, яквже було зазначено, цього вистачає для перебігу хімічної реакції за карбонільною групою. Таким чином, глюкоза існує в основному в піранозній формі. Фуранозна форма для глюкози вважається нестійкою переважно внаслідок Відмінність конфігурації іншого, часто другого зверху, хірального вуглецевого атома викликає утворення епімерів. Епімери – діастереоізомери з декількома хіральними атомами, що відрізняються конфігурацією лише при одному (епімерному) атомі. Наприклад, D-глюкоза і D-маноза, D-алоза і D-альтроза, D-галактоза і D-талоза тощо є між собою епімерами:
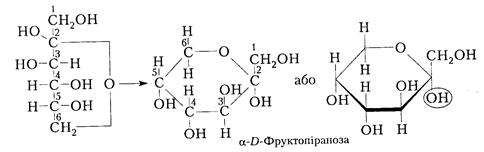
Глюкоза Маноза Будову моносахаридів у циклічній формі зручно зображати перспективними формулами У. Хеуорса (1929 р.). При цьому атоми, розміщені у формулі Коллі -Толленса зліва, розташовуються зверху, а розміщені справа – внизу площини кільця. Біля п'ятого вуглецевого атома водень розташований внизу, оскільки для утворення кисневого містка С5-О необхідний поворот частини молекули навколо валентної осі С4-С5 для замикання циклу:
Аналогічно для ß-D-глюкопіранози отримаємо:
ß-D -Глюкопіраноза Насправді глюкoза і фруктоза, як і всі шестичленні цикли, не мають плоскої будови, а існують у вигляді просторових конформерів у формі ванни (шість конформерів) або в енергетично вигіднішій формі крісла (два конформери):
При цьому конформер І у формі крісла переважає, оскільки містить всі великі об’ємні замісники ОН і СН2ОН в екваторіальному положенні, а в конформері II вони знаходиться в аксіальному (паралельному) положенні. Внаслідок такої максимальної термодинамічної стійкості конформеру І ß-D-глюкоза та целюлоза на її основі значно поширені в природі. Для зручності будемо застосовувати формули Хеуорса, пам'ятаючи, що реально молекули моносахаридів існують у тій чи іншій конформаційній будові. Відповідно для фруктози, як це було показано на прикладі глюкози, можна навести піранозну і фуранозну формули Хеуорса:
Аналогічно для ß-D-фруктопіранози отримуємо:
ß-D-фруктопіраноза
α-D-фруктофураноза Аналогічно для ß-D -фруктофуранози отримуємо:
ß-D –фруктофураноза Таким чином, для вуглеводів характерні всі основні види ізомерії: структурна, стерична і конформаційна. Альдогексози у відкритій формі містять чотири хіральних атоми вуглецю, і, отже, загальна кількість стереоізомерів для них становить 2n = 24 = 16. Ці 16 ізомерів утворюють вісім пар енантіомерів: вісім D-ряду і вісім L-ряду (див. генетичний ряд альдоз). Усі 16 енантіомерів відомі, причому більшість L-ізомерів отримано синтетичним шляхом. При напівацетальній формі для альдогексоз кількість хіральних центрів збільшується до п'яти і альдогексозам відповідають вже 25 = 32 стереоізомери, тобто кожний з них існує в α- або ß-формі:
D-Глюкоза L-Глюкоза (природна) (синтетична)
Для кетогексоз, що містять три хіральні атоми вуглецю у відкритій формі, кількість стереоізомерів досягає 23=8, які утворюють чотири пари енантіомерів: чотири D-ряду і чотири L-ряду:
D-фруктоза (природна) L-фруктоза (синтетична)
α-D –Фруктофураноза α-L–Фруктофураноза Глікозиди Реакції простих півацеталів або півкеталів з спиртами утварюють відповідно ацеталі або кеталі.Альдози та кетози також дають ацеталі і кеталі.
Півацеталь ацеталь В хімії вуглеводів подібні речовини називають глікозидами.
Циклічні глікозиди, існуючі у вигляді шестичленних кілець,мають назву піранозиди. Циклічні глікозиди, кільце яких містить п’ять атомів,називаються фуранозидами.
Піранозид в загальному вигляді; фуранозид в загальному вигляді; В природі широко розповсюдені глікозиди глюкози – глюкозиди. Нижче дані різні способи зображення одного і того ж α-D-глюкопіранозида.
Різні способи зоброження одного і того ж метил α-D-глюкопіранозида.
При синтезі глікозидів з допомогою реакції моносахаридів з спиртами в присутності кислоти одержують звичайно ацеталі і кеталі.Так названий аглікон (що означає «які не містять цукор») приєднюється до С1 цукор через атом оксигену, тому більш точно називати утворений продукт О- глікозидом.Реакції утворення глікозидів проводять, як правило, в дуже м’ягких умовах,так що спирт не може перетворитись в ефір,і в реакцію вступає тільки гідрокильна група при С1.
D-глюкоза метил-α-D-глюкопіранозид (утворюється також β-аномер)
Глікозидний зв’язок зустрічається в усіх природніх вуглеводах,і тому методи її розщеплення має велику роль при аналізі вуглеводів.Як і інші ацеталі або кеталі,глікозиди стійкі в слаболужних розчинах,але легко гідролізуються кислотами.Механізм такого гідролізу зображений нижче:
Глікозид в загальному вигляді;
Не дивлячись на швидкість каталізуючого кислотами гідроліза,перевагу слід віддати ферментативному гідролізу. Річ в тім,що ферменти не тільки швидко розщіплюють глікозидні зв’язки,але і володіють високою селективністю.Так,наприклад, α-D-глюкозидаза із дріжджів діє тільки на глікозидні зв’язки при С1 α-аномера глюкози.Напроти, β-D- глюкозидаза,яка міститься в емульсині мендаля,специфічна по відношенню до β-глюкозидним зв’язкам. Півацеталі легко розщепляються, даючи карбонільні зв’язки і спирт.
А ацеталі,навпаки досить стійкі і не піддаються спонтанному гідролізу.
Глікозиди – це ацеталі.Тому вони не здатні спонтанно перетворюватись в відповідний моносахарид.
моносахарид Для того,щоб між аномерними глікозидами спонтанно встановилась рівновага,вони повинні бути здатні утворювати вільний моносахарид, так як саме він є проміжним з’єднанням при взаємоперетворенні α- і β-глюкозидів.В іншому випадку спонтанне взаємоперетворення аномерних глікозидів виключено.Виходячи з цього,фуранозиди і піранозиди не проявляють мутаротації.
Найбільш цікаві аглікони. Багато природніх продуктів містять цукри, які з’єднані глікозидними зв’язками з цікавими агліконами.До простих глікозидів, преставляючі інтерес з медичної точки зору, відносяться сердечні глікозиди, які містять стероїдний аглікон і використовуються для стимуляції сердечної діяльності.Із отруйної рослини наперстянки (Digitalis purperia)можна екстрагувати суміш, відому під назвою дегіталіса. Ця суміш багата глікозидами, головним агліконом яких є дигетоксигенин - поліциклічний спирт, який використовується при сердечних захворювань.
Крім О-глікозидів, існують і інші типи глікозидів, в яких аглікон приєднний до цукру не через атом оксигену, а через який-небудь інший атом. Наприклад, в N-глікозидах аглікон з’єднаний з С1 через атом азоту.
N-глікозиди в узагальненоному виді До найважливих N-глікозидам відносяться нуклеозиди,які складаються із рибози або дезоксирибози і гетероциклічного аміна. Нижче приведена формула аденозина-нуклеозида,збудованого з аденіна і рибози.
Аденін нуклеозид, збудований з рибози і аденіну Одержання моносахаридів Моносахариди можна отримувати за допомогою синтетичних методів, але в цьому немає потреби, оскільки вигідніше їх добуват з природних продуктів. Нижче наведено основні промислові та синтетичні методи одержання моносахаридів. 1. Альдольна конденсація. Першим синтезував цукристі речовини
Пізніше Е. Фішер виділив з такої суміші рацемат D- і L-фруктози. Альдольна конденсація гліцеринового альдегіду і дигідроксиацетону також веде до утворення кетогексоз:
2. Гідроліз дисахаридів і полісахаридів. Цей метод основний для С12Н22O11 + H2O дисахарид (сахароза) моносахарид (С6Н10O5)n + nH2O полісахарид моносахарид 3.Неповне окиснення шестиатомних спиртів. Зазвичайних умов при окисненні багатоатомних спиртів утворюється, як
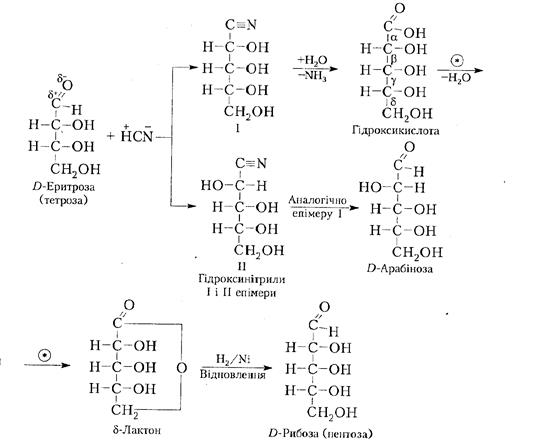
4. Гідроксинітрильний синтез Г. Кіліані - Е. Фішера. Даним методом можна збільшувати довжину вуглецевого ланцюга моносахариду. Таким шляхом були отримані гептози, октози і навіть декози C10H20O10,тобто з нижчих моносахаридів утворили вищі:
Гідроксинітрильний синтез відбувається завдяки здатності карбонільної групи моносахариду взаємодіяти з ціанідною кислотою з утворенням суміші епімерів (гідроксинітрилів І і II), що відрізняються конфігурацією верхнього хірального атома вуглецю С1. Такий гідроксинітрил гідролізують до відповідної гідроксикислоти, яка при нагріванні легко дегідратується з утворенням переважно стійкішого шестичленного δ-лактону порівняно з п'ятичленним γ-лактоном. Отриманий δ-лактон легше, ніж гідроксикислоту, відновити в альдопентозу дією амальгами натрію або каталітичного водню. На схемі наведені перетворення лише для епімеру І, оскільки для епімеру II вони аналогічні. 1.2.1Синтез і розклад моносахаридів; Синтез по методу Кіліані- Фішера. Цей метод застосовується для збільшення довжини вуглеводного ланцюга альдози на один атом вуглевода,в результаті чого утворюються дві діастометричні альдоза.
Вже на першій стадії синтезу утворюється ізомерні ціангідриди, після гідролізу і дегідротації яких утворюються лактони, які відновлюються до альдоз, які містять на один атом вуглевода більше, ніж вихідний моносахарид. Утворення D-глюкози і D-манози із альдопептози показано вище. Суміш дистереомерних продуктів можна розділити на різні стадії синтезу, але краще зробити перед останнім відновленням, так як розділення двох утворених цукрів буває спряжено з деякими труднощами. Ці ж реакції можна проводити в зворотньому порядку, якщо потребується скоротити вуглеводневий ланцюг моносахариду на один атом. Ця ретрореакція Кіліані- Фішера починається з перетворення альдози в оксим, при допомозі реакції з гідроксиламіном. Під дією оцтового ангідриду відбувається дегідратація оксиму до нітрилу.Ця реакція супроводжується ацетилюванням вільних гідроксильних груп вільних цукрів. Переетерифікація ацетильованого продукту дає ціангідрин моносахариду, який в результаті відщеплення ціанистого водню, перетворюється в альдозу, яка містить на один атом вуглеводу менше, ніж вихідний цукор.
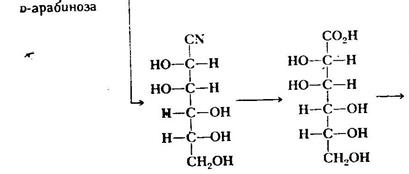
Синтез D-глюкози і D-манози за Кіліані- Фішером Перетворення D-глюкози в D-арабінозу при допомозі ретрореакції Килліані- Фішера. В даному випадку получають тільки один кінцевий продукт, так як нові хіральні центри в реакціях не утворюються. Якщо для синтезу по Кіліані – Фішеру,беруть ціаністий водень в надлишку, щоб забезпечити високий вихід ціангідрина, для успішного протікання зворотньої послідовності реакції (так названої дигідратації по Волю) потрібно неперервно видаляти утворений ціаністий водень. Деградація по Руффу. Деградація альдоз по Руффу представляє собою вільнорадикальне декарбоксилювання солі гліконової кислоти, в результаті якого вуглецевий ланцюг альдози скорочується на один атом. Декарбоксилювання проводять сумішшю пероксиду водню і трьохвалентного заліза (так званий реактив Фентона). На жаль, вихід продукту складає всього біля 30-40%. Дегідратаціяглюкози по Руффу показана нижче.
Перетворення D-глюкози в D-арабінозу за допомогою деградації за Хімічні властивості 1.3.1.Реакції моносахаридів; Унаслідок особливості будови моносахариди проявляють властивості спиртів, карбонільних сполук і напівапеталів. Розглянемо спочатку їх реакції для відкритої (карбонільної) форми. 1. Відновлення. При відновленні моносахаридів утворюються відповідні багатоатомні спирти, реакція зворотна до неповного окислення. Під дією сильних відновників на зразок НІ відбувається їх повне відновлення. Наприклад, з глюкози отримують 2-йодогексан: СН2ОН-(СНОН)4-СН=О 2. Окиснення. Моносахариди легко окиснюються і залежно від характеру окисника дають різні продукти. Так, м'які окисники (НNO3, розведена або бромна вода) в кислих і нейтральних середовищах окис-нюють тільки альдегідну групу з утворенням так званих альдонових кислот. При застосуванні сильнішого окисника моносахариди або альдо-нові кислоти окиснюються в альдарові (двоосновні). Так, з глюконової кислоти при окисненні первинної спиртової групи одержують сахарну кислоту. При окисненні добуваються переважно не самі кислоти, а іх лактони. Уронові кислоти отримують шляхом окиснення похідних моносахаридів з попередньо захищеною альдегідною групою. Застосуванні захисту альдегідної групи пояснюється необхідністю її збереження від окиснення. Для цього спочатку утворюють глікозид Інший метод полягає у відновленні амальгамою натрію моно лактонів сахарних кислот, що легко утворюються при реакції:
З таких γ-монолактонів сахарної кислоти першою буде відновлюватися та карбоксильна група, яка легше утворює лактон. Фруктоза (кетогексоза) окиснюється важче, ніж глюкоза (альдо-гексоза), і часто з розщепленням вуглецевого ланцюга:
У лужному середовищі моносахариди окиснюються з розщепленням вуглецевого ланцюга і з утворенням продуктів окиснення, які хактеризуються сильними відновними властивостями. На цьому засноване застосування для якісного визначення вуглеводів реакції срібного дзеркала – так звана проба Толленса, що полягає в окисненні альдегідної групи під дією аміачного розчину оксиду срібла (реактиву Толленса): D-глюкоза + Ag(NH3) 2+ → Продукти окислення + Ag↓ + 2HN3 З цією ж метою застосовують відновлення вуглеводами гідроксиду купруму (II) до яскраво-червоного оксиду купруму (І): D-глюкоза + 2Си ОН)2 → Продукти окиснешгя + Сu2О + Н2О Фруктоза обидві згадані сполуки також відновлює, на відміну від кетонів. Але це відбувається не завдяки самій фруктозі, а внаслідок утворення в лужному середовищі певної кількості глюкози і манози при епімеризації фруктози. Концентровані розчини лугів моносахариди осмолюють з утворенням складної суміші продуктів окиснення, розщеплення, поліконденсації тощо.
|
||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 1500; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.01 с.) |



 -групи.
-групи.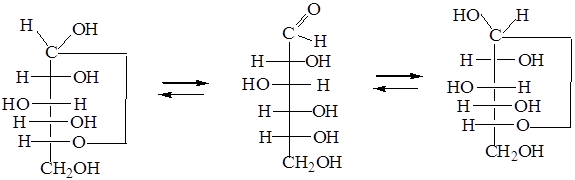












 Глікозид в загальному вигляді,показаний тільки аномерний атом вуглецю.
Глікозид в загальному вигляді,показаний тільки аномерний атом вуглецю.










 Спонтанного взаємного перетворення не відбувається
Спонтанного взаємного перетворення не відбувається дигетоксигенин
дигетоксигенин



 2C6H12O6
2C6H12O6





 СН3—(СН2)3-СНІ-СН3
СН3—(СН2)3-СНІ-СН3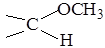 або монометиловий етер α-D-глюкопіранози дією метанолу на α-D-глюкопіранози в слабокислому середовищі. Окиснення такого глікозиду з подальшим гідролізом дає глюкуронову кислоту.
або монометиловий етер α-D-глюкопіранози дією метанолу на α-D-глюкопіранози в слабокислому середовищі. Окиснення такого глікозиду з подальшим гідролізом дає глюкуронову кислоту.




