Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кафедра органічної та аналітичної хіміїСодержание книги
Поиск на нашем сайте
Кафедра органічної та аналітичної хімії
На правах рукопису
УДК 663 (547-3) ББК 24.2(24я73)
Курта Сергій Андрійович Природні вуглеводи та полісахариди
НАВЧАЛЬНИЙ ПОСІБНИК
м. Івано-Франківськ 2013 р. Курта С.А. Природні вуглеводів та полісахариди - Навчальний посібник.Прикарпатський націо-нальний університет імені Василя Стефаника. – Івано-Франківськ, 2012. – 100 с. Вуглеводи є одним з основних харчових продуктів, вони містяться в злакових зернах, фруктах, картоплі, овочах. На вуглеводи припадає приблизно 2/3 їжі людини, а за калорійність- приблизно 55%. Окрім того, їх широко використовують у медицині, вони є сировиною для виробництва етилового спирту, гліцеролу, молочної, цитринової, глюконової кислот. Широко використовують штучні волокна (віскозні та ацетатні), плівкоутворювачі, вибухівка, папір з целюлози тощо. Навчальний посібник є рукопис, який містить теоретичні дослідження походження, будови та експериментальні обгрунтування способів синтезу, фізичних та хімічних властивостей і використання вуглеводів та полісахаридів природного походження в тому числі в вкладі виноградного вина. У роботі розглянуто класифікацію та походження вуглеводів, їх поширення, а саме моносахаридів, дисахаридів та полісахаридів особлива увага приділена таким представникам: глюкозі, фруктозі, мальтозі, целобіозі, лактоза, сахарозі, трегаллозі, крохмалю, амілозі, глікогену, целюлозі, ксантановій камеді, аміноцукрам та їх модифікованим похідним в складі виноградного сусла та вина. Приведені їхні особливості будови, добування, застосування, хімічні властивості та використання, а також принципи сенсорного аналізу та вживання виноградних вин. 100с., 23 літ. джерел, 120 хімічний формул та реакцій. Ключові слова: моносахариди, дисахариди, полісахариди, глюкоза, фруктоза, мальтоза, целобіоза, лактоза, сахароза, трегалоза, крохмаль, амілоза, глікоген, целюлоза, хімічні властивості, будова, виноград, вино..
Зміст Вступ …………………………………………………………………… 4 Розділ 1. Моносахариди ………………………………………………….8 1.1. Особливості будови …………………………………………... 8 1.1.2. Циклічна структура моносахаридів…………………….. 11 1.1.3. Мутаротація……………………………………………… 13 1.1.4. Глікозиди…………………………………………………. 17 1.2.Одержання моносахаридів ……………………………………. 22 1.2.1. Синтез і розклад моносахаридів…………………….….. 25 1.3.Хімічні властивості …………………………………………... 27 1.3.1. Реакції моносахаридів……………………………………. 27 1.3.2. Доказ структури Д-глюкози……………………………... 43 Розділ 2. Дисахариди ……………………………………………………. 50 2.1.Відновлюючі дисахариди ……………………………………. 50 2.1.1. Мальтоза…………………………………………………….. 50 2.1.2. Лактоза………………………………………………………. 51 2.2. Не відновлюючі дисахариди ……………………………..… 52 2.2.1. Гентибіоза і целобіоза…………………………………..… 52 2.2.2. Сахароза……………………………………………………. 53 2.2.3 Тригалоза……………………………………………………. 53 Розділ 3. Полісахариди ………………………………………………….. 55 Розділ 4. Аміноцукри……………………………………………………. 60 Розділ 5. Хімія вина………………………………………………………. 65 5.1. Хімічний склад винограду і вина…………………………………… 67 5.1.1.Моносахариди……………………………………………………. 67 5.1.2.Полісахариди…………………………………………………….. 73 5.2. Традиції вживання вина та їжі……………………………… 83 5.2.1. Вино та їжа: базові принципи поєднання…………………… 87 5.2.2. Сенсорний аналіз вина……………………………………….. 91 Розділ 6. Питання для самоконтролю ……………………… 95 Список використаних джерел …………………………………100
Вступ Вуглеводи – це клас біомолекул, якого в природі із всієї біомаси найбільше. На вуглеводи припадає приблизно 80% сухої маси рослин і 2% тварин. Вуглеводи надзвичайно поширені у рослинному і тваринному світі і мають виняткове значення в у життєвих процесах, оскільки є джерелом енергії для біологічних систем. Поряд з білками, нуклеїновими кислотами і ліпідами вони є основними компонентами, з яких формуються клітини організмів людей і тварин. У природі приблизно 80% сухої маси рослин і 2% сухої маси тварин припадає на вуглеводи. Синтез вуглеводів з СО2 і Н2О під дією світла і природного каталізатора хлорофілу (фотосинтез) є основою життєдіяльності рослинних ор ганізмів. Вуглеводи, один з основних харчових продуктів, містяться в зернах, картоплі, фруктах, овочах. Вони широко використовуються для виробництва спирту, штучного волокна, паперу, вибухівки тощо. Мета – класифікація, походження, особливості будови, одержання, вивчення хімічних властивостей, застосування, використання, поширення вуглеводів та природних полісахаридів. Завдання – допомогти студентам детально вивчитиклас органічних сполук -вуглеводні таполісахариди. Структура та обсяг роботи–робота складається з: анотації, змісту, вступу, 6-и розділів, питань для самоконтролю, списку використаних джерел. Робота викладена на 99 сторінках, містить 120 формул і 23 посилань на літературні джерела. В роботі вперше систематизовано і узагальнено величезний матеріал, опублікований у відомих виданнях та монографіях по хімії вуглеводів та природних полісахаридів та викладено у стислій формі, близько 39 сторінок, українською мовою, що дає можливість студентам і аспірантам за короткий період швидко ознайомитися з усіма типовими класами вуглеводів та природних полісахаридів.
Вуглеводи відіграють значну роль у складних біохімічних процесах метаболізму живих організмів і порушення їхнього обміну призводить до деяких хвороб (цукрового діабету, уражень печінки, нервової системи тощо). Такі вуглеводи, як рибоза і дезоксирибоза входять до складу нуклеїнових кислот, які забезпечують збереження і відтворення генетичної інформації. У живих організмах вуглеводи виконують певні функції, найважливішими з яких є структурні, енергетичні, захисні, транспортні. Вуглеводи виконують роль транспортерів – виводять з організму і знезаражують отримання речовини. Функція біологічно-активних сполук – моносахариди, вуглеводам належить ключова роль в процесах молекулярного пізнання. Вуглеводами називаються сполуки загальної формули Cn(H2O)n, з чим і пов’язана їх назва (К. Шмідт, 1844 р. – карбон і вод а). За хімічною класифікацією вуглеводи відносяться до гідроксиальдегідів або до гідроксикетонів, тобто, до сполук, які містять одночасно гідроксильні групи і альдегідну або кетонну. Вуглеводи називаються також цукрами, або сахаридами (карбогідратами). Для української хімічної термінології вуглеводів питання щодо користування родоначальними термінами цукор і сахар остаточно ще не вирішене. За рекомендаціями УНКоХіТерН пропонується керуватися правилом: слову сахар відповідає англійський термін sacchar, наприклад сахарид (saccharide), полісахарид (роlуsaccharide), сахароза (saccharose) тощо; а слову цукор - англійський термін sugar, наприклад, клас цукри (sugars), аміноцукор (aminosugar) тощо. Оскільки вуглеводи відносяться до поширеного класу природних сполук, правилами IUPAC дозволяється використовувати для них тривіальні назви. Такі назви для найпростіших вуглеводів закінчуються на –оза (рибоза, глюкоза, фруктоза, сахароза). Вуглеводи поділяюься на дві великі групи: моносахариди і полісахариди.
Загальна назва моносахаридів складається з назви числівника, що відповідає загальній кількості атомів вуглецю (три-, тетра-, пента-,гекса- тощо), і закінчення -оза. Наприклад, вуглеводи з чотирма атомами вуглецю – тетрози, з п'ятьма - пентози тощо. За функціональною групою моносахариди поділяють на альдози (альдегід + оза, гідроксиальдегіди) і кетози (кетон + оза, гідроксикетони). Повну загальну назву моносахариду утворюють з префікса альдо- або кето-, до якого додають назву числівника і закінчення (суфікса) -оза. Наприклад, моносахариди пентози С5Н10О5 називаються альдопентозами з альдегідною групою (рибоза, арабіноза, ксилоза, ліксоза) і кетопентозами з карбонільною групою (рибулоза, ксилулоза), а гексози С6Н1206 - альдогексозами і кетогексозами відповідно. Найбільше значення з природних сахаридів мають пентози та гексози, причому триози (гліцериновий альдегід, дигідроксиацетон) не вважаються сахаридами внаслідок суттєвої відмінності їх хімічних властивостей від властивостей інших моносахаридів, а тетрози в природі не зустрічаються. Полісахариди поділяють на цукроподібні, або олігосахариди (дисахариди, трисахариди тощо), і нецукроподібні (крохмаль, целюлоза, або клітковина). Представлена робота допоможе викладачу, студенту ознайомитися з основним хімічним складом, із застосовуваними сенсорного аналізу вин, їх асортиментом та показниками якості, а також атрибутикою під час їх споживання. Розділ 1. Моносахариди Особливості будови 1.1.1 У природі найпоширенішими моносахаридами є пентози і гексози, здебільшого групи альдоз. Родоначальниками генетичного ряду моносахаридів є хіральний гліцериновий альдегід для альдоз і дигідроксиацетон для кетоз:
гліцериновий альдегід дигідроксиацетон З цих сполук можна отримати синтетичним методом інші моносахариди, які утворюють генетичний ряд. Віднесення вуглеводів до D- або L-ряду залежить від конфігурації нижнього хірального вуглецевого атома на відміну від гідроксикислот і амінокислот, для яких конфігурація визначається за верхнім хіральним атомом. Генетичний ряд D-альдоз представлений на схемі:
D-еритроза D-треоза
D-рибоза D-арабіноза D-ліксоза D-ксилоза
Аналогічна картина спостерігається для L-гліцеринового альдегіду. Використавши в якості родоначальника кетоз дигідроксиацетон, можна побудувати по аналогії генетичний ряд D-кетоз:
Тривіальні назви тетра- і пентакетоз утворені з назв відповідних за структурою альдоз із суфіксом -улоза. Для моносахаридів існують також систематичні назви за правилами IUPAC. Так, назва альдоз утворюється за допомогою конфігураційних префіксів, які відповідають основній назві без закінчення -за. Конфігураційний префікс - проекція Фішера відповідної основи без урахування верхнього (карбонільного) і нижнього атомів вуглецю, що позначаються, наприклад: D-еритро- (це проекція D-еритрози без верхньої СНО- і нижньої СН2ОН-групи), D-арабіно-, D-глюко-. Далідо конфігураційного префікса додають назву основи (тетроза, пентоза, гексоза тощо) із закінченням -оза, наприклад: D -треоза (тривіальна назва) => D -трео-тетроза (систематична назва), D -арабіноза => D - арабіно -пентоза, D -глюкоза => D - глюко- гексоза. Аналогічно утворюють назви кетоз, але за основу конфігураційного префікса беруть той, що відповідає основі альдоз від нижнього атома вуглецю до кетогрупи. Наприклад, для D-фруктози застосовується конфігураційний префікс арабіно-, оскільки конфігурація D-фруктози від нижньої СН2ОН-групи до кетогрупи відповідає конфігурації альдози - D-арабінози. При цьому закінчення -а змінюють на -улоза, а положення кетогрупи позначають локантом, наприклад: D-еритрулоза => D- гліцеро -2-тетрулоза, D-фруктоза => D- арабіно -2-гексулоза, D-тагатоза => D-ліксо-2-гексулоза. Складніші правила для похідних моносахаридів. Найпоширенішими моносахаридами є D-глюкоза (виноградний цукор) і D-фруктоза (фруктовий цукор). Так, глюкоза міститься у винограді та більшості солодких фруктів, входить до складу дисахаридів (мальтоза, лактоза тощо), полісахаридів (крохмаль, клітковина, глікоген, декстрини тощо). Фруктоза також міститься переважно в солодких фруктах, але у меншій кількості, ніж глюкоза, а крім того, у меді, помідорах; входить до складу дисахариду сахарози, полісахариду інуліну тощо. На підставі вивчення хімічних властивостей глюкози (в реакціях відновлення, ацилювання, окиснення, утворення оксимів) А. Байєром і Р.Фіттігом (1870 р.) була визначена її структурна формула: СН2ОН-СН(ОН)-СН(ОН)-СН(ОН)-СН(ОН)-СН=О Пізніше Е. Фішер дослідив просторову конфігурацію глюкози та фруктози і запропонував для них сучасні проекційні формули:
D-фруктоза D-глюкоза Ці формули називаються відкритими або ланцюговими (карбонільними). Нумерацію починають з того кінця ланцюга, до якого ближче перебуває оксогрупа. Застосовують також позначення α-, ß- тощо по відношенню до оксогрупи. Було встановлено, що один гідроксил за хімічними властивостями реакційноздатніший і відрізняється від чотирьох інших гідроксилів. Крім того, незважаючи на здатність сполук на зразок глюкози до реакцій, характерних для оксогруп (взаємодія з НСN, окиснення аміачним розчином оксиду срібла, відновлення до шестиатомного спирту, утворення озазону з фенілгідразином), вони не взаємодіють з гідросульфітом NaHSO3, не забарвлюють розчини фуксинсульфітної кислоти, не вступають у реакції конденсації та полімеризації. Це свідчить про існування іншої форми моносахаридів, так званої циклічної, або напівацетальної (кільчастої, форми О. Коллі - Б. Толленса), якавиникає, наприклад, для глюкози і фруктози. Мутаротація Відомо, що свіжоприготовлений розчин α-D-глюкози обертає площину поляризованого світла вправо на кут 112º, а розчин ß-D-глюкози також вправо, але на 19º. При розчиненні однієї з цих форм у воді завжди відбувається часткова ізомеризація одного аномеру в інший через стадію відкритої форми до встановлення рівноваги між ними з кінцевим кутом обертання 52,7°. Така зміна значення кута обертання моносахаридів у часі називається мутаротацією (від лат. mutare – змінювати, rotatio - обертання), або аномеризацією. Встановлено, що у водному розчині глюкози при 25°С міститься36% α-D-глюкопіранози і 64% ß- D-глюкопіранози. Тільки приблизно 0,02% D-глюкози у таких розчинах існує у відкритій формі, але, яквже було зазначено, цього вистачає для перебігу хімічної реакції за карбонільною групою. Таким чином, глюкоза існує в основному в піранозній формі. Фуранозна форма для глюкози вважається нестійкою переважно внаслідок Відмінність конфігурації іншого, часто другого зверху, хірального вуглецевого атома викликає утворення епімерів. Епімери – діастереоізомери з декількома хіральними атомами, що відрізняються конфігурацією лише при одному (епімерному) атомі. Наприклад, D-глюкоза і D-маноза, D-алоза і D-альтроза, D-галактоза і D-талоза тощо є між собою епімерами:
Глюкоза Маноза Будову моносахаридів у циклічній формі зручно зображати перспективними формулами У. Хеуорса (1929 р.). При цьому атоми, розміщені у формулі Коллі -Толленса зліва, розташовуються зверху, а розміщені справа – внизу площини кільця. Біля п'ятого вуглецевого атома водень розташований внизу, оскільки для утворення кисневого містка С5-О необхідний поворот частини молекули навколо валентної осі С4-С5 для замикання циклу:
Аналогічно для ß-D-глюкопіранози отримаємо:
ß-D -Глюкопіраноза Насправді глюкoза і фруктоза, як і всі шестичленні цикли, не мають плоскої будови, а існують у вигляді просторових конформерів у формі ванни (шість конформерів) або в енергетично вигіднішій формі крісла (два конформери):
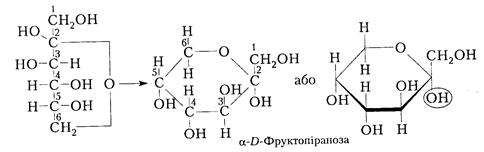
При цьому конформер І у формі крісла переважає, оскільки містить всі великі об’ємні замісники ОН і СН2ОН в екваторіальному положенні, а в конформері II вони знаходиться в аксіальному (паралельному) положенні. Внаслідок такої максимальної термодинамічної стійкості конформеру І ß-D-глюкоза та целюлоза на її основі значно поширені в природі. Для зручності будемо застосовувати формули Хеуорса, пам'ятаючи, що реально молекули моносахаридів існують у тій чи іншій конформаційній будові. Відповідно для фруктози, як це було показано на прикладі глюкози, можна навести піранозну і фуранозну формули Хеуорса:
Аналогічно для ß-D-фруктопіранози отримуємо:
ß-D-фруктопіраноза
α-D-фруктофураноза Аналогічно для ß-D -фруктофуранози отримуємо:
ß-D –фруктофураноза Таким чином, для вуглеводів характерні всі основні види ізомерії: структурна, стерична і конформаційна. Альдогексози у відкритій формі містять чотири хіральних атоми вуглецю, і, отже, загальна кількість стереоізомерів для них становить 2n = 24 = 16. Ці 16 ізомерів утворюють вісім пар енантіомерів: вісім D-ряду і вісім L-ряду (див. генетичний ряд альдоз). Усі 16 енантіомерів відомі, причому більшість L-ізомерів отримано синтетичним шляхом. При напівацетальній формі для альдогексоз кількість хіральних центрів збільшується до п'яти і альдогексозам відповідають вже 25 = 32 стереоізомери, тобто кожний з них існує в α- або ß-формі:
D-Глюкоза L-Глюкоза (природна) (синтетична)
Для кетогексоз, що містять три хіральні атоми вуглецю у відкритій формі, кількість стереоізомерів досягає 23=8, які утворюють чотири пари енантіомерів: чотири D-ряду і чотири L-ряду:
D-фруктоза (природна) L-фруктоза (синтетична)
α-D –Фруктофураноза α-L–Фруктофураноза Глікозиди Реакції простих півацеталів або півкеталів з спиртами утварюють відповідно ацеталі або кеталі.Альдози та кетози також дають ацеталі і кеталі.
Півацеталь ацеталь В хімії вуглеводів подібні речовини називають глікозидами.
Циклічні глікозиди, існуючі у вигляді шестичленних кілець,мають назву піранозиди. Циклічні глікозиди, кільце яких містить п’ять атомів,називаються фуранозидами.
Піранозид в загальному вигляді; фуранозид в загальному вигляді; В природі широко розповсюдені глікозиди глюкози – глюкозиди. Нижче дані різні способи зображення одного і того ж α-D-глюкопіранозида.
Різні способи зоброження одного і того ж метил α-D-глюкопіранозида.
При синтезі глікозидів з допомогою реакції моносахаридів з спиртами в присутності кислоти одержують звичайно ацеталі і кеталі.Так названий аглікон (що означає «які не містять цукор») приєднюється до С1 цукор через атом оксигену, тому більш точно називати утворений продукт О- глікозидом.Реакції утворення глікозидів проводять, як правило, в дуже м’ягких умовах,так що спирт не може перетворитись в ефір,і в реакцію вступає тільки гідрокильна група при С1.
D-глюкоза метил-α-D-глюкопіранозид (утворюється також β-аномер)
Глікозидний зв’язок зустрічається в усіх природніх вуглеводах,і тому методи її розщеплення має велику роль при аналізі вуглеводів.Як і інші ацеталі або кеталі,глікозиди стійкі в слаболужних розчинах,але легко гідролізуються кислотами.Механізм такого гідролізу зображений нижче:
Глікозид в загальному вигляді;
Не дивлячись на швидкість каталізуючого кислотами гідроліза,перевагу слід віддати ферментативному гідролізу. Річ в тім,що ферменти не тільки швидко розщіплюють глікозидні зв’язки,але і володіють високою селективністю.Так,наприклад, α-D-глюкозидаза із дріжджів діє тільки на глікозидні зв’язки при С1 α-аномера глюкози.Напроти, β-D- глюкозидаза,яка міститься в емульсині мендаля,специфічна по відношенню до β-глюкозидним зв’язкам. Півацеталі легко розщепляються, даючи карбонільні зв’язки і спирт.
А ацеталі,навпаки досить стійкі і не піддаються спонтанному гідролізу.
Глікозиди – це ацеталі.Тому вони не здатні спонтанно перетворюватись в відповідний моносахарид.
моносахарид Для того,щоб між аномерними глікозидами спонтанно встановилась рівновага,вони повинні бути здатні утворювати вільний моносахарид, так як саме він є проміжним з’єднанням при взаємоперетворенні α- і β-глюкозидів.В іншому випадку спонтанне взаємоперетворення аномерних глікозидів виключено.Виходячи з цього,фуранозиди і піранозиди не проявляють мутаротації.
Найбільш цікаві аглікони. Багато природніх продуктів містять цукри, які з’єднані глікозидними зв’язками з цікавими агліконами.До простих глікозидів, преставляючі інтерес з медичної точки зору, відносяться сердечні глікозиди, які містять стероїдний аглікон і використовуються для стимуляції сердечної діяльності.Із отруйної рослини наперстянки (Digitalis purperia)можна екстрагувати суміш, відому під назвою дегіталіса. Ця суміш багата глікозидами, головним агліконом яких є дигетоксигенин - поліциклічний спирт, який використовується при сердечних захворювань.
Крім О-глікозидів, існують і інші типи глікозидів, в яких аглікон приєднний до цукру не через атом оксигену, а через який-небудь інший атом. Наприклад, в N-глікозидах аглікон з’єднаний з С1 через атом азоту.
N-глікозиди в узагальненоному виді До найважливих N-глікозидам відносяться нуклеозиди,які складаються із рибози або дезоксирибози і гетероциклічного аміна. Нижче приведена формула аденозина-нуклеозида,збудованого з аденіна і рибози.
Аденін нуклеозид, збудований з рибози і аденіну Одержання моносахаридів Моносахариди можна отримувати за допомогою синтетичних методів, але в цьому немає потреби, оскільки вигідніше їх добуват з природних продуктів. Нижче наведено основні промислові та синтетичні методи одержання моносахаридів. 1. Альдольна конденсація. Першим синтезував цукристі речовини
Пізніше Е. Фішер виділив з такої суміші рацемат D- і L-фруктози. Альдольна конденсація гліцеринового альдегіду і дигідроксиацетону також веде до утворення кетогексоз:
2. Гідроліз дисахаридів і полісахаридів. Цей метод основний для С12Н22O11 + H2O дисахарид (сахароза) моносахарид (С6Н10O5)n + nH2O полісахарид моносахарид 3.Неповне окиснення шестиатомних спиртів. Зазвичайних умов при окисненні багатоатомних спиртів утворюється, як
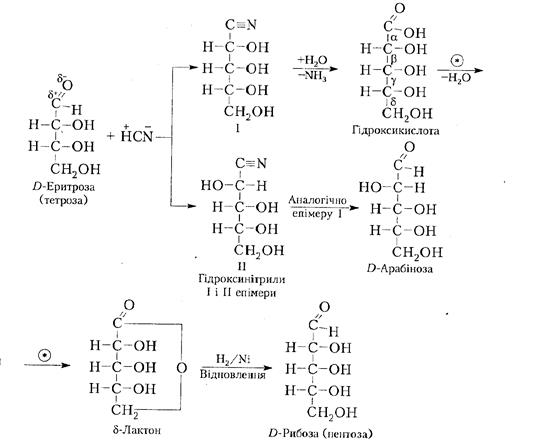
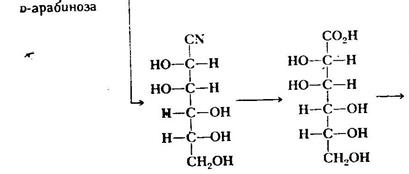
4. Гідроксинітрильний синтез Г. Кіліані - Е. Фішера. Даним методом можна збільшувати довжину вуглецевого ланцюга моносахариду. Таким шляхом були отримані гептози, октози і навіть декози C10H20O10,тобто з нижчих моносахаридів утворили вищі:
Гідроксинітрильний синтез відбувається завдяки здатності карбонільної групи моносахариду взаємодіяти з ціанідною кислотою з утворенням суміші епімерів (гідроксинітрилів І і II), що відрізняються конфігурацією верхнього хірального атома вуглецю С1. Такий гідроксинітрил гідролізують до відповідної гідроксикислоти, яка при нагріванні легко дегідратується з утворенням переважно стійкішого шестичленного δ-лактону порівняно з п'ятичленним γ-лактоном. Отриманий δ-лактон легше, ніж гідроксикислоту, відновити в альдопентозу дією амальгами натрію або каталітичного водню. На схемі наведені перетворення лише для епімеру І, оскільки для епімеру II вони аналогічні. 1.2.1Синтез і розклад моносахаридів; Синтез по методу Кіліані- Фішера. Цей метод застосовується для збільшення довжини вуглеводного ланцюга альдози на один атом вуглевода,в результаті чого утворюються дві діастометричні альдоза.
Вже на першій стадії синтезу утворюється ізомерні ціангідриди, після гідролізу і дегідротації яких утворюються лактони, які відновлюються до альдоз, які містять на один атом вуглевода більше, ніж вихідний моносахарид. Утворення D-глюкози і D-манози із альдопептози показано вище. Суміш дистереомерних продуктів можна розділити на різні стадії синтезу, але краще зробити перед останнім відновленням, так як розділення двох утворених цукрів буває спряжено з деякими труднощами. Ці ж реакції можна проводити в зворотньому порядку, якщо потребується скоротити вуглеводневий ланцюг моносахариду на один атом. Ця ретрореакція Кіліані- Фішера починається з перетворення альдози в оксим, при допомозі реакції з гідроксиламіном. Під дією оцтового ангідриду відбувається дегідратація оксиму до нітрилу.Ця реакція супроводжується ацетилюванням вільних гідроксильних груп вільних цукрів. Переетерифікація ацетильованого продукту дає ціангідрин моносахариду, який в результаті відщеплення ціанистого водню, перетворюється в альдозу, яка містить на один атом вуглеводу менше, ніж вихідний цукор.
Синтез D-глюкози і D-манози за Кіліані- Фішером Перетворення D-глюкози в D-арабінозу при допомозі ретрореакції Килліані- Фішера. В даному випадку получають тільки один кінцевий продукт, так як нові хіральні центри в реакціях не утворюються. Якщо для синтезу по Кіліані – Фішеру,беруть ціаністий водень в надлишку, щоб забезпечити високий вихід ціангідрина, для успішного протікання зворотньої послідовності реакції (так названої дигідратації по Волю) потрібно неперервно видаляти утворений ціаністий водень. Деградація по Руффу. Деградація альдоз по Руффу представляє собою вільнорадикальне декарбоксилювання солі гліконової кислоти, в результаті якого вуглецевий ланцюг альдози скорочується на один атом. Декарбоксилювання проводять сумішшю пероксиду водню і трьохвалентного заліза (так званий реактив Фентона). На жаль, вихід продукту складає всього біля 30-40%. Дегідратаціяглюкози по Руффу показана нижче.
Перетворення D-глюкози в D-арабінозу за допомогою деградації за Хімічні властивості 1.3.1.Реакції моносахаридів; Унаслідок особливості будови моносахариди проявляють властивості спиртів, карбонільних сполук і напівапеталів. Розглянемо спочатку їх реакції для відкритої (карбонільної) форми. 1. Відновлення. При відновленні моносахаридів утворюються відповідні багатоатомні спирти, реакція зворотна до неповного окислення. Під дією сильних відновників на зразок НІ відбувається їх повне відновлення. Наприклад, з глюкози отримують 2-йодогексан: СН2ОН-(СНОН)4-СН=О 2. Окиснення. Моносахариди легко окиснюються і залежно від характеру окисника дають різні продукти. Так, м'які окисники (НNO3, розведена або бромна вода) в кислих і нейтральних середовищах окис-нюють тільки альдегідну групу з утворенням так званих альдонових кислот. При застосуванні сильнішого окисника моносахариди або альдо-нові кислоти окиснюються в альдарові (двоосновні). Так, з глюконової кислоти при окисненні первинної спиртової групи одержують сахарну кислоту. При окисненні добуваються переважно не самі кислоти, а іх лактони. Уронові кислоти отримують шляхом окиснення похідних моносахаридів з попередньо захищеною альдегідною групою. Застосуванні захисту альдегідної групи пояснюється необхідністю її збереження від окиснення. Для цього спочатку утворюють глікозид Інший метод полягає у відновленні амальгамою натрію моно лактонів сахарних кислот, що легко утворюються при реакції:
З таких γ-монолактонів сахарної кислоти першою буде відновлюватися та карбоксильна група, яка легше утворює лактон. Фруктоза (кетогексоза) окиснюється важче, ніж глюкоза (альдо-гексоза), і часто з розщепленням вуглецевого ланцюга:
У лужному середовищі моносахариди окиснюються з розщепленням вуглецевого ланцюга і з утворенням продуктів окиснення, які хактеризуються сильними відновними властивостями. На цьому засноване застосування для якісного визначення вуглеводів реакції срібного дзеркала – так звана проба Толленса, що полягає в окисненні альдегідної групи під дією аміачного розчину оксиду срібла (реактиву Толленса): D-глюкоза + Ag(NH3) 2+ → Продукти окислення + Ag↓ + 2HN3 З цією ж метою застосовують відновлення вуглеводами гідроксиду купруму (II) до яскраво-червоного оксиду купруму (І): D-глюкоза + 2Си ОН)2 → Продукти окиснешгя + Сu2О + Н2О Фруктоза обидві згадані сполуки також відновлює, на відміну від кетонів. Але це відбувається не завдяки самій фруктозі, а внаслідок утворення в лужному середовищі певної кількості глюкози і манози при епімеризації фруктози. Концентровані розчини лугів моносахариди осмолюють з утворенням складної суміші продуктів окиснення, розщеплення, поліконденсації тощо. Дія лугів (епімеризація). Луги за нормальних умов викликають кето-енольну таутомерію біля С1 і С2 атомів вуглецю моносахаридів, що зумовлює їх епімеризацію. При цьому з одного моносахариду утворюються відповідні епімери. Наприклад, при дії на D-глюкозу розчином лугу вона на 2-3% перетворюється в D-манозу і на 31% у D-фруктозу через стадію проміжного ендіолу:
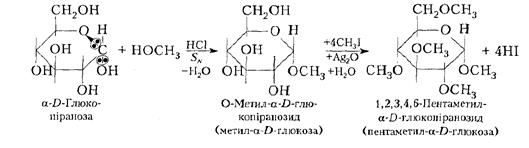
Алкілювання моносахаридів. При алкілюванні, наприклад, глюкози слабким алкілюючим агентом, як СН3ОН, у присутності розчину НСІ реагує тільки глікозидний гідроксил з утворенням відповідного глікозиду, чи ацеталю. Глікозид – ацепшль або кеталь моносахариду, який існує в α- і ß-формах. Інші чотири ОН-групи глюкози при цьому в реакції участь не беруть. До глікозидів відносяться похідні моносахаридів, в яких глікозидний гідроксил заміщений будь-яким невуглеводним залишком – агліконом і сполучений з циклом моносахариду через атом кисню, азоту або вуглецю. Ацеталі глюкози (глікозиди) прийнято називати глюкозидами, галактози - галактозидами тощо, а кеталі фруктози - фруктозидами. Підвищену реакційну здатність глікозидного гідроксилу пояснюють впливом етерового атома кисню, який зміщує частково електрони суміжних С-О-зв'язків на себе. Таке зміщення електронної густини збільшує полярність зв'язку між атомом вуглецю і ОН-групою:
Глікозиди на зразок метил-α- D-глюкози не здатні до мутаротації у водних розчинах, не відновлюють аміачний розчин оксиду срібла до металічного срібла або Сu(ОН)2 до Сu2О і тому є невідновлюючими сахаридами. При дії надлишку сильніших алкілюючих агентів (алкілгалогенідів, діалкіл-сульфатів (RО)2 SО2 тощо) алкілюються інші чотири гідроксили з утворенням повного етеру. Механізм алкілювання за глікозидним гідроксилом полягає в заміщенні його СН3О-групою. При алкілюванні інших гідроксильних груп галоген алкілами механізм реакції полягає в заміщенні атомів водню ОН-груп алкілами СН3- і подібний до механізму утворення етерів:
При гідролізі повністю алкільованих моносахаридів у м'яких умовах у першу чергу гідролізується ацетальна група, утворена завдяки глікозидному гідроксилу. Для діалкілових етерів R—О —R при цьоот гідроліз не спостерігається. У жорсткіших умовах гідролізуються інші чотири етерові зв'язки до вихідного моносахариду. Таким чином, повністю метильована глюкоза містить ацетальний і етерні зв'язки, що утворилися різними шляхами і гідролізуються в різних умовах. Ацилювання моносахаридів. Моносахариди ацилюються звичайними ацилюючими агентами до естерів:
Аналогічно етерам моносахаридів при гідролізі естерів у першу чергу гідролізується естерова група, утворена глікозидним гідроксилом. Це використовують для синтезу інших похідних мон
|
||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 610; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.92.213 (0.012 с.) |

 Моносахаридами (монозами) називаються прості вуглеводи, не здатні гідролізуватися з утворенням найпростіших вуглеводів. Полісахаридами називаються вуглеводи, здатні гідролізуватися на моносахариди.
Моносахаридами (монозами) називаються прості вуглеводи, не здатні гідролізуватися з утворенням найпростіших вуглеводів. Полісахаридами називаються вуглеводи, здатні гідролізуватися на моносахариди.

















 Глікозид в загальному вигляді,показаний тільки аномерний атом вуглецю.
Глікозид в загальному вигляді,показаний тільки аномерний атом вуглецю.










 Спонтанного взаємного перетворення не відбувається
Спонтанного взаємного перетворення не відбувається дигетоксигенин
дигетоксигенин



 2C6H12O6
2C6H12O6





 СН3—(СН2)3-СНІ-СН3
СН3—(СН2)3-СНІ-СН3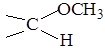 або монометиловий етер α-D-глюкопіранози дією метанолу на α-D-глюкопіранози в слабокислому середовищі. Окиснення такого глікозиду з подальшим гідролізом дає глюкуронову кислоту.
або монометиловий етер α-D-глюкопіранози дією метанолу на α-D-глюкопіранози в слабокислому середовищі. Окиснення такого глікозиду з подальшим гідролізом дає глюкуронову кислоту.



 Перетворення такого типу відбуваються і для D-фруктози або D-манози. Доказом наведених процесів є те, що всі три згадані сахариди однаково реагують з фенілгідразином і відрізняють між собою лише конфігурацією біля другого атома вуглецю (С2).
Перетворення такого типу відбуваються і для D-фруктози або D-манози. Доказом наведених процесів є те, що всі три згадані сахариди однаково реагують з фенілгідразином і відрізняють між собою лише конфігурацією біля другого атома вуглецю (С2).