
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергетические уровни атомов. Спектр излученияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Опыты по рассеянию -частиц обнаружили существование в атомах тяжелого положительного ядра и электронной оболочки. Энергия электрона: Вырожденный уровень – некоторому значению энергии соответствуют несколько состояний. Кратность вырождения для атома водорода: Спектр излучения – относительная интенсивность электромагнитного излучения объекта исследования по шкале частот. Опыт Штерна и Герлаха. В этом опыте пучок атомов пропускался через пространство между 2 полюсами магнитов и попадал на экран. Полюса были таковы, что существовала только компонента
Магнитомеханические эффекты. Намагничивание некоторого тела при помещении его во внешнее магнитное поле приводит к возникновению механического момента у тела – оно начинает вращаться. Если привести тело в быстрое вращение, то тело начинает намагничиваться. В отсутствии закона сохранения момента импульса кристаллическая решетка и соответственный стержень приобретают механический момент направленный по полю. Магнитный и механический моменты связаны соотношением:
Принцип Паули. Принцип тождественности, периодическая система элементов. Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда следует, что два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, т.к. для фермионов волновая функция должна быть антисимметричной. Фермионы – частицы, обладающие полуцелым сплином. Принцип Паули: В определённом состоянии может находиться не более одного фермиона. Для электрона это значит, что в состоянии с заданными квантовыми числами (n,l,m,
Закон Мозли. Рентгеновские спектры. При бомбардировке анода электронами наблюдается рентгеновское измерение, он бывает 2х типов: тормозное и характеристическое. При слишком большой энергии электронов наблюдается тормозное рентгеновское излучение имеющее непрерывный спектр – совокупность резких линий отвечающих определённым частотам. Закон Мозли — закон, связывающий частоту спектральных линий характеристического рентгеновского излучения атома химического элемента с его порядковым номером. Согласно Закону Мозли, корень квадратный из частоты Спектры молекул (МС). МС - спектры поглощения, испускания или рассеяния, возникающие при квантовых переходах молекул из одного энергетического состояния в другое. MС определяются составом молекулы, её структурой, характером химической связи и взаимодействием с внешними полями (и, следовательно, с окружающими её атомами и молекулами). Существую спектры: э лектронные, колебательные, в ращательные.
|
||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 451; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.231.116 (0.008 с.) |

 , n=1,2…. Энергия атома не может изменяться непрерывно. Она изменяется скачками на определенные, конечные порции, различные для разных атомов. При излучении электрон переходит с одной стационарной орбиты на другую, поэтому:
, n=1,2…. Энергия атома не может изменяться непрерывно. Она изменяется скачками на определенные, конечные порции, различные для разных атомов. При излучении электрон переходит с одной стационарной орбиты на другую, поэтому:  – энергия кванта равна разности начальной и конечной энергии. Энергия атома не может быть любой, а может принимать только некоторые избранные значения, характерные для каждого атома.
– энергия кванта равна разности начальной и конечной энергии. Энергия атома не может быть любой, а может принимать только некоторые избранные значения, характерные для каждого атома. , l – определяющая величину момента импульса.
, l – определяющая величину момента импульса.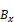 и
и  . Атомы обладают моментом и магнитным моментом равны сумме соответствующих внешних электронов. По классической теории, на экране должен образоваться сплошной свет, но в опыте на экране возникали симметрично расположенные полосы, число которых определялось химическим элементом. Опыт говорит о том, что проекции магнитного момента на некоторую ось могут принимать только некоторый дискретный набор значений. Это явление получило название пространственного квантования.
. Атомы обладают моментом и магнитным моментом равны сумме соответствующих внешних электронов. По классической теории, на экране должен образоваться сплошной свет, но в опыте на экране возникали симметрично расположенные полосы, число которых определялось химическим элементом. Опыт говорит о том, что проекции магнитного момента на некоторую ось могут принимать только некоторый дискретный набор значений. Это явление получило название пространственного квантования. .
. ) может находиться не более одного электрона. Принцип Паули позволяет объяснить, почему электроны в атоме не переходят все сразу в основное состояние с моментальной энергией. На основе принципа Паули объясняется периодическая система.
) может находиться не более одного электрона. Принцип Паули позволяет объяснить, почему электроны в атоме не переходят все сразу в основное состояние с моментальной энергией. На основе принципа Паули объясняется периодическая система. спектральной линии характеристического излучения элемента есть линейная функция его порядкового номера z:
спектральной линии характеристического излучения элемента есть линейная функция его порядкового номера z:  , где R — постоянная Ридберга,
, где R — постоянная Ридберга,  — постоянная экранирования, n — главное квантовое число. На диаграмме Мозли зависимость от Z представляет собой ряд прямых (К-, L-, М- и т. д. серии, соответствующие значениям n = 1, 2, 3,...).
— постоянная экранирования, n — главное квантовое число. На диаграмме Мозли зависимость от Z представляет собой ряд прямых (К-, L-, М- и т. д. серии, соответствующие значениям n = 1, 2, 3,...).


