
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Порядок работы на калориметреСодержание книги
Поиск на нашем сайте
Результатом проведения эксперимента на данной установке является измерение с высокой точностью разности температур между рабочим калориметром, в котором протекает исследуемый процесс и эталонным калориметром, в котором находятся те же соединения, что и в рабочем калориметре, но они изолированы друг от друга. Выбор рабочего калориметра осуществляется тумблером с цифрами 1 и 2. Навеска соли, взятая на аналитических весах в пробирке с пробкой, аккуратно помещается в держатель ампулораскалывателя. В калориметрический стакан наливают известное количество калориметрической жидкости. таким образом подготавливают калориметры 1 и 2. Закрывают крышки калориметров. Включают мешалки и секундомер. С этого времени начинается эксперимент. Весь опыт делится на три периода: предварительный, продолжительность которого зависит от времени установления температуры, но не менее 3 минут; главный, продолжительность которого зависит от скорости процесса, протекающего в рабочем калориметре, и заключительный, продолжающийся 3-5 минут. После окончания предварительного периода разбивают ампулу с солью путем вращения ручки ампулораскалывателя. В главном периоде продолжают записывать показания температуры до тех пор, пока вновь не установится равномерный ход температуры. Переход к нему означает начало заключительного периода. Записывать показания термометра (DТ) следует: в главном периоде – через каждые 10 с, в предварительном и заключительном – через 30 с. По результатам измерений строят график зависимости DТ = f(t), где t - время, с. Изменение температуры в результате выделения или поглощения тепла в процессе опыта DТоп определяют графически. Для нахождения продолжительности главного периода проводят прямые через точки начального и конечного периодов. Точки отрыва от этих прямых линии графика соответствуют началу и окончанию главного периода. Для нахождения DТоп с поправкой на теплообмен с окружающей средой отрезок оси абсцисс, соответствующий продолжительности главного периода делят пополам и из середины отрезка проводят перпендикуляр. Точки пересечения этого перпендикуляра с продолжениями прямых линий, характеризующих ход температуры в начальном и конечном периодах дают возможность рассчитать DТоп, как разность значений ординат точек окончания и начала главного периода.
Способы определения теплоемкости калориметрической системы
Теплоемкость калориметрической системы Ск – это количество теплоты, необходимое для ее нагревания на 1 град. В данном случае понятие теплоемкость относится не к веществу, а к системе, так как нагревается и стеклянная пробирка, и находящаяся внутри нее соль, и стакан с калориметрической жидкостью, и металлические части калориметра и воздух внутри него.
где: DQ – количество теплоты, сообщенное системе, DТоп – полученное из опыта значение изменения температуры. Существует 2 способа сообщить системе известное количество теплоты: а) с помощью электрического нагревателя; DQ = Р∙t, Дж (2.8) где: Р – мощность нагревателя, Вт; t - продолжительность нагревания, с.
б) проведение в калориметре процесса с известным тепловым эффектом. Таким процессом может быть растворение соли, например KBr.
где: DН – интегральная теплота растворения соли (справочная величина зависит от концентрации полученного раствора); DТоп – изменение температуры, вызванное тепловым эффектом DН.
Порядок выполнения работы
Взвешивают на аналитических весах в 2-х пробирках с пробками указанное преподавателем количество соли. В калориметрические стаканы наливают дистиллированную воду по 200-300 г (по указанию преподавателя). Устанавливают ампулы и стаканы с водой в рабочий и эталонный калориметры. По указанию преподавателя выбирают один из способов определения Ск и снимают зависимость DТ = f(t). На основании полученных экспериментальных данных строят график и определяют DТоп. При определении Ск с использованием нагревателя последний включают на 1-3 мин после окончания предварительного периода, затем выключают. Этим завершается главный период и продолжают снимать показания в заключительном периоде. Если Ск определяют другим способом, то в пробирки помещают навески стандартной соли (KBr или KCl) и проводят эксперимент по обычной схеме. Для выбора табличного значения теплоты растворения соли предварительно рассчитывают концентрацию образовавшегося раствора стандартной соли. Значения Ск получают из формул (2.9 или 2.10).
Загружают калориметрическую установку пробирками с исследуемой безводной солью и стаканами с дистиллированной водой и снимают зависимость DТ = f(t). Проводят аналогичный эксперимент с кристаллогидратом соли. Строят графики и определяют значения DТоп. Экспериментальные данные заносят в таблицу 2.1. Таблица 2.1.
* - Время начала главного периода (отметить, в какой момент времени был включен и выключен обогреватель, или разбита ампула).
Интегральную теплоту растворения безводной соли и ее кристаллогидрата рассчитывают, используя экспериментальные значения DТоп1 и DТоп2 и полученное ранее значение Ск, где DТоп1 и DТоп2 – изменение температуры в езультате растворения n1 моль безводной соли и n2 моль ее кристаллогидрата (соответственно):
Затем по закону Гесса вычисляют теплоту образования кристаллогидрата (гидратации) DH по экспериментально найденным тепловым эффектам DH1 и DH2, например:
DH1 = DH+DH2 – по закону Гесса DH = DH1 - DH2
Химическое равновесие
Математическим выражением законов термодинамики для равновесия химических процессов является закон действующих масс, который в простейшем случае можно сформулировать следующим образом: отношение произведения равновесных концентраций (или парциальных давлений) продуктов реакции, взятых в степенях, равных их стехиометрическим коэффициентам к аналогичному произведению для исходных веществ при данной температуре есть величина постоянная. Таким образом, для реакции вида:
где Кс и Кр – константы равновесия этой реакции при определенной температуре. Константы равновесия химической реакции позволяет знать направление и предел ее возможного протекания. Если для реакционной смеси с определенными значениями парциальных давлений р’A, р’B, р’C и р’D составить выражение -DG = RT ln(Kp – K’p), (3.3) которое называется уравнением изотермы химической реакции (изотермы Вант-Гоффа при T=const и p=const). С помощью уравнения изотермы (3.3) можно определить химическое сродство различных веществ, т.е. характеризовать их способность вступать во взаимодействие друг с другом. При этом определяется стандартное сродство (DG0), относящееся к предполагаемому протеканию реакций в стандартных условиях Р’A = P’B = P’C = P’D = 1 Тогда ln К’p = 0, и уравнение изотермы упрощается: - DGо = RT ln Kp (3.4) Из уравнений (3.3) и (3.4) получаем уравнение DG = -DGо + RT lnK’p (3.5) для определения сродства в нестандартных условиях. Справедливы аналогичные уравнения -DF0 = RT ln Kc (3.6) DF = -DFо + RT lnK’c (3.7) где DF и DF0 – потенциал Гельмгольца и стантартное сродство (при T=const и V=const). Следует отметить, что если реакция идет без изменения числа молей в газовой фазе, то Кр = Кс.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 768; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.236.223 (0.011 с.) |

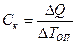 , (2.7)
, (2.7)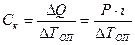 , Дж/град (2.9)
, Дж/град (2.9)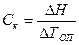 , Дж/град, (2.10)
, Дж/град, (2.10) (2.11)
(2.11) (2.12)
(2.12)

 а А + b B c C + d D
а А + b B c C + d D (3.1)
(3.1)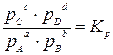 (3.2)
(3.2)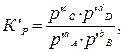 то связь между Кр и DG (потенциалом Гиббса) можно описать уравнением:
то связь между Кр и DG (потенциалом Гиббса) можно описать уравнением:


