
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Составители: д-р хим. наук Н.Р. КильдееваСодержание книги
Поиск на нашем сайте К-т хим. наук П.А. Перминов Москва 2009 В методических указаниях приведены руководства для выполнения лабораторных работ и кратко рассмотрен ряд теоретических вопросов по разделам курса «Физическая химия», изучаемым студентами факультета химической технологии и экологии в 5 семестре. Методические указания по курсу «Физическая химия» предназначены для студентов дневного отделения специальностей 240201.65 «Технология и оборудование производства химических волокон и композиционных материалов на их основе», 240202.65 «Химическая технология и оборудование отделочного производства», а также направления 240100.62 «Химическая технология и биотехнология». Составители: д-р хим. наук Кильдеева Н.Р., к-т. хим. наук Перминов П.А. Рецензенты: профессор кафедры аналитической, физической и коллоидной химии, д-р хим. наук, профессор Волков В.А., профессор кафедры общей и неорганической химии, д-р хим. наук, профессор Павлов Н.Н.
Подготовлено к печати на кафедре Ответственный редактор проф. Б.А. Измайлов
содержание Введение…………………………………………………………………………….4 1. Строение молекул………………………………………………………………..8 Рефракция………………………………………………………………………..8 Лабораторная работа №1.Определение рефракции и структурной формулы вещества………………………………………………………………………....10 Парахор…………………………………………………………………………..13 Лабораторная работа №2. Определение парахора и структурной формулы вещества…………………………………………………………………………14 2. Термохимия………………………………………………………………………17 Лабораторная работа №3. Определение интегральной теплоты растворения соли (безводной и кристаллогидрата) и расчет теплоты гидратации……….19 3. Химическое равновесие…………………………………………………………24 Лабораторная работа №4. Определение константы равновесия реакции взаимодействия салициловой кислоты с треххлористым железом в водном растворе………………………………………………………………………….25 4. Фазовые равновесия в многокомпонентных жидких системах………………31 Гетерогенные жидкие системы………………………………………………...31 Лабораторная работа №5. Изучение взаимной растворимости жидкостей и фазового равновесия в двухкомпонентной системе………………………….33 Свойства растворов жидких летучих компонентов. Перегонка……………..35 Лабораторная работа №6. Перегонка бинарных смесей полностью смешивающихся жидкостей……………………………………………………38
В в е д е н и е
Методические указания к выполнению лабораторных работ, предусмотренных рабочей программой по физической хими для студентов 3 курса дневного отделения факультета химической технологии и экологии, изложенные в настоящем учебном пособии (Часть 1), содержат описание лабораторных работ, выполняемых в учебной лаборатории кафедры аналитической, физической и коллоидной химии в осеннем семестре. Материалы лабораторного практикума весеннего семестра будут изложены в следующем учебном пособии (Часть 2). Описанию лабораторной работы предшествует краткий теоретический материал, позволяющий понять цели работы и правильно интерпретировать полученные экспериментальные данные. Материал каждой лабораторной работы содержит цель работы, задание к ее выполнению, описание основных материалов и лабораторного оборудования, таблицы для записи результатов измерений и расчетных величин, последовательность и основные приемы выполнения работы и ссылки на методы расчета и обработки экспериментальных данных. Лабораторные работы выполняются по маршрутам согласно графику, составляемому на первом вводном занятии. Одинаковые лабораторные работы одновременно могут выполнять 2 (за редким исключением 3) студента. После выполнения каждых двух лабораторных работ на специально отведенном занятии проводится их защита. В соответствии с рейтинговой системой оценки знаний по физической химии одна лабораторная работа оценивается в 1-3 балла. При защите работы учитывается аккуратность при выполнении эксперимента, знание методики выполнения работы, соответствие полученных результатов данным справочников физико-химических величин, правильность расчетов и построения графиков, знание теоретического материала соответствующего раздела курса.
Правила выполнения работ в лаборатории физической химии
1. Работа должна быть законспектирована в рабочем журнале. В конспекте нужно отразить цель работы, последовательность выполнения этапов, формулы, необходимые для расчета, и таблицы, в которые следует вносить результаты измерения по мере проведения работы. 2. Все значения физических величин следует выражать в системе СИ. 3. Перед началом работы необходимо получить у преподавателя допуск к ее выполнению. 4. Получить в препараторской лабораторную посуду и дополнительное оборудование, необходимое для проведения измерений. 5. При выполнении работы результаты необходимо сразу вписывать в подготовленные таблицы в рабочем журнале. 6. По завершению выполнения работы необходимо вернуть в препараторскую посуду, сдать рабочее место и подписать у преподавателя результаты эксперимента. 7. Защита работы проводится на занятии в соответствии с графиком проведения лабораторных работ или во время коллоквиумов. Защита включает проверку знаний теоретического раздела работы, методики ее выполнения и расчетов. Число баллов, полученное при защите, проставляется преподавателем в лабораторном журнале студента.
Обработка экспериментальных данных
При проведении работы в лаборатории физической химии особенное внимание нужно уделять ведению рабочего журнала и правильной записи экспериментальных данных. Все экспериментальные данные записываются непосредственно в рабочий журнал. При оформлении работы нужно указать ее название, дать краткое содержание, нарисовать схему прибора и описать последовательность эксперимента. Полученные данные записывают в таблицу, составленную перед выполнением работы. Это дает возможность заранее предвидеть, какие данные, необходимые для расчета, нужно взять из справочников. Необходимо следить за тем, чтобы числа, вносимые в таблицу, соответствовали точности измерения и давались с соответствующим количеством значащих цифр. Для этого нужно знать цену деления приборов, используемых в работе (бюретки, весы, электроизмерительные приборы и т.д.), правила расчета приближенных величин и теорию ошибок измерения.
Построение графиков
Так как графическое рассмотрение изучаемых процессов является важным методом исследования, то необходимо научиться правильно строить графики. Графики дают возможность: 1. вывести математическую формулу, описывающую исследуемый процесс; 2. элиминировать случайные ошибки опыта; 3. рассчитать методом графического интерполирования или экстраполирования некоторые искомые величины, которые нельзя, в силу каких-либо причин, найти непосредственно из опыта; 4. позволяют обнаружить наличие максимумов, минимумов, перегибов, характеризующих особенности процесса; 5. определить важные термодинамические функции и физико-химические постоянные. Метод графического экстраполирования. Графическая экстраполяция обычно проводится в случае линейной зависимости y=f(x). Прямую линию, описывающуюся уравнением y=ax+b, получают из результатов эксперимента по координатам не менее четырех значений переменных. Продолжив прямую линию до пересечения с осью ординат, определяют значение b как отрезок, который отсекает прямая на оси ординат (y=b при x=0) Рассмотрим пример: допустим, необходимо найти значение эквивалентной электропроводности при бесконечном разведении l¥ для раствора сильного электролита. Для этого можно воспользоваться уравнением l = l¥ - аÖс и экспериментально изучить зависимость l = f(Öс). Эта зависимость, как видно из уравнения, описывается прямой линией. При Öс®0, l ®l¥. Поэтому, если через полученные экспериментальные точки провести прямую линию и продолжить ее до пересечения с осью ординат (экстраполировать на ось ординат), то отрезок, отсекаемый на ординате, равен l¥. Метод графического интерполирования заключается в нахождении искомой величины, лежащей между двумя известными значениями переменных и функции. Если известны значения Öс1 и Öс3 и соответствующие им значения l1 и l3, то из графика можно найти любое промежуточное значение l2. Графическое интерполирование можно проводить и в случае нелинейной зависимости. При построении графиков нужно иметь в виду следующие общие положения: 1) Графики строят на миллиметровой бумаге размером не более тетрадного листа. 2) Начало осей ординат располагают в левом нижнем углу миллиметровки. 3) При построении кривой y=f(x) значение функции (y) откладывают на оси ординат, а значение переменной (х) – на оси абсцисс. 4) Выбирают правильное значение масштаба с учетом ошибки измерения и соотношение координат. Масштаб характеризует число мм, приходящихся на единицу измерения. Как правило, соотношение координат не должно резко отличаться друг от друга, чтобы график не получился очень растянутым, или, наоборот, с очень большой кривизной. Однако лучше, если график несколько вытянут по оси ординат. Это дает возможность определить значение функции (y) с большей точностью. 5) Нужно стремиться к тому, чтобы все поле чертежа было полностью использовано. Если значения «x» или «y» велики по абсолютной величине и далеки от нулевого значения, то за начало координат можно принять величину, несколько меньшую самых малых значений «x» и «y». 6) Никогда не следует откладывать на осях координат значения величин, полученные непосредственно из опыта или расчета. Достаточно отложить на осях ряд целых чисел, характеризующих масштаб. 7) Если в результате измерений или расчетов получаются очень большие или, наоборот, очень маленькие цифры, то на оси координат откладываются значения, содержащие не более 3-х значащих цифр, а обозначение координаты приводится с соответствующим множителем, например: число 2000 представляется в виде 2,0∙103, тогда на оси (Y) откладывается значение 2,0, а обозначение координаты указывается в виде у∙10-3. 8) Если график строится на основании экспериментальных, а не расчетных данных, то обязательно наносят все экспериментальные точки. Благодаря случайным ошибкам экспериментальные точки могут показывать некоторый разброс. Тем не менее, проводимые через них кривые должны быть плавными. Никогда не нужно соединять точки так, чтобы образовывалась ломаная линия. Для построения правильной кривой нужно, чтобы она проходила возможно близко ко всем экспериментальным точкам. При этом необходимо, чтобы сумма отклонений всех точек, лежащих с одной стороны кривой, была равна сумме отклонений всех точек, лежащих с другой стороны кривой. Для правильного построения зависимости y=f(x) можно воспользоваться методом наименьших квадратов. 9) Графики должны быть построены не только правильно, но и аккуратно. Нужно обязательно указывать название изображенной графически зависимости, обозначать на осях координат функцию и переменную и их единицы измерения. 10) Листы миллиметровой бумаги с графиками должны быть вклеены в лабораторный журнал.
МЕТОДЫ ОПРЕДЕЛЕНИЯ строения молекул Рефракция строение молекул определяет многие свойства как физические, так и химические. Каждая молекула характеризуется индивидуальным, соответствующим минимальной энергии, расположением положительно заряженных ядер и отрицательно заряженных электронов в молекуле, центры тяжести которых могут совпадать и не совпадать. Это определяет полярность молекул. Характеристикой полярности является величина дипольного момента:
где: е - заряд частицы; l – расстояние между центрами тяжести положительного и отрицательного зарядов. За единицу измерения дипольного момента принимается 1 дебай (1D = 3,3∙10-30Кл∙м). В случае совпадения центров тяжести положительного и отрицательного зарядов m=0. Под воздействием статического электрического поля молекула поляризуется (т.е. происходит смещение центров тяжести зарядов), при этом величина индуцированного дипольного момента mинд. пропорциональна напряженности поля Е:
где: a - коэффициент пропорциональности, называемый поляризуемостью. Результат воздействия слабого поля на молекулу представляет собой совокупность двух эффектов: смещения электронов с частичной деформацией молекулярных орбиталей (для полярной и неполярной молекул) и поворота молекулы в целом (только для полярных молекул). Соответственно поляризуемость молекулы складывается из индукционной и ориентационной поляризуемости:
Ориентационная поляризуемость связана с постоянным дипольным моментом молекулы:
где: к – постоянная Больцмана, Т – абсолютная температура. Влияние температуры на aор проявляется в дезориентирующем действии теплового движения молекул. aинд. не зависит от температуры. Поляризуемость совокупности молекул, образующих 1 моль вещества называется молярной поляризацией Р:
Молярная поляризация, поляризуемость и дипольный момент связаны между собой уравнением Дебая:
где: N – число Авогадро. Молярная поляризация диэлектрика зависит от диэлектрической проницаемости. Эта зависимость выражается уравнением Клаузиуса-Моссоти:
где: Комбинирование уравнений (1.6 и 1.7) дает возможность экспериментальным путем определить дипольный момент молекул в газах и жидкостях:
Зависимость (1.8) представляет собой уравнение прямой линии в координатах РМ =f(1/Т), тангенс угла наклона которой равен (4pm2N)/9к. Определив экспериментально В электромагнитном поле высокой частоты (в том числе в области видимого света) постоянный диполь молекулы не успевает ориентироваться за время одного колебания (~10-13 с), поэтому Рор =0, тогда: РМ =РМинд. В этом случае РМинд. определяется изменением состояния молекулярных орбиталей под действием электромагнитного поля. Величина РМинд. – важная молекулярная постоянная, ее называют молекулярной рефракцией и обозначают RМ=РМинд.. Для неполярных молекул РМ= RМ, для полярных молекул:
Из электромагнитной теории света Максвелла известно, что для длин волн, сильно удаленных от области их поглощения молекулами вещества, справедливо равенство n2=
Уравнение (1.10) называют уравнением Лорентца-Лоренца по именам профессоров Лейденского университета Г.А.Лорентца и Военной школы в Копенгагене Л.В.Лоренца. RМ, как и РМ имеет размерность объема. Молярная рефракция RМ (иногда ее называют молекулярной рефракцией) практически не зависит от температуры и агрегатного состояния вещества. Важнейшее свойство рефракции, позволяющее использовать ее для определения строения молекул, аддитивность; это значит, что молекулярные рефракции соединений могут быть представлены аддитивно, т.е. как сумма рефракций составных частей молекулы: атомов и связей. Аддитивность рефракций широко применяется как простой и надежный способ проверки правильности предполагаемого строения молекулы. Для этого необходимо рассчитать по правилу аддитивности теоретическое значение рефракции для каждой возможной структуры и сравнить его с рефракцией данного вещества, найденной опытным путем. Для определения экспериментального значения RМ практически необходимо найти лишь величины n и r в уравнении (1.10). Совпадение значений RМ, полученных опытным и теоретическим путем свидетельствует о правильности предположенной структурной формулы соединения.
|
||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 446; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.011 с.) |

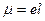 (1.1)
(1.1) (1.2)
(1.2)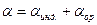 (1.3)
(1.3)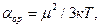 (1.4)
(1.4)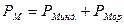 (1.5)
(1.5)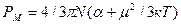 (1.6)
(1.6)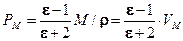 (1.7)
(1.7)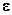 - диэлектрическая проницаемость, М – молярная масса вещества, r- его плотность, VM – молярный объем.
- диэлектрическая проницаемость, М – молярная масса вещества, r- его плотность, VM – молярный объем.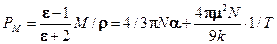 (1.8)
(1.8)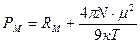 (1.9)
(1.9)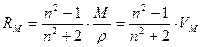 (1.10)
(1.10)


