
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторная работа №2. Определение парахора и структурной формулы вещества.
Цель работы: изучение метода определения структурной формулы вещества известного состава по значению поверхностного натяжения жидкости. Задания: 1) определить поверхностное натяжение исследуемой жидкости; 2) определить плотность исследуемого вещества (см. описание лабораторной работы №1); 3) рассчитать опытный парахор 4) записать возможные изомеры вещества известного состава; 5) рассчитать теоретический 6) сопоставлением Парахор Определение поверхностного натяжения. Для измерения поверхностного натяжения вещества пользуются методом наибольшего давления в газовом пузырьке, разработанным академиком П.А. Ребиндером. Работа по этому методу проводится на приборе, изображенном на рисунке 1.2.
Рис. 1.2
Сосудик А для исследуемой жидкости соединен с помощью боковой трубки В с водяным аспиратором С, создающим необходимое разрежение в системе, и манометром D. Сверху сосудик закрывается пришлифованной пробкой, через которую проходит трубка, заканчивающаяся капиллярным кончиком. Сосудик заполняют исследуемой жидкостью и помещают в термостат. Выпуская воду из аспиратора, добиваются такой разности между атмосферным давлением и давлением внутри сосудика, чтобы из капиллярного кончика через поверхность жидкости начали проскакивать пузырьки воздуха (1 - 2 в секунду). Капиллярный кончик должен иметь ровные края и быть отшлифован. Очистка капиллярного кончика производится хромовой смесью. Трубка с капиллярным кончиком устанавливается так, чтобы последний только касался поверхности жидкости. Глубже погружать кончик нельзя: в противном случае необходимо вводить поправку на гидростатическое давление слоя жидкости над погруженным кончиком. Скорость проскакивания пузырьков воздуха можно регулировать с помощью крана на аспираторе. Показания манометра D замечают в момент проскакивания пузырьков воздуха. Опыт повторяют с одной и той же жидкостью 2 - 3 раза и берут среднее показание манометра. Колебания отдельных измерений не должны превышать 1-2 мм. Между давлением P в момент проскакивания пузырьков, отмеченным по манометру, и поверхностным натяжением существует зависимость
где Так как значение
откуда
где Сначала производят измерения с дистиллированной водой, а затем с исследуемой жидкостью
По найденному поверхностному натяжению и плотности исследуемой жидкости рассчитывают опытное значение парахора
где Мx и ρx − молярная масса и плотность исследуемой жидкости. Изображают возможные структурные формулы исследуемого вещества известного состава и по правилу аддитивности рассчитывают теоретические значения парахора (
Значения парахоров инкрементов составляющих молекулу атомов и связей (Пат и Псвязей) находят в таблицах краткого справочника физико-химических величин. Сопоставляют теоретические и опытные значения П. Выбирают структурную формулу, для которой Полученные экспериментальные данные представляют в виде таблицы 1.2. Рассчитывают абсолютную и относительную погрешности определения. В случае удовлетворительно проведенных измерений расхождение между Записывают выводы по проделанной работе.
Таблица 1.2.
Термохимия Раздел химической термодинамики, который изучает тепловые эффекты химических реакций, теплоты фазовых переходов, теплоты растворения веществ, разбавления растворов и т.п., называется термохимией. Выделение или поглощение теплоты в результате химического превращения или физико-химического процесса есть следствие того, что суммарная энергия веществ в конце процесса отличается от суммарной энергии веществ в исходном состоянии. Экспериментально (калориметрически) измеряемая теплота химического превращения зависит от количеств реагентов и условий проведения опыта. Она называется тепловым эффектом реакции, если результаты измерений отнесены 1) к стехиометрическим количествам реагентов; 2) к постоянному давлению (Р) или постоянному объему (V); 3) к одинаковой температуре исходных веществ и продуктов реакции и 4) если во время реакции не совершается других видов (полезной) работы, кроме работы расширения. На основании I закона термодинамики:
где: DU и DН – изменение полной внутренней энергии и энтальпии системы QP и QV называют тепловым эффектом химической реакции. основным законом термохимии является закон Гесса. Закон Гесса устанавливает: если из данных исходных веществ можно получить заданные конечные вещества различными путями, то суммарная теплота на одном каком-нибудь пути равна суммарной теплоте процесса на любом другом пути, т.е. тепловой эффект химических реакций не зависит от пути перехода, а определяется только начальным и конечным состояниями системы. Закон Гесса незаменим для расчета тех тепловых эффектов, которые нельзя измерить калориметрически. Например, теплоту образования СО (DН) при реакции С + О2 вследствие течения реакции как с образованием СО, так и СО2 экспериментально определить невозможно. Однако с помощью закона Гесса с использованием легко определяемых калориметрически тепловых эффектов реакций DН, и DН2 он может быть рассчитан: С + О2 = СО2 + DН1 СО + 1/2О2 = СО2 + DН2 С + 1/2О2 = СО + DН DН1 = DН + DН2 по закону Гесса DН = DН1 - DН2 Закон Гесса применим и для определения тепловых эффектов, сопровождающих процессы растворения веществ, разбавления жидкостей. Он используется для расчета тепловых эффектов реакции по стандартным теплотам образования или сгорания веществ, расчета энергии химической связи. Тепловой эффект считают положительным для эндотермических DН>0 и отрицательным для экзотермических процессов. Тепловой эффект, сопровождающий процесс растворения вещества в жидкости называется теплотой растворения. Различают интегральную и дифференциальную теплоту растворения. Интегральной теплотой растворения называют тепловой эффект растворения 1 моля вещества в таком количестве растворителя, чтобы получился раствор концентрации Сm. Дифференциальной теплотой растворения – тепловой эффект растворения 1 моля вещества в бесконечно большом количестве раствора концентрации Сm. Дифференциальные теплоты определяются расчетным методом, а интегральные – экспериментально. Определение тепловых эффектов химических реакций и физико-химических процессов проводят в специальных приборах калориметрах. Следует различать два способа проведения калориметрического опыта. При одном из них температура пространства, окружающего калориметр, остается в течение всего опыта постоянной (калориметр с изотермической оболочкой). При другом – температура оболочки, окружающей калориметр, в течение опыта меняется так, чтобы в каждый момент времени она была равна температуре калориметра (калориметр с адиабатической оболочкой). Последний способ употребляется в том случае, если исследуемые процессы протекают очень медленно и возможна потеря части теплового эффекта процесса в результате теплообмена калориметра с окружающей средой.
Любой калориметрический опыт сводится к определению изменения температуры калориметрической жидкости в результате проходящего в ней химического или физико-химического процесса. Тепловые эффекты рассчитывают, используя экспериментальные данные и известные значения теплоемкости. Теплоемкостью называют количество теплоты, поглощаемой веществом при его нагревании на 1оС. Теплоемкости разделяют на удельную и молярную. Молярная теплоемкость – это количество теплоты, поглощаемой 1 моль вещества, при нагревании его на 1оС. Истинную теплоемкость определяют как количество теплоты, поглощаемое при бесконечно малом изменении температуры С = dQ/dТ. В эксперименте определяют среднюю теплоемкость с=DQ/DТ. Если процессы происходят при постоянном давлении или объеме, то DQР = - DН, а DQV = - DU. Тогда:
С использованием калориметрических данных и формул (2.3-2.6) рассчитывают значения теплоемкостей и тепловые эффекты химических и физико-химических процессов.
Лабораторная работа №3. Определение интегральной теплоты растворения соли (безводной и кристаллогидрата) и расчет теплоты гидратации Цель работы: Освоение методики калориметрических измерений и определение теплоты гидратации соли. Задание: 1. Определить теплоемкость калориметрической системы. 2. Определить интегральные теплоты растворения безводной соли и кристаллогидрата в воде. 3. Рассчитать теплоту гидратации на основании полученных тепловых эффектов (по закону Гесса).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 645; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.181.231 (0.027 с.) |
 ;
; парахор для всех возможных структурных формул данного эмпирического состава;
парахор для всех возможных структурных формул данного эмпирического состава;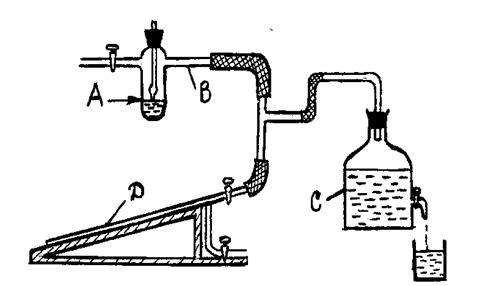
 , (1.16)
, (1.16) – постоянная прибора.
– постоянная прибора. неизвестно и которое необходимо определить, в качестве второй – воду, поверхностное натяжение которой известно (
неизвестно и которое необходимо определить, в качестве второй – воду, поверхностное натяжение которой известно ( ). Тогда
). Тогда ,
, 
 ,
, – показания манометра при работе с водой, мм;
– показания манометра при работе с водой, мм;  – показания манометра при работе с исследуемой жидкостью, мм.
– показания манометра при работе с исследуемой жидкостью, мм. (1.17)
(1.17) , (1.18)
, (1.18) (1.19)
(1.19) ,
Н/м
,
Н/м
 ,
Н/м
,
Н/м
 (2.1)
(2.1)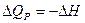 (2.2)
(2.2)






