
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення біологічно активних речовин гранатаСодержание книги Поиск на нашем сайте КУРСОВА РОБОТА
ВИЗНАЧЕННЯ БІОЛОГІЧНО АКТИВНИХ РЕЧОВИН ГРАНАТА
Виконала студентка 42 групи хімічного факультету спеціальність”хімія” Антоній Вячеслав Олекчійович
Науковий керівник: доц., к. б.н. Осип Юрій Леонідович
Луцьк - 2013
Реферат Проведено дослідження жирнокислотного складу олії насіння граната методом газорідинної хроматографії. Визначено вміст вищих карбонових кислот у оліях насіння граната. Встановлено фізико-хімічні параметри досліджуваної олії. Встановлено вітамінний склад шкірки граната і соку.
ABSTRACT The investigation of fatty acid composition of granatum oil seeds method gas-liquid chromatography. Detected of higher contents of carboxylic acids in seed oils of granatum. Is established physico-chemical parameters of the investigated oil. Is established vitamin warehouse granatum the skin and juice.
ЗМІСТ СПИСОК УМОВНИХ ПОЗНАЧЕЕНЬ І СКОРОЧЕНЬ 5 ВСТУП 6 Розділ I. Літературний огляд 8 1.1. Загальна характеристика гранату (granatus) 8 1.2. Біологічно активні речовини 10 1.2.1. Вітаміни 11 1.2.2. Флавоноїди 16 1.2.3. Алкалоїди 18 1.3. Ліпіди 18 Розділ II. Обґрунтування напрямку дослідження 20 1. 2.1. Роль біологічно активно речовин в процесі життєдіяльності людини20 Розділ III. Методи дослідження 21 3. 3.1. Виділення олії методом екстрагування органічним розчинником 21 3.2. Визначення фізико - хімічних показників олії 22 3.2.1. Визначення кислотного числа 23 3.2.2. Визначення числа омилення 23 3.2.3. Визначення ефірного числа 24 3.2.4. Визначення йодного числа 24 3.2.5. Визначення пероксидного числа 25 3.2.6. Визначення показника заломлення олії 26 3.2.7. Визначення густини олії 26 3.3. Дослідження жирнокислотного складу рослинних олій методом газової хроматографії 27 3.4. Якісне визначення вітамінів 28 3.4.1. Вітамін А (Ретинол) 28 3.4.2. Вітамін D (Кальциферол) 29 3.4.3. Вітамін Е (Токофенол) 29 3.4.4. Вітамін К (Філохінон) 29 3.4.5. Вітамін В1 (Тіанін) 30 3.4.6. Вітамін В2 (Рибофлавін) 30 3.4.7. Вітамін В6 (Піродиксин) 31 3.4.8. Вітамін Р (Рутин) 31 3.4.9. Вітамін С (Аскорбінова кислота) 31 3.4.10. Вітамін РР (Вітамін В5, Нікотинамід) 32 Розділ IV. Експериментальна частина 32 1. 2. 3. 1. 2. 3. 4. 4.1. Отримання дослідних олій 32 4.2. Дослідження жирокислотного складу олій з насіння граната 33 4.2.1. Пробопідготовка олії 33 4.2.2. Хроматографічне визначення 33 4.3. Визначення фізико-хімічних показників олії 33 4.3.1. Визначення густини олії 33 4.3.2. Визначення показника заломлення олії 34 4.3.3. Визначення числа омилення олії 34 4.3.4. Визначення кислотного числа олії 34 4.3.5. Визначення естерного числа олії 35 4.3.6. Визначення йодного числа олії 35 4.3.7. Визначення пероксидного числа олії 35 4.4. Визначення вітамінного складу 36 РОЗДІЛ V. ОБГОВОРЕННЯ РЕЗУЛЬТАТІВ ДОСЛІДЖЕННЯ 36 1. 2. 3. 4. 5. 5.1. Визначення фізико-хімічних характеристик олії граната 36 5.2. Визначення жирнокислотного складу олій методом газорідинної хроматографії 37 5.3. Визначення вітамінного складу шкірки і соку граната 37 ВИСНОВКИ 38 СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ 39
СПИСОК УМОВНИХ ПОЗНАЧЕНЬ І СКОРОЧЕНЬ
Д.р. – дубильні речовини А. - алколоїди ЖК – жирні кислоти мл – мілілітр г – грам хв - хвилин мм – міліметр кг – кілограм см – сантиметр мг – міліграм мкг – мікрограм Ккал – кілокалорій Ф. – флавоноїд БАР – біологічно активні речовини Тпл. – температура плавлення р. - рік мол.м. – молекулярна маса Напр. – наприклад атм. – атмосфер С – градуси цельсія мкл. – мікролітр нм. – нанометр ЛЖК – леткі жирні кислоти
Вступ Вітаміни, група незамінних для організму людини і тваринних органічних сполук, що володіє дуже високою біологічною активністю, присутніх у в нікчемних кількостях в продуктах живлення, але що мають величезне значення для нормального обміну речовин і життєдіяльності. Основна їх кількість поступає в організм з їжею, і тільки деякі синтезуються в кишечнику мешкаючи ми в йому корисними мікроорганізмами, однак і у цьому разі їх буває не завжди досить. Сучасна наукова інформація свідчить про виключно різноманітну участь вітамінів в процесі забезпечення життєдіяльності людського організму. Одні з них є обов'язковими компонентами ферментних систем і гормонів, регулюючих численні етапи обміну речовин в організмі, інші є початковим матеріалом для синтезу тканинних гормонів. Вітаміни у великій мірі забезпечують нормальне функціонування нервової системи, м'язів і інших органів і багатьох фізіологічних систем. Від рівня вітамінної забезпеченості живлення залежить рівень розумової і фізичної працездатності, витривалості і стійкості організму до впливу несприятливих чинників зовнішньої середи, включаючи інфекції і дії токсинів. У харчових продуктах можуть містяться не тільки самі вітаміни, але і речовини-попередники провітаміни, які тільки після ряду перетворень в організмі стають вітамінами. Порушення нормальної течії життєво важливих процесів в організмі через тривалу відсутність в раціоні того або іншого вітаміну приводять до виникнення важких захворювань, відомих під загальною назвою авітаміноз. У теперішні час такі ситуації практично не зустрічаються. У рідких випадках авітаміноз можливі в слідстві захворювань, результатом яких є припинення всмоктування вітаміну або його посилене руйнування в шлунково-кишковому тракті. Для авітаміноз характерна виражена клінічна картина зі суворо специфічними ознаками. Досить поширеним явищем залишається часткова вітамінна недостатність в тій або іншій мірі виражена гіповітамінозом. Вони протікають більш легко, їх вияви нечіткі, менш виражені, до того ж існують і приховані форми такого стану, коли гіршає самопочуття і знижується працездатність без яких-небудь характерних симптомів. Поширеність явно виражених гіповітамінозних станів і їх прихованих форм зумовлена багатьма причинами, але частіше всім-орієнтацією індивідуального живлення виключно на задоволення смакових запитів без урахування конкретної значущості вітамінів для здоров'я, потреб в них організму і вмісту їх в продуктах живлення, не кажучи вже про наслідок використання тих або інших прийомів кулінарної обробки, здатних руйнувати вітаміни. Потрібно також враховувати, що гіповітамінозні стани можуть виникнути при тривалому або неправильному прийомі антибіотиків, сульфаніламідів і інших медичних коштів, які придушують діяльність корисної мікрофлора кишечника, що синтезує істотні кількості деяких вітамінів, або безпосередньо зв'язуючих і що руйнують вітаміни. Причиною гіповітамінозів може бути і підвищена потреба у вітамінах при посиленій фізичній і розумовій роботі, при впливі на організм несприятливих чинників. Такими можуть бути переохолодження, перегрівання, стресові ситуації і т.п. Аналогічно їх причиною можуть бути і фізіологічні стани, що пред'являють до організму підвищені вимоги, наприклад, вагітність і годування дитини. Прийом вітамінів потрібно провести відповідно суворому до рекомендацій або під контролем медичних працівників. Надмірне споживання харчових продуктів, надзвичайно багатих вітамінами, або самостійний зайвий прийом вітамінних препаратів можуть привести до гіпервітамінозів [1].
РОЗДІЛ I ЛІТЕРАТУРНИЙ ОГЛЯД Біологічно активні речовини Біологічно активні речовини(БАР)(грец. bios — життя, що означає зв’язок із життєвими процесами і відповідає слову «біол.» + лат. аctivus — активний, тобто речовина, яка має біологічну активність). Зміст словосполучення може суттєво змінюватися залежно від сфери застосування. В науковому значенні (нейрофізіологічному, психічному, хімічному процесах) — підвищення активності життєвих процесів організму. Іншими словами, біологічна дія — це біохімічні, фізіологічні, генетичні та інші зміни, що відбуваються у живих клітинах та організмі в результаті дії БАР. Отже, БАР — це сполука, яка внаслідок своїх фізико-хімічних властивостей має певну специфічну активність і виконує або впливає, змінює каталітичну (ферменти, вітаміни, коферменти), енергетичну (вуглеводи, ліпіди), пластичну (вуглеводи, ліпіди, білки), регуляторну (гормони, пептиди) або іншу функцію в організмі. Взагалі повністю індиферентних речовин у природі нема. Всі речовини виконують якісь функції в організмі людини, тварин, рослин або використовуються для досягнення певних ефектів. Напр. вода, пов’язана з метаболічними функціями живої клітини, є активним учасником транспортування поживних речовин та продуктів обміну в організмі, субстрактом низки ферментативних реакцій [4]. З метою класифікації усі БАР поділяють на ендогенні та екзогенні. До ендогенних речовин відносять хімічні елементи (кисень, водень, калій, фосфор та ін.), низькомолекулярні (глюкоза, АТФ, етанол, адреналін та ін.) і ВМС (ДНК, РНК, білки). Вони входять до складу організму, беруть участь у обмінних процесах речовин і мають виражену біологічну (фізіологічну) активність. Екзогенними вважають БАР, що надходять до організму різними шляхами. З урахуванням взаємодії з організмом БАР поділяють на біоінертні, які не засвоюються організмом (целюлоза, геміцелюлоза, лігнін, кремнійорганічні полімери, полікарбонат та ін.); біосумісні, які повільно розчиняються або ферментуються в організмі (полісахариди, полівінілпіролідон, поліакриламіди, полівініловий спирт, поліетиленоксиди, водорозчинні ефіри целюлози та ін.); біонесумісні, які викликають ураження тканини організму (поліантрацени, деякі поліаміди та багато ін.); біоактивні спрямованої дії (вінілін, полімери у пєднанні з лікарськими речовинами). Біоінертні та біосумісні речовини широко використовуються у виробництві ліків як допоміжні речовини, а також для отримання тари, пакувальних і конструкційних матеріалів тощо. Залежно від ступеня токсичності БАР поділяють на звичайні речовини, сильнодіючі та отруйні. Прояв токсичності залежить від концентрації (дози) БАР, шляхів надходження до організму, чутливості останнього, поведінки БАР в організмі та інших чинників (напр. отруйні речовини використовуються як ліки в певних дозах). Можливі інші підходи до класифікації БАР, напр. залежно від природи (рослинного або тваринного походження), мол. м., розміру часток, стійкості до температури, можливості накопичуватися в організмі, виявляти наркотичні та інші властивості [5].
Вітаміни Вітаміни – біоорганічні сполуки, що є життєво необхідними компонентами обміну речовин. Участь вітамінів в обміні речовин обумовлена в значній мірі тим, що багато з них є коферментами або їх складовою частиною. Більшість вітамінів в організмі не синтезується. Джерелом їх зазвичай є харчові продукти. В тканинах організму синтезуються лише вітамін D3 (в шкірі при дії ультрафіолетового проміння) і нікотинамід (із триптофану). Крім цього, ряд вітамінів (вітамін К та ін.) утворюється мікроорганізмами в товстому кишечнику. На відміну від вуглеводів, ліпідів та білків, вітаміни належать до мікрокомпонентів харчування, їх добові потреби для людей складають міліграмові або мікрограмові кількості. В деяких випадках може розвинутись недостатність вітамінів (гіповітаміноз, авітаміноз). Найчастіше причиною недостатності є низький вміст вітамінів в їжі. Крім цього, при патологічних змінах в травному тракті може бути порушене всмоктування вітамінів. В ряді випадків гіповітаміноз виникає в результаті завищеної потреби організму в вітамінах (напр., при вагітності, тиреотоксикозі, лихоманці). Нестачу вітамінів можна компенсувати шляхом дотримання дієти з відповідним вмістом овочів, фруктів, продуктів тваринного походження. Це самий надійний спосіб лікування гіповітамінозу. Однак дозування вітамінів при цьому важко визначити. Але цей спосіб є малоефективний у випадку, коли порушене всмоктування вітамінів. Відкриття вітамінів пов`язано з розробками багатьох дослідників – лікарів, біохіміків, фізіологів, які встановили наявність певних сполук, що необхідні для нормальної життєдіяльності – “додаткових факторів харчування”. Специфічні хвороби, пов’язані з порушеннями в харчуванні цинга (скорбут), бері-бері, пелагра, рахіт (“англійська хвороба”), гемералопія (“куряча сліпота”) були відомі людству протягом століть. Першим вітаміном, щодо якого було доведено значення як необхідного фактора харчування, був тіамін (вітамін В1), отриманий у 1911р. польським біохіміком К.Функом з рисових висівок. Сполука виділена К.Функом, попереджала розвиток бері-бері (поліневриту, спричиненого тривалим споживанням полірованого рису) і містила в своїй структурі аміногрупу, що стало основою запропонованого для всіх додаткових факторів харчування терміна “вітаміни” (vitaminum – амін життя; лат.). Враховуючи, що відкриття перших препаратів вітамінів значно передувало розшифровці їх хімічної структури, історично склалися емпіричні назви (номенклатура) вітамінів, що містять велику літеру латинського алфавіту з цифровим індексом; у сучасних назвах вітамінів вказують також їх хімічну природу та, в деяких випадках, - основний біологічний ефект з префіксом “анти-” [6]. Залежно від фізико-хімічних властивостей (розчинності у воді або в ліпідах) вітаміни поділяють на дві великі групи: водорозчинні та жиророзчинні. Водорозчинні вітаміни Алкалоїди Алколоїди (лат. Alkali — луг + oides — подібний, тобто подібні до лугу) –велика група вторинних рослинних речовин, які містять один чи більше атомів азоту, частіше у складі гетероциклічного кільця, мають лужні властивості, більшість з них чинить виражену фармакологічну дію на організм людини і тварин. А. не є гомологічною групою речовин і розрізняються за хімічними, біохімічними і фармакологічними властивостями. Крім С, Н, О і N молекули А. містять атоми S, рідше Cl чи Br. А. зазвичай надають назви рослин, з яких їх виділяють. Назва А. може бути: за родовою назвою рослини (атропін — Atropa); за видовою назвою рослини (кокаїн — Erytroxylon coca); за фізіологічною активністю (морфін — від назви бога сну Морфея); за назвою рослинної сировини (ерготамін — від назви ріжок (рос. назва: спорынья) ergot); або називають ім’ям першовідкривача Пелетьє (пелетьєрин). Іноді до назви А. додають префікс чи суфікс, щоб позначити інший А. з цього ж рослинного джерела, проте відповідно до хімічної номенклатури назва А. має закінчуватися на суфікс – ін [8]. Найбільш прийнятна класифікація А., що базується на будові вуглецево-азотного скелета молекули, напр.: ізохінолінові А., тропанові, індольні, хінолінові, пуринові, імідазольні, піридинові, піперидинові, хінолінові, піролідинові. Класифікують також за філогенетичними ознаками, поєднуючи в одну групу всі сполуки, виділені з рослин однієї родини чи роду, напр.: А. аконіту, А. дурману, А. іпекакуани, А. родини макових. За біогенетичними попередниками (прекурсорами) можна групувати А., розрізняючи групи А., у біосинтезі яких беруть участь амінокислоти орнітин, лізин, пролін, фенілаланін, триптофан, антранілова кислота і гістидин. З точки зору біосинтезу А. розподіляють на 3 групи: А. або справжні А. — мають гетероцикли і біосинтетично походять з А. амінокислот, або з кислот нікотинової чи антранілової; протоалкалоїди (біогенні аміни) — містять азот поза циклом, але утворюються з амінокислот; псевдоалкалоїди (ізопреноїдні А.) — утворюються без участі амінокислоти, але за участю мевалонової кислоти і об’єднуються в групу незалежно від наявності гетероциклу, тобто вони мають терпеноїдне походження. Біохімічна класифікація А. не завжди дозволяє однозначно віднести той чи інший А., особливо складної структури, до певної групи. Можна системазувати А. за фармакологічним принципом, згрупувавши речовини з однотипною активністю. Напр. А.з протикашльовою дією — кодеїн, глауцин та ін.; А., що чинять спазмолітичний ефект — папаверин, атропін, платифілін та ін [9]. Зазвичай рослини містять суміш декількох, іноді до 15 або 20 А., які близькі за своєю будовою, напр. мак снодійний, хінне дерево. Однак деякі рослини містять тільки один А., напр. рицинін у рицині. Багато А., особливо складної будови, специфічні для певних родів і навіть родин, що широко використовуються у систематиці (хемотаксономія). Часто А. містяться у рослині у вигляді солей органічних та неорганічних кислот. Локалізацію А. виявляють переважно у певних частинах (органах) рослин, напр. у хінному дереві — кора, в аконіті — бульби, у кокаїновому кущі — листя, у болиголова — плоди, у фізостигмі — насіння. Вміст А. у тканинах зазвичай становить десяті або соті частки відсотка і рідко доходить до 10–15% (кора хінного дерева, лист тютюну). Значний вплив на накопичення А. у рослинах має географічне розповсюдження та різні фактори: температура повітря і ґрунту, кількість опадів, тривалість та інтенсивність сонячного дня, затемнення, висота над рівнем моря тощо, а також вплив людини у разі культивування та акліматизації. А., які виявляють у тварин, не завжди синтезуються самим організмом, іноді їх походження пов’язане з характером їжі. Так, бобри, вживаючи в їжу кореневища латаття жовтого (рос. назва: кувшинка желтая), накопичують А. касторамін, дуже близький до А. нуфаридину [6].
Флавоноїди
Флавоноїди - група БАР поліфенольного характеру з загальною формулою С6–С3–С6. Назва походить від лат. flavus — жовтий, оскільки перші виділені Ф. кверцитрин (з кори дуба), рутин (з рути та гречки), робінін (з акації) мали жовте забарвлення. Молекула Ф. складається з двох фенільних залишків (кільця А і В), з’єднаних пропановою ланкою. Ці кільця можна розглядати як похідні фенілпропаноїдів. Ф. рідко зустрічаються у вільному стані: пилок квіток містить кверцетин; у корі дерев містяться катехіни, лейкоантоціанідини. Більшість Ф. представлені глікозидами. Частота і перевага заміщення будь-якого положення залежить від структури аглікону. Так, напр., у флавонів заміщення відбувається в положенні С-7, рідше — у С-3 ′, С-4 ′; у С-глікозидів — у С-6, С-8. У флавонолів зазвичай заміщення відбувається в положенні С-3 або С-7. Цукрові залишки представлені D-глюкозою, D-галактозою, D-ксилозою, L-рамнозою, L-арабінозою, D-глюкуроновою та D‑галактуроновою кислотами. Здебільшого у Ф. глікозидах цукрові залишки зв’язані з агліконами напівацетальним зв’язком через атом кисню. О-глікозиди залежно від кількості та положення цукрових залишків можуть бути монозидами, біозидами, диглікозидами, тріозидами. Цукровий ланцюг може бути лінійним або розгалуженим [10]. Ліпіди
Ліпіди (грец. lipos — жир) — великагрупа природних гідрофобних сполук, неоднорідних за хімічним складом та біологічними функціями, які об’єднують за такими критеріями: 1) обмежена розчинність у воді та полярних розчинниках і, навпаки, хороша розчинність у неполярних розчинниках; 2) знаходження в природі у вигляді складних ефірів вищих жирних кислот; 3) наявність в усіх живих організмах. Деякі Л. (жири тваринні, рослинні) використовують здавна як продукти харчування, для виготовлення ліків і косметики, а також для освітлення приміщень. З початку XVIII ст. Л. стали використовувати для миловаріння, а з XX ст. — для виробництва мийних засобів, емульгаторів, детергентів, пластифікаторів і технологічних мастил. Л. класифікують: 1) за функціями, які вони виконують в організмі, виділяють Л. запасні та мембранні (фосфоліпіди та гліколіпіди); 2) за фізичними властивостями — нейтральні (неполярні) та полярні; 3) за хімічними властивостями — Л., які омилюються лугами (жири, віск, складні Л.), та неомилювані ліпофільні речовини [11]. Сучасна класифікація поділяє Л. на прості та складні, окремі групи становлять похідні Л. і різні Л. Прості Л. — це ефіри жирних кислот із різноманітними спиртами. До них належать жири, або ацилгліцероли (ефіри жирних кислот і гліцеролу), воски, а також ефіри холестеролу і вищих жирних кислот. Складні Л. — це ефіри жирних кислот і спиртів, гідроксильні групи яких містять інші замісники. До цієї групи належать фосфоліпіди, гліколіпіди, сфінголіпіди, ліпопротеїди, ліпополісахариди. Похідні Л.— сполуки, які утворюються внаслідок гідролізу складних Л., тобто вищі жирні кислоти, моно- та діацилгліцероли, гліцерол, стерини, жирні альдегіди, ліпідна частина ліпопротеїдів. До групи різних Л. належать аліфатичні вуглеводні, сквален, інші терпени, вітаміни Е, К, ефіри гліцеролу, глікозилгліцероли тощо. Іноді сполуки, подібні до Л. за фізико-хімічними властивостями, називають ліпоїдами (фосфоліпіди, воски, стероїди, у т.ч. холестерол та його ефіри, біологічно активні гормони і жовчні кислоти). Усі Л. умовно можна поділити на неполярні (нейтральні) та полярні; Л., що омилюються лугами (жири, воски, складні Л.), і неомилювані (ізопреноїди, каротиноїди, простагландини тощо). За ліпофільними властивостями до Л. іноді зараховують терпеноїди, стероїди, каротиноїди, а також хлорофіл. Певною мірою віднесення цих сполук до Л. виправдано, оскільки всі вони в живих організмах знаходяться разом із Л. і разом екстрагуються органічними розчинниками [12].
Визначення кислотного числа
Кислотне число – це кількість мг гідроксиду калію, необхідна для нейтралізації вільних жирних кислот в 1 г жиру. Кислотне число характеризує якість жиру. Так, у жирі, виготовленому з дозрілого насіння, вільних жирних кислот мало, а у жирі з недозрілого насіння – багато. При зберіганні жиру спостерігається накопичення вільних жирних кислот, тобто зростає кислотність. Підвищення кислотності вказує на зниження якості жиру. Принцип методу полягає в тому, що вільні жирні кислоти, які містяться в жирі, відтитровують 0,1 н. розчином гідроксиду калію. Титрування доцільно проводити гідроксидом калію, а не гідроксидом натрію, оскільки утворені калієві мила краще розчиняються в умовах досліду. Хід роботи. До 1г жиру додають 5мг спирту нейтралізованого фенолфталеїном, добре перемішеють до максимального розчинення вільних жирни кислот і титрують розчином KOH до появи рожевого забарвлення(забарвлення не повинно зникати протягом 0,5 – 1 хв.). Кількість KOH, мг, витрачену на титрування вільних жирних кислот, що містяться в 1г жиру, визначають за формолою: КЧ=AQ/a де А – об’єм розчину KOH (0,1 моль/л), витрачений на титрування досліджуваної проби, мл; а – наважка жиру, г; Q – кількість KOH (5,61 мг), еквівалентна 1мг розчину KOH (0,1 моль/л).
Визначення числа омилення Число омилення — кількість міліграмів їдкого калі КОН, необхідна для нейтралізації вільних і зв'язаних з гліцерином жирних кислот, одержаних при омиленні 1 г жиру. Хід роботи. В одну колбу (досліджувану пробу) поміщають 0,5г жиру, в другу (контрольну пробу) – 0,5мл води. В обидві колби доливають по 15мл спиртового розчину KOH і кип’ятять із зворотнім холодильником на водяній бані протягом 50 хв до повного омилення гліцеридів і нейтралізації вільних жирних кислот. Потім у обидві колби додають по 10 краплин розчину фенолфталеїну та титрують прозчином HCl до зникнення рожевого забарвлення (до нейтральної реакції). Кількість KOH у мг, витрачена на нейтралізацію всіх жирних кислот, що містяться 1г жиру, визначають за формолою: ЧО=(В-А)fQ/a де (В-А) – різниця результатів титрування контрольного та досліджуваного зразків розчином соляної кислоти (0,5 моль/л), мл; а – наважка досліджуваного жиру, г; Q – кількість KOH (28 мг), яка еквівалентна 1 мл розчину KOH (0,5 моль/л).
Визначення ефірного числа Це число визначать за різнацею між ЧО жиру та його КЧ ЕЧ=ЧО-КЧ
Визначення йодного числа Йодне число – кількість грамів йоду, потрібного для насичення ненасичених жирних кислот, що містяться в 100 г жиру. Дає уявлення про ступінь ненасиченості жиру, про здатність до висихання, прогіркання та інших зміни, що відбуваються при зберіганні та переробці жирів. Чим більше у жирі ненасичених жирних кислот, тим вище йодне число. Зменшення йодного числа є показником псування жиру. Принцип методу полягає в тому, що ненасичені жирні кислоти приєднують галогени за місцем подвійних зв’язків.
Хід роботи. В одну колбу (досліджувана проба) вносять наважку 0,1 – 0,2 г, у другу (контрольна проба) – 0,1 – 0,2 мл води, по 10 мл спиртового розчину йоду, перемішують і залишають на 15 хв. Далі вміст колб титрують розчином Na2S2O3 до появи жовтуватого забарвлення. Потім, додавши 1 мл розчину крохмалю, суміш титрують до зникнення синього забарвлення. Йодне число визначають за формолою: де (В-А) – різниця резудбтатів титрування контрольного та досліджуваного зразків у розчині Na2S2O3 (0,05 моль/л), мл; а – наважка розвину жиру, г; f – коефіцієнт поправки на титр розчину Na2S2O3 (0,05 моль/л); Q – кількість J2 (12,69 мг), еквівалент на 1 мг розчину Na2S2O3(0,05 моль/л).
Визначення густини олії Величина густини залежить від температури. Відносну густину зазвичай визначають за водою, густина якої при 4°С майже дорівнює одиниці (0,99997г/см3). Визначення густини проводять у пікнометрів ємності 1– 2 мл. Чистий та сухий пікнометр зважують на аналітичних вагах при кімнатній температурі. Потім визначають «водне число пікнометра», що є постійним для кожного пікнометра і відповідає масі води в об’ємі пікнометра при 20°С, приведеної до маси води при 4°С, mH2O(20°C)/ mH2O(4°C)=0,99823/1 x(mH2O(4°C))= mH2O(20°C)/0,99823, де 0,99823 г/см3 густина води при 20°С. Отримана величина m Н2О (4°С) або х є «водним числом» або «водною константою» пікнометра. Для визначення густини досліджуваної рідини зважують сухий, чистий пікнометр і порівнюють його масу з масою, визначеною при визначенні «водної константи». Потім пікнометр заповнюють досліджуваною рідиною та проводять аналогічні вимірювання, як для води. Відношення маси речовини в об’ємі даного пікнометра до величини «водної константи» відповідає густині даної речовини: d420 =m-mn /B В – «водна константа» пікнометра; М – маса пікнометра з досліджуваною речовиною; mn – маса пікнометра порожнього. За результат аналізу приймають середнє арифмитичне трьох паралельних [15]. Якісне визначення вітамінів Вітамін А (Ретинол)
1. Реакція на вітамін А з ферум хлоридом В суху пробірку вносять 0,5 мл досліджуваного розчину та додають 0,5 мл розчину форум (ІІІ) хлориду. При наявності вітаміну А суміш забарвлюється в жовто – зелений колір. 2. Реакція на вітамін А з концентрованою сульфатною кислотою В суху пробірку вносять 0,5 мл досліджуваного розчину та додають 0,5 мл концентрованої сульфатно кислоти. У випадку наявності у пробі вітаміну А спостерігається утворення червоно – фіолетового або червоно – бурого кольору.
Вітамін D (Кальциферол) 1. Бромхлороформна проба на вітамін D. Проба, що містить вітамін D забарвлюється в зелено – голубий колір при додаванні розчину брому в хлороформі. 2. Анілінова проба на вітамін D. В сухій пробірці змішують 5 мл анілінового реактиву (15 частин + 1 частина концентрованой соляної кислоти). Вміст проби обережно при постійному перемішуванні нагрівають до кип’ятіння і кип’ятять 30 секунд. У присутності вітаміна D з’являється спочатку грязно – зелене забарвлення, а потім буро – червоне або червоне забарвлення.
Вітамін Е (Токофенол) Реакція з нітратною кислотою Взаємодія α – токоферолу з концентрованою нітратною кислотою забарвлює реакційну суміш в червоний колір. Це зумовлено тим, що продукт окиснення α – токоферолу має хіноїдну структуру. В суху пробірку вносять 5 крапель спиртового розчину вітаміну Е і додають 1 мл концентрованої HNO3. Пробірку інтенсивно струшують. При наявності у пробі токоферолу спостерігається поступове забарвлення суміші в червоний колір.
Вітамін К (Філохінон) Якісна реакція на метінон В пробірці змішують 0,5 мл спиртового досліджуваного розчину ті кілька крапель аналіна. При наявності метінона суміш забарвлюється в червоний колір. Якісна реакція на вікасол В пробірці змішують 0,5 мл спиртового досліджуваного розчину з розчином цистеїна.Додають кілька крапель 10%-го розчину NaOH. При наявності вікасола суміш забарвлюється в жовто – оранжевий колір.
3.4.5. Вітамін В1 (Тіанін)
Реакція окиснення вітаміна В1 в тіохром Вітамін В1 під дією K3[Fe(CN)6] окислюється до тіохрома – пігмента жовтого кольору. 0,5 мл проби змішують в пробірці з 1 мл 10%- го розчину натрій гідроксид та додають 0,5 мл 5%-го розчину K3[Fe(CN)6]. При нагріванні суміш забарвлюється в жовтий колір у результаті окислення тіаміну в тіохром. Осадження вітаміну В1 у вигляді срібної солі. В пробірку наливають 1 мл проби та додають краплями розчин арґентум(Ш) нітрату до появи осаду. 3.4.6. Вітамін В2 (Рибофлавін) Реакція відновлення вітамінв В2 Водень, що утворюється при додаванні металічного цинка до концентрованої хлоридної кислоти, відновлює рибофлавін, через проміжну сполуку червоного кольору (родофлавін), в безбарвний лейкофлавін. При цьому жовте забарвлення переходить а рожеве, хгодом розчин знебарвлюється. У пробірку наливають 1 мл водного розчину проби, додають концентровану хлоридну кислоту та шматок цинку. Водень, що виділяється, реагує з рибофлавіном, розчин міняє забарвлення з жовтого на червоне та рожеве, а згодом знебарвлюється.
3.4.7. Вітамін В6 (Піродиксин) Ферихлоридна проба на вітамін В6 Безбарвний розчин вітаміна В6 набуває червоного забарвлення у присутності ферум хлориду. Реакція зумовлена утворенням комплексної солі червоного кольору типу фенолята заліза. В пробірці змішують 0,5 мл водного досліджуваного розчину та кілька крапель 5%- го розчину ферум хлориду. У присутності вітаміна В6 суміш забарвлюється в червоний колір.
Вітамін Р (Рутин) Якісна реакція на рутин Мотод базується на взаємодії рутина с ферум(ІІІ) хлоридом з утворенням комплексної сполуки зеленого кольору. Наважку досліджуваного об’єкта (100 мг) кип’ятять протягом2 хвилин в 15 мл дистильованої води. Дають вистигнути, відбирають в пробірку 1 мл рідини та додають кілька кристаликів ферум(ІІІ) хлориду. Перемішують і розводять в 2 – 3 рази дистильованою водою. Спостерігають появу забарвлення.
3.4.9. Вітамін С (Аскорбінова кислота) Відновлення K3[Fe(CN)6] вітаміном С Метод базується на тому, що аскорбінова кислота відновлює K3[Fe(CN)6] до K4[Fe(CN)6]. Останній утворює з ферум(ІІІ) хлоридом важкорозчинну сіль ферум(ІІІ) – берлінську блакить, що випадає у вигляді темно – синього осаду. У кожну з двох пробірок вносять по 2-3 краплі 5%-го розчину K3[Fe(CN)6] та 1%-го розчину FeCl3, перемішують. Рідина набуває бурого забарвлення. Далі у першу пробірку додають 5 10 крапель водної витяжки з природного об’єкта, а в іншу – таку ж кількість дистильованої води. Якщо досліджуваний об’єкт містить аскорбінову кислоту, то рідина в першій пробірці забарвлюється в зеленувато – синій колір, і згодом випадає темно – синій осад берлінської блакиті. Йодоформна проба на вітамін С При додавання водної витяжки, що містить вітамін С, до розчину йоду в KI спостерігається знебарвлення суміші за рахунок відновлення молекуля додають рного йоду аскорбіновою кислотою з утворенням HI. У дві пробірки наливають по 10 крапель дистильованої води та по 1-2 краплі0,1%-го розчину йоду в 0,2%-му розчині KI. В одну додають пробу у другу дистильовану воду.
3.4.10. Вітамін РР (Вітамін В5, Нікотинамід) Проба з міддю на нікотинову кислоту Нікотинова кислота при нагріванні з розчином купрум(ІІ) ацетату утворює синій осад малорозчинної мідної солі (купрум нікотинат). До мг розтертого природнього об’єкта додають 20 крапель 10%-го розчину оцтової кислоти та нагрівають до кипіння. До нагрітого розчину додають рівний об’єм 5%-го розчину купрум(ІІ) ацетату. При поступовому охолодженні вмісту пробірки випадає осад мідної солі нікотинової кислоти синього кольору.
Отримання дослідних олій Для екстрагування ми використовували апарат Сокслета. Як сировину використовували насіння гранату. Масова частка з насіння граната Мс=32% Маса олії з насінням граната m=15,5 г
Пробопідготовка олії Підготовленні проби рослинних олій досліджували на газовому хроматографі. Хроматографічне визначення
Якісний і кількісний склад олії з насіння граната методом газорідинної хроматографії. Узагальнена хроматограма.
Хроматограма дослідження жирнокислотного складу олії насіння граната.
Визначення густини олії Густина олії з насіння граната d420=0,5324 г/см3.
ВИСНОВКИ 1. Методом екстракції гексаном отримали олії з насіння гранату. Вихід олій становить 32%; 2. Визначено фізико-хімічні параметри, а саме: густина, показник заломлення, число омилення, кислотне, пероксидне, ефірне та йодне числа; 3. Методом газорідинної хроматографії встановлено, що олія з насіння гранату містить пальмітинової кислоти – 3,991%, стеаринової кислоти – 2,636%, олеїнової кислоти – 6,773%, лінолевої кислоти – 5,223%, ліноленової кислоти – 0,616%, гранатовой кислоти – 80,761%. 4. Визначено наявність і сокові гранату таки вітаміни: Вітамін А, Вітамін Е, Вітамін К, Вітамін В2, Вітамін В6, Вітамін РР, Вітамін С; а в шкірці граната: Вітамін Е, Вітамін К, Вітамін В1.
КУРСОВА РОБОТА
ВИЗНАЧЕННЯ БІОЛОГІЧНО АКТИВНИХ РЕЧОВИН ГРАНАТА
Виконала студентка 42 групи хімічного факультету спеціальність”хімія” Антоній Вячеслав Олекчійович
Науковий керівник: доц., к. б.н. Осип Юрій Леонідович
Луцьк - 2013
Реферат Проведено дослідження жирнокислотного складу олії насіння граната методом газорідинної хроматографії. Визначено вміст вищих карбонових кислот у оліях насіння граната. Встановлено фізико-хімічні параметри досліджуваної олії. Встановлено вітамінний склад шкірки граната і соку.
ABSTRACT The investigation of fatty acid composition of granatum oil seeds method gas-liquid chromatography. Detected of higher contents of carboxylic acids in seed oils of granatum. Is established physico-chemical parameters of the investigated oil. Is established vitamin warehouse granatum the skin and juice.
ЗМІСТ СПИСОК УМОВНИХ ПОЗНАЧЕЕНЬ І СКОРОЧЕНЬ 5 ВСТУП 6 Розділ I. Літературний огляд 8 1.1. Загальна характеристика гранату (granatus) 8 1.2. Біологічно активні речовини 10 1.2.1. Вітаміни 11 1.2.2. Флавоноїди 16 1.2.3. Алкалоїди 18 1.3. Ліпіди 18 Розділ II. Обґрунтування напрямку дослідження 20
|
||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 345; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.066 с.) |

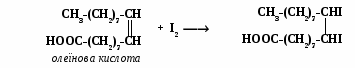 еханізм реакції взаємодії ненасичених жирних кислот з йодом:
еханізм реакції взаємодії ненасичених жирних кислот з йодом:



