
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Внутренняя энергия идеального газа. Параметр состояния.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Внутренняя энергия газа U, Дж/кг – запас кинетической энергии газа, характеризующейся суммой кинетических энергий поступательного, вращательного движения молекул, энергии внутримолекулярного колебания атомов и энергии межмолекулярного взаимодействия (потенциальной энергии). Первые 3 составляющие являются функцией от температуры, последняя (потенциальная энергия) = 0 (для идеального газа), след-но внутренняя энергия идеального газа зависит только от его температуры и не зависит от объема: U=f(T). Изменение внутр. энергии рабочего тела не зависит от его промежуточных состояний и хода процесса и определяется конечным и начальным состоянием: ∆U=U2-U1, Дж/кг, где U2-конечная внутренняя энергия, U1-начальная. Во всех термодинамических процессах, если V=const, т.е. рабочее тело не расширяется и не совершает работы, сообщаемая ему теплота q=cv(T2-T1) идёт только на увеличение его внутренней энергии т.е.: ∆U= cv(T2-T1); ∆U= М(U2-U1); ∆U= cv∙dT Для бесконечно малого изменения внутр. энергии: dU= cv∙dt Работа газа. Параметр процесса. Для определения работы рабочего тела удобно воспользоваться графическим изображением процессов в координатах p-v.
Выделим участок процесса 1-2, в котором происходит бесконечно малое изменение dv удельного объёма рабоч. тела. Давление на этом участке равно текущей ординате p. Первоначальн. объём газа- V1. Произведение pdV имеет размерность работы (l), производимой 1 кг рабочего тела, Дж/кг. где p - переменное давление газа на поршень, Па F - площадь поршня, м2 S - перемещение поршня,м Работа расширения l Дж/кг, рабочего тела в процессе 1-2: d l =p∙dv l =∫pdv, Дж/кг Работа газа в процессе расширения считается положительной. При уменьшении объёма газа, когда поршень будет двигаться справа налево, получим процесс сжатия газа. Совершаемая при этом работа наз. работой сжатия газа. Она считается отрицательной. Работа зависит от характера протекания процесса и явл. его фун-ей и не зависит от состояния. Работа 122'1'- положит. 121'2'б- отриц.
Теплоёмкость газа. Теплоёмкость (С) - кол-во тепловой энергии, необходимой для изменения температуры газа на 10С. Измеряется в Дж/К. Удельная теплоёмкость – теплоёмкость, отнесённая к одной количественной единице (кг, моль, м3). С, Дж/кг∙К – массовая теплоёмкость (к 1 кг) С', Дж/м3∙К – объёмная теплоёмкость (к 1 м3) µС, Дж/к моль∙К – молярная теплоёмкость (к 1 кмолю) Между ними имеют место след. Отношения: С= µС/22,41; С'=ρС Если к телу подводиться бесконечно малое кол-во тепла, то это мгновенная теплоемкость: С= dq/dt, Дж/кг∙0С. Если к телу с температурой Т1 подводиться некоторое кол-во тепла q, то его температура становиться равной Т2 – средняя теплоёмкость: Cm=q/T2-Т1 dq=Cdt T1→T2 q=∫Cdt Cm| T1T2=q/T2-T1
Cm| T2T1=∫Cdt/T2-T1=(Cm|0T2∙T2-Cm|T10∙T1)/T2-T1
Особое значение для нагревания (или охлаждения) газа имеют условия, при которых происходит процесс подвода (или отвода) теплоты. В теплотехнике наиболее важным является: -нагревание (или охлаждение) при постоянном объеме – изохорная теплоемкость; -нагревание (или охлаждение) при постоянном давлении – изобарная теплоемкость.
Газовые смеси. Идеальные газы, молекулы которых химически не реагируют друг с другом и между которыми отсутствуют силы притяжения и отталкивания, ведут себя в смеси так, как будто каждый из них находится в занимаемом объеме один. Это значит, что каждый газ, входящий в смесь, занимает весь предоставленный для смеси объем и находится под своим, так называемым, парциальным давлением. Общее давление смеси газов в таком случае будет состоять из суммы парциальных давлений (закон Дальтона): Pсм=∑Pi Pi- парциальное давление отдельного компонента - давление оказывающее о стенки сосуда при t и v газовой смеси. Следовательно:
Температура каждого газа в установившемся состоянии будет равна температуре смеси:
Ур-ние состояния смеси газов выводится на основании ур-ний состояния отдельных компонентов смеси и имеет вид: Rсм = g1*R1+g2*R2+…+gn*Rn, где g1,g2,..,gn - массовые доли компонентов. Газовую постоянную смеси, Дж/(кг*К), можно найти также по формуле:
Газовая смесь может быть задана массовыми и обьемными долями: Qi=Mi/Mcm=pi*ri/pcm;
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 541; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.110.231 (0.006 с.) |


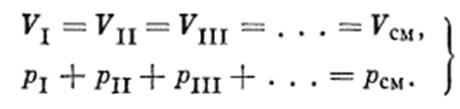

 . Для того чтобы можно было пользоваться этим уравнением, следует определить величину газовой постоянной смеси Rсм.
. Для того чтобы можно было пользоваться этим уравнением, следует определить величину газовой постоянной смеси Rсм.



