Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Присоединение углеводов наиболее популярный способ пострибосомальной ковалентной модификации белковСодержание книги
Поиск на нашем сайте Присоединение углеводов одна из составляющих механизма сортировки белков в клетке. Многие полипептидные цепи, попадающие в полости ЭР, взаимодействуют с углеводами. Наиболее популярные моносахариды, участвующие в ковалентной модификации белков приводятся в следующей таблице
Тип связи между белком и углеводом - результат разных механизмов синтеза. В зависимостиот типа связи между углеводной и белковой частями различают 2 типа гликопротеинов: · Гликопротеины с О- гликозидной связью между СЕР (ТРЕ) и N-ацетилгалактозамином, СЕР и ксилулозой или между гидроксилизином и галактозой (О-связанные гликопротеины) · Соединения с N- гликозидной связью между АСН и N-ацетилгалактозамином (N-связанные гликопротеины)
Полипептидные цепи (коровые белки) обоих типов гликопротеинов синтезируются на мембраносвязанных полирибосомах по матричному механизму синтеза, Углеводная часть гликопротеина образуется по двум механизмам: · Олигосахаридные цепи О-связанных гликопротеинов образуются путем постепенного добавления моносахаридов к образованной полипептидной цепи, Ферменты, которые катализируют этот процесс - мембраносвязанные гликозилтрансферазы. Синтез самих ферментов контролируется отдельными генами. Образование одного типа связи требует отдельного специфического фермента (гипотеза одна связь - одна гликозилтрансфераза). Присоединение первого сахара происходит во время трансляции, а остальные добавляются ферментами, локализованными на эндоплазматической сети. Ферменты, присоединяющие последний сахар локализованы в аппарате Гольджи.
Рис. Структура долихола · Образование олигосахаридной части N-связанных гликопротеинов происходит отдельно от белковой части. Ведущую роль в синтезе олигосахаридов занимает полиизопреновое соединение долихол (состоит 17-20 изопреновых единиц).
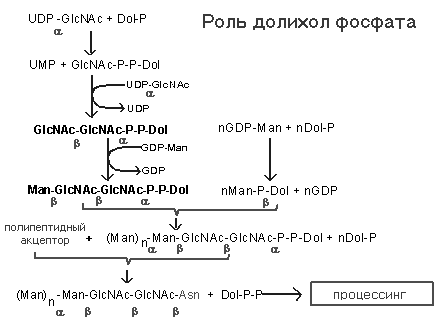
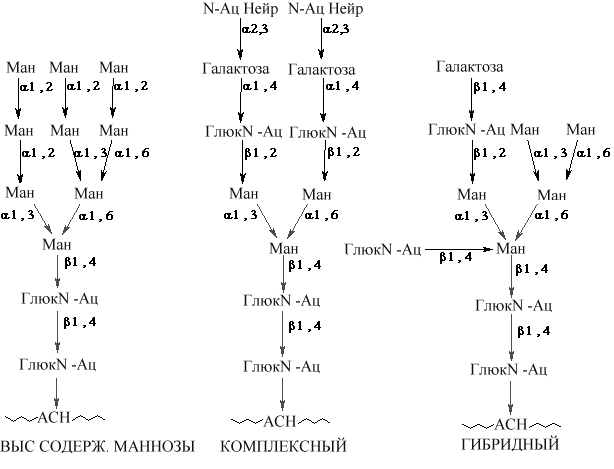
Рис Роль долихол-фосфата в механизме синтеза N-гликозидносвязанных белково- углеводных комплексов. Долихол-киназа превращает долихол в долихол-фосфат, который в свою очередь вступает в реакцию с УДФ-N-ац-глюкозамином с образованием долихол-пирофосфат-N-ац-глюкозамина. Затем к этому соединению присоединяется еще одна молекула N-ац-глюкозамина, 5 молекул маннозы (ГДФ-манноза как субстрат), затем еще 4 маннозы (донор маннозы долихол-манноза) и, наконец, добавляются 3 периферические остатка глюкозы (донор - долихол-глюкоза). Образованный олигосахарид переносится на АСН белка, расположенного на люминальной поверхности эдоплазматической сети. Катализируется этот процесс с участием 'олигосахарид-трансферазы', связанным с мембраной ферментом. Гликозилируются в основном секретируемые белки, белки цитозоля обычно не гликозилируются. Продукт трансферазной реакции долихол-Р-Р превращается в долихол-Р при помощи фосфатазы. Долихол -фосфат вновь используется в реакциях переноса. Преобладающим типом гликопротеинов животных клеток являются N – связанные гликопротеины. Участок связывания углевода в N - связанном гликопротеине представлен консенсусной последовательностью аминокислот, АСН-Y-СЕР (ТРЕ), (N-X-S (T)), где X - любая аминокислота кроме пролина. Присоединенный олигосахарид в последующем подвергается дополнительной модификации, однако у всех N-связанных гликопротеинов имеется одинаковое олигосахаридное ядро, связанное с полипептидом. Это ядро состоит из трех остатков манноз и двух GlcN-AцГлюкозамина. В зависимости от вариантов других сахаров присоединяемых в последующем к этому ядру различают три главных N -связанных семейства гликопротеинов (см рис.):
1. Семейство с высоким содержанием маннозы 2. Гибридный тип содержит кроме манозы другие гексозы и аминогексозы 3. Комплексный подобен гибридному, но кроме гексоз и аминогексоз содержит различные количества производных нейраминовой кислоты, присоединенных к концевым отделам олигосахаридных частей молекул. Углеводы в белке могут быть сигналами в клеточной сортировке белков. Ферменты, которые предназначены для лизосом (лизосомные ферменты) направляются после синтеза на рибосомах в лизомы специфичной модификацией углеводного компонента фермента. Лизосомные ферменты относятся к семейству N связанных гликопротеинов и имеют базовый олигосахарид, содержащий маннозу. Во время прохождения через аппарат Гольджи к С6 одной из манноз присоединяется остаток a-N-ацетилглюкозамин-1-фосфата (Глюк N-Ац - 1 - Ф) при участии Глюк N-Ац-фосфотрансферазы. Образуется фосфодиэирная связь (Глюк N-Ац - 1 - Ф -6-Манноза- Белок). Вторая реакция (катализируемая Глюк N-Ац - 1-фосфодиэфир-N-ацетилглюкоминидазой) удаляет Глюк N-Ац, при этом остающийся остаток маннозы, связанной с белком фосфорилирован в 6 положении: Ман-6-Ф -Белок. В мембранах аппарата Гольджи имеется специфический рецептор к Ман- 6-Ф. Связывание Ман-6-Ф рецептором обеспечивает перенос ферментов в лизосомы. Идентифицировано два различных рецептора к Ман- 6-Ф. Они являются интегральными мембранными белками. Один рецептор большой с молекулярной массой около 275 кДа, а другой рецептор с меньшей молекулярной массой (около 46 кДа). Большой рецептор связывает 2 молеклы Ман- 6-Ф, а меньший -1 молекулу на субъединицу. Больший рецептор не требует дивалентных катионов для связывания лиганда и назван катион независимым Ман-6-Ф рецептором (CI-MPR). У людей CI-MPR также связывает негликозилированный полипептидный гормон подобный инсулину фактор роста II (IGF -II) и поэтому называемый Ман-6-Ф/IGF-II рецептором. Участки, связывающие IGF –II и Ман-6-Ф, различаются друг от друга. Получены доказательства, что оба рецептора обеспечивают направление недавно синтезированных лизосомных ферментов к лизосомам. Нарушение активности Глюк N-Ац-фосфотрансферазы, катализирующей присоединение Глюк N-Ац- 1-Ф к остаткам Ман (Глюк N-Ац-фосфотрансферазы) в лизосомных ферментах приводит к формированию плотных включений в фибробластах и нарушению правильного перемещения ферментов в лизосомы. Описаны два заболевания, связанные с нарушением транспорта лизосомных ферментов: I – клеточная болезнь (муколипидоз II) и полидистрофия (муколипидоз III), или муколипидоз -HI. I - Клеточная болезнь характеризуется тяжелыми психомоторными нарушениями, деформацией скелета, болезненной ограниченной подвижностью в суставах и ранней смертностью. В крови увеличивается активность ферментов лизосом. Муколипидоз III протекает менее тяжело; она прогрессирует более медленно, и больные доживают до взрослого состояния.
|
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 444; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.62 (0.008 с.) |