Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Регуляция синтеза пуриновых нуклеотидов de novoСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В регуляции синтеза пуриновых нуклеотидов можно выделить несколько уровней. Управление синтезом в целом происходит на этапе фосфорибозиламидотрансферазы Как видно из рис. 9-18, основную роль в регуляции на этом уровне играет ингибирующее влияние мононуклеотидов по механизму обратной связи и -или концентрация ФРПФ (см выше).. Мононуклеотиды (АМФ и ГМФ). Второй уровень регуляции связан с контролем за поддержанием соответствующего равновесия между ATФ и ГТФ. АТФ, являясь источником энергии для синтеза ГМФ, стимулирует образование ГМФ. В свою очередь ГТФ, как источник энергии для синтеза АМФ, стимулирует образование АМФ Кроме того, каждый их нуклеотидов тормозит свое образование по принципу обратной связи, действуя на ферменты своего синтеза. ГМФ тормозит преобразование ИМФ в КсMФ, а AMФ тормозит преобразование ИМФ в аденилсукцинат.
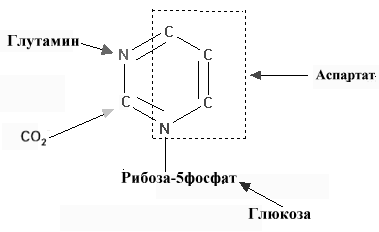
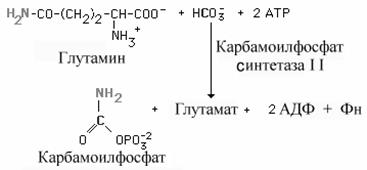
Такое многоуровневое и согласованное действие регуляторов позволяет поддерживать соотношение мононуклеотидов на уровне, обеспечивающем потребности в них в клетке Cинтез пиримидиновых нуклеотидов de novo Структура пиримидинового кольца проще, и путь биосинтеза пиримидинов короче, чем у пуринов. Амидный азот глутамина и диоксид углерода обеспечивает атомы 2 и 3 кольца пиримидина после преобразования их в карбамоилфосфат. Другие четыре атома кольца происходят из аспартата. Так же как и в случае с пуриновыми нуклеотидами, углеводная часть поставляется ФРПФ. Карбамоилфосфат. Образование пиримидиновых нуклеотидов начинается с синтеза карбамоил фосфата, который протекает в цитозоле тканей, способных к образованию пиримидинов (наиболее высокая активность синтеза в селезенке, тимусе, ЖКТ и яичках).
Карбамоил фосфат, как упоминалось в главе об обмене аминокислот, используется также в синтезе мочевины. Его образование в клетках катализируется двумя разными карбамоилфосфат синтетазами - I и II.Основные различия между ними приведены в таблице 9-3.
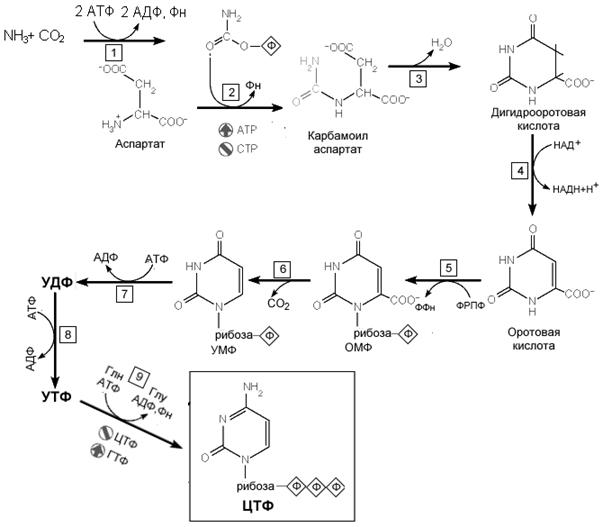
Карбамоилфосфат синтетаза II (КФС II) предпочитает амид глутамина свободному аммиаку и не требует N-ацетилглутамата в качестве косубстрата. У человекаn КФСII, аспартат-транскарбамоилазная, и дигидрооротазная активности - это части одного мультифункционального белка. Образование оротовой кислоты. Ключевая реакция. Первая уникальная для биосинтеза пиримидинов реакция – это реакция конденсации карбамоилфосфата и аспартата с образованием карбамоиласпартата, катализируемая аспартаттранскарбамоилазой (реакция
. Реакции синтеза пиримидиновых нуклеотидов оснований ( реакция 4). Образование нуклеотидов. Образование мононуклеотида происходит в реакции 5 путем присоединения к оротовой кислоте остатка рибоза-5-фосфата. Донором моносахарида служит ФРПФ. Первый пиримидиновый мононуклеотид - оротидинмонофосфат (ОМР). Эта реакция катализируется оротат-фосфорибозилтрансферазой — ферментом, аналогичным гипоксантин-гуанин— фосфорибозилрансферазе и аденин-фосфорибозил трансферазе, которые участвуют в фосфорибозилировании пуриновых колец при их реутилизации. Первый главный пиримидиновый рибонуклеотид - уридиловая кислота (уридинмонофосфат, УМФ) образуется путем декарбоксилирования оротидилата ( реакция б). Дигидрооротатдегидрогеназа — митохондриальный фермент. Все остальные ферменты, участвующие в синтезе пиримидинов de novo, локализуются в цитозоле. УМФ подвергается двукратному янием аминоимидазолилрибозилфосфатсинтетазы участвующие в синтезе пиримидинов de novo, локализуются в цитозоле. УМФ подвергается двукратному фосфорилированию и образующийся УТФ аминируется с участием глутамина и АТФ и образованием ЦТФ (реакция 9). Регуляция синтеза пиримидиновых нуклеотидов Ключевым ферментом синтеза пиримидиновых нуклеотидов у человека является цитоплазматическая КФС II. УТФ тормозит активность этого фермента, конкурируя с ATФ. ФРПФ является активатором этого фермента. Имеются и другие участки регуляции (например, OMФ декарбоксилаза ингибируется УМФ и ЦМФ). Однако при нормальных условиях эти участки имеют ограниченное значение. У бактерий ключевым регуляторным ферментом является аспартат транскарбомоилаза. У них имеется только одна карбомоилфосфат синтетаза, так как они не имеют митохондрий. Карбомоилфосфат, таким образом, находится на развилке метаболических путей, которая ведет или к образованию пиримидиновых нуклеотидов или к синтезу аргинина.
Суммарная сравнительная характеристика путей синтеза пуриновых и пиримидиновых нуклеотидов приводится в следующей таблице.
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 544; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.27.70 (0.011 с.) |