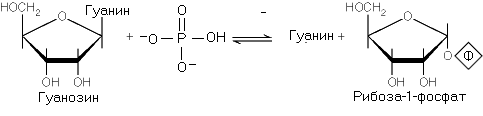Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Продукты распада нуклеотидов могут повторно использоваться (реутилизацироваться)Содержание книги
Поиск на нашем сайте
Продукты катаболизма нуклеиновых кислот могут использоваться клетками в качестве субстратов для синтеза мононуклеотидов и служить дополнительным источником пула нуклеотидов клеток. Нулеозиды и основания легко проникают через мембраны и могут, при участии системы кровообращения, переносится из клеток одних тканей другим Повторное использование этих продуктов для синтеза нуклеиновых кислот энергетически выгоднее для клеток, чем синтез их de novo. Большинство клеток обладает несколькими путями для преобразования нуклеозидов и свободных оснований назад, до уровня нуклеотидов. Имеются доказательства того, что биосинтез пуринов в печени обеспечивает предшественниками синтеза ДНК другие клетки, в частности, клетки костного мозга. В реутилизации продуктов распада нуклеиновых кислот участвуют следующие ферменты: Фосфорибозил трансферазы. Эти ферменты катализируют образование нуклеозидмонофосфатов из свободных оснований (аденина, гуанина, и гипоксантина) и ФРПФ;
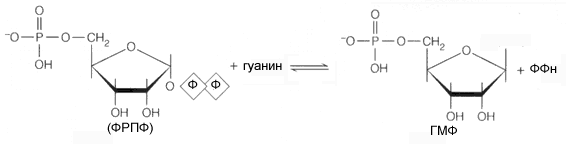
Две ключевых трансферазы включается в утилизацию пуринов: аденозин фосфорибозил-трансфераза (AФРT), которая катализирует следующую реакцию: аденин + ФРПФ <-----> AMФ+ ФФн и гипоксантин гуанин фосфорибозилтрансфераза (ГГФРТ ), которая катализирует следующую реакцию: ФРПФ +гипоксантин <------> ИМФ + ФФн 2. Нуклеотидазы – катализируют реакции гидролиза мононуклеотидов с образованием нуклеозидов; 3. Нуклеозидкиназы – катализируют реакции фосфорилирования нуклеозидов с образованием
3. Нуклеозидкиназы – катализируют реакции фосфорилирования нуклеозидов с образованием нуклеозидмонофосфатов; Тимидин киназа фермент который катализирует следующую реакцию: (Дезокси)тимидин + АТФ <=> дТМФ +АДФ Форма этого фермента, обнаруженная в цитозоле, действует только на дезокситимидин. Тимидин киназа митохондрий катализирует реакцию фосфорилирования дезокситимидина, дезоксицитидина и дезоксиуридина. Обладая довольно широкой специфичностью, митохондриальная тимидин киназа может влиять на фосфорилирование средства, используемого при лечении СПИДа, 3'-азидо-2'3'- дидезокситимидина (AZT). AZT после фосфорилирования в митохондриях, может ингибировать репликацию ДНК митохондрий, что может объяснить кардиотоксический эффект этого средства Дезоксицитидин киназа, фермент катализирующий фосфорилирование дезоксицитидина, а также дезоксиаденозина и дезоксигуанозина при высоких их концентрациях. Фермент ингибируется дЦТФ. В отличие от тимидин киназы, активность которой колеблется в течение клеточного цикла, активность дезоксицитидин киназы относительно постоянна. Дезоксигуанозин киназа I - митохондриальный фермент, катализирующий фосфорилирование дезоксигуанозина. 4. Фосфорилазы – катализируют реакцию фосфоролиза нуклеозидов, с образованием свободных оснований и рибоза-1-фосфата. Эти реакции обратимы и могут участвовать в образовании нуклеозидов
6. Эндонуклеазы,- катализируют гидролиз нуклеиновых кислот до олигонуклеотидов De novo синтез пуриновых и пиримидиновых рибонуклеотидов
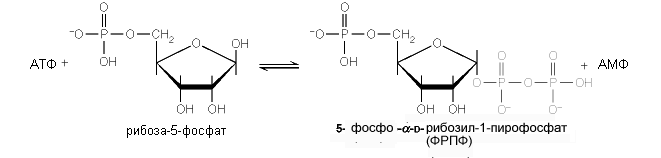
ФРПФ. Необходимой предпосылкой для биосинтеза нуклеотидов является синтез активной формы рибоза-5-фосфата. Рибоза 5-фосфат вступает в реакцию с ATФ, формируя 5-фосфо - a - D-рибозил-1-пирофосфат (ФРПФ). Реакция катализируется синтетазой ФРПФ. Фермент обнаружен практически во всех тканях, потому, что ФРПФ служит субстратом для процессов реутилизации нуклеотидов, синтеза пиримидиновых нуклеотидов, и коферментов НАД+ и НАДФ+ (фермент фосфорибозил трансфераза), синтеза пуриновых нуклеотидов (ФРПФ амидотрансфераза) de novo.
ФРПФ синтетаза тщательно регулируется рядом соединений (нуклеозидди- и трифосфаты,
2,3-ДФГ), преимущественно обеспечивая соответствие синтеза ФРПФ потребности
De Novo синтез пуриновых нуклеотидов. Пуриновые основания собираются на рибозе при участии нескольких амидотрансферазных и трансформилирующих реакции. Весь процесс можно разделить на 2 этапа: · а) образование ИМФ - исходного предшественника для синтеза главных пуриновых нуклеотидов · б) преобразование ИМФ в АМФ и ГМФ. Для синтеза ИМФ необходимо пять молей ATФ, два моля глутамина (атомы 3,9), один моль глицина (атомы 4,5,7), один моль CO2 (атом 6), один моль аспартата(атом 1) и два моля формиата (атомы 2,8). Формильный фрагмент переносится при участии тетрагидрофолиевой кислоты (ТГФ) в форме N5, N10-метенил-ТГФ и N10-формил-ТГФ (см рис 9-14).
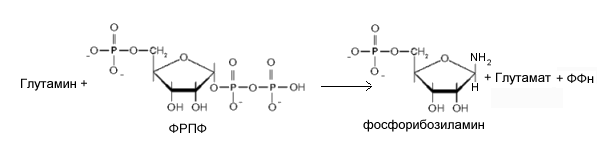
Ключевая реакция. Биосинтез пуриновых нуклеотидов происходит активно в цитозоле печени, где присутствуют все необходимые ферменты в форме макромолекулярного агрегата. Первый шаг - замена пирофосфата ФРПФ амидной группой глутамина катализируется фосфорибозипирофосфат амидотрансферазой. Продукт этой реакции - 5-фосфорибозиламин (ФРА). Аминогруппа глутамина, перенесенная на С1 рибоза-1-фосфата становится атомом N 9 будущего кольца пурина. Это - ключевая и ограничивающая скорость реакция пути синтеза пуриновых нуклеотидов. Фермент находится под жестким аллостерическим контролем путем торможения по типу обратной связи. И AMФ, и ГМФ, и ИМФ порознь ингибируют активность амидотрансферазы, так же как и пары AMФ + ГМФ или AMФ + ИМФ. Этим обеспечивается тонкий постоянный контроль активности этого фермента. Нуклеотиды ингибируют фермент, способствуя агрегации небольших активных молекул в неактивные агрегаты молекул. Коцентрация ФРПФ также играет существенную роль в регуляции скорости ключевой реакции. Нормальные внутриклеточные концентрации ФРПФ (которые могут и колебаться) - ниже Км фермента для ФРПФ, что создает возможности для увеличения скорости реакции, путем увеличения концентрации субстрата. Исследование зависимости скорости реакции от концентрации ФРПФ описывается S-образной кривой.
Фермент мало чувствителен к изменениям концентрации глутамина, (кинетика гиперболическая, а концентрация глутамина соответсвует Км). Очень высокая концен . Реакции образования ИМФ- первого пуринового нуклеотида.
трация ФРПФ может снимать обычный ингибирующий эффект, вызываемый нуклеотидами, заставляя неактивные агрегаты фермента диссоциировать с образованием активных молекул. Скорость синтеза ФРПФ зависит от наличия субстратов синтеза (рибоза-5-фосфата) и каталитической активности ФРПФ-синтазы, активность которой в свою очередь зависит от концентрации мононуклеотидов, выступающих в роли аллостерических регуляторов
Cинтез пуринов de novo - сложный, многоступенчатый, потребляющий большое количество энергии и тщательно регулируемый путь После образования 5-фосфорибозиламина, остальная часть молекулы формируется серией реакций в форме присоединения химических групп, образуя сначала пяти - а затем шестичленное кольца пурина. Целая молекула глицина (реакция 1), за счет ATФ присоединяется к аминогруппе ФРА, образуя глицинамид рибозидфосфат (ГАР). Эту реакцию катализирует глицинамид-киносинтетаза.. Углеродные атомы глицина становятся атомами С4 и С5, а
Cинтез пуринов de novo - сложный, многоступенчатый, потребляющий большое количество энергии и тщательно регулируемый путь После образования 5-фосфорибозиламина, остальная часть молекулы формируется серией реакций в форме присоединения химических групп, образуя сначала пяти - а затем шестичленное кольца пурина. Целая молекула глицина (реакция 1), за счет ATФ присоединяется к аминогруппе ФРА, образуя глицинамид рибозидфосфат (ГАР). Эту реакцию катализирует глицинамид-киносинтетаза.. Углеродные атомы глицина становятся атомами С4 и С5, а Реакции образования АМФ и ГМФ из ИМФ атом азота - N7 кольца пурина. Этот атом азота формилируется при участии глицинамид-рибозилфосфат –формилтрансферазы.(реакция 2). Донором формильной группы является N5, N10 метенилтетрагидрофолат. Атом углерода этой группы займет положение С8 в кольце пурина. Вторая молекула глутамина участвует в реакции 3. Амидирование происходит по атому С4 формилглицинамид - рибозилфосфата и катализируется формилглицинамид рибозилфосфатсинтетазой. Присоединяемый атом азота займет положение N3. Замыкание пятичленного (имидазольного) кольца происходит в реакции 4 под вли аминоимидазолилрибозилфосфатсинтетазы. Аминоимидазолрибозилфосфат карбоксилируется (реакция 5) с образованием аминоимидазолкарбоксилат-рибозилфосфата. a-Аминогруппа аспарагиновой кислоты в следующей реакции (реакция 6) становится донором азота кольца в положении N1.Сукцинильный фрагмент аспарагиновой кислоты удаляется в форме фумаровой кислоты. В результате возникает аминоимидазолкарбоксиламид – рибозилфосфат, который формилируется (реакция 7) N10-формилтетрагидрофолатом под влиянием формилтрансферазы. Вновь присоединенный атом углерода займет в молекуле пурина положение 2. ИМФ-циклогидролаза (реакция 8) завершает формирование пуринового нуклеотида, катализируя замыкание 6-членного кольца пурина. В результате образуется первый пуриновый нуклеотид – инозиновая кислота, (инозинмонофосфат ИМФ). На образование ИМФ расходуется 4 моля АТФ.
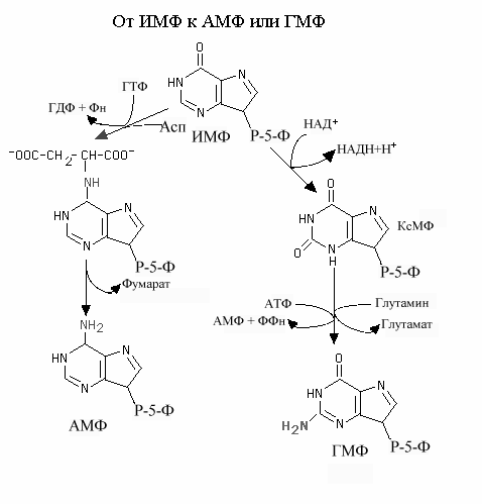
Образование AMФ и ГМФ (рис.9-19). ИМФ может затем превратится или в AMФ или в ГМФ. Образование ГМФ протекает в 2 стадии. Вначале ИМФ окисляется Рис. 9.20.Основные принципы регуляции синтеза пуриновых нуклеотидов. при участии НАД зависимой ИМФ дегидрогеназы с образованием ксантинмонофосфата (КсMP). Последний во второй стадии аминируется при участии амидогруппы глутамина, используя молекулу АТФ. При этом АТФ гидролизуется до АМФ и ФФн. Атом кислорода в позиции 2 замещается амидной группой глутамина. Образование АМФ также протекает в 2 стадии. ИМФ вначале аминируется с участием аспарагиновой кислоты. Механизм аминирования подобен реакции биосинтеза пуринового нуклеотида, в которой альфа аминогруппа аспарагиновой кислоты формирует атом N1 пуринового кольца. Аминирование ИМФ сопровождается образованием промежуточного соединения аденилосукцината. На втором этапе аденилосукцинат теряет атомы углерода аспарагиновой кислоты в составе фумарата, аминогруппа аспарагиновой кислоты становится 6-аминогруппой кольца аденина.
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 446; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.45.223 (0.01 с.) |