
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изменение внутренней энергии идеального газаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Первый закон термодинамики: все тепло, полученное телом, идет на совершение этим телом работы и изменения его внутренней энергии Q- количество теплоты; А- работа; ∆U- изменение внутренней энергии.
Правила знаков: +Q -если тело получает тепло (газ нагревают, газу передают количество теплоты) -Q- если тело отдает тепло (газ охлаждается, газ отдает тепло окружающей среде) + А тело само совершает работу (газ расширяется) - А над телом совершается работа (газ сжимает внешняя сила) +∆ U если тело нагревается (внутренняя энергия газа увеличивается) -∆ U если тело охлаждается (внутренняя энергия газа уменьшается).
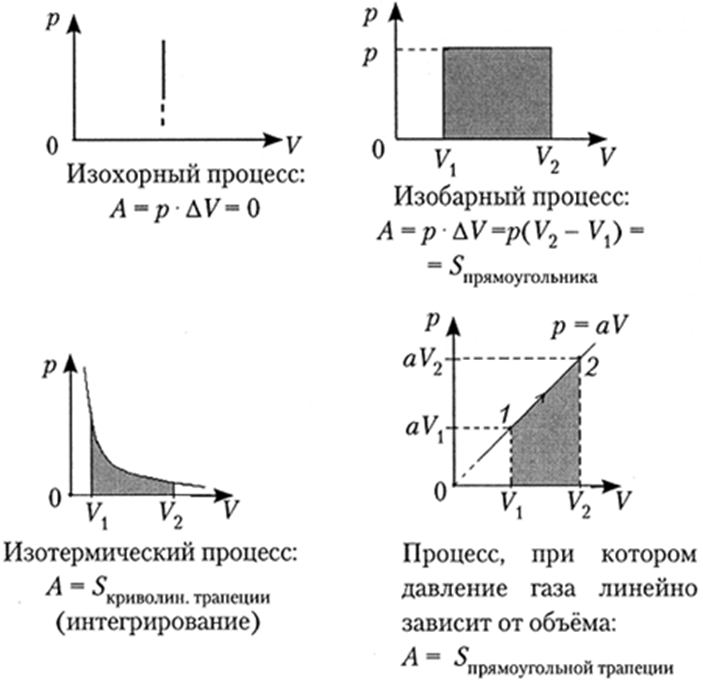
ЭКЗАМЕНАЦИОННЫЙ ВОПРОС № 27 Приведите формулу для определения работы идеального газа и объясните ее физический смысл. Объясните, как графический определяют работу идеального газа. Запишите формулы применения первого начала термодинамики к изопроцессам, объясните их физический смысл. Дайте определение адиабатного процесса. ОТВЕТ Формулы для определения работы идеального газа Изобарный процесс P=const
Изотермический Т=const
Изохорный V= const
Работу идеального газа можно определить графический, как площадь (S) фигуры образованный под графиком процесса построенного в координатах (P,V). S=A
Применение первого начала термодинамики к изопроцессам Изобарный процесс P=const; При изобарическом процессе обмен энергией между идеальным газом и окружающими телами происходит в форме работы и теплопередачи. Сообщенная идеальному газу теплота затрачивается и на изменение внутренней энергии, и на совершение газом работы: Q= A +∆U Изотермический процесс (Т = const): При изотермическом процессе обмен энергией между идеальным газом и окружающими телами происходит и в форме теплопередачи, и в форме работы. Все подведенное к идеальному газу тепло затрачивается на совершение работы. если температура газа не меняется, то внутренняя энергия газа также не будет меняться U=const, ∆U = 0 Q=A Если газ получает теплоту (Q > 0), то он совершает положительную работу (А > 0), если газ отдает теплоту (Q < 0), то А < 0. Работа внешних сил над газом в этом случае положительная (А > 0). Изохорный процесс V =const, При изохороном процессе обмен между идеальным газом и окружающими телами происходит только в форме теплопередачи. Вся подведенная к идеальному газу теплота затрачивается на изменение его внутренней энергии: A=0 Q =∆U Адиабатный процесс – это процесс протекающий без теплообмена с окружающей средой (на практике это быстро протекающие процессы) При адиабатном процессе обмен энергией между идеальным газом и окружающими телами происходит только в форме работы. Работа при адиабатическом процессе совершается за счет изменения внутренней энергии газа.
- при расширении газ охлаждается
- при сжатии газ нагревается.
ЭКЗАМЕНАЦИОННЫЙ ВОПРОС №28 Дайте определение теплоёмкости вещества. Перечислите возможные фазовые превращения вещества. Дайте определение понятиям удельная теплота парообразования и удельная теплота плавления. Запишите уравнение теплового баланса и объясните его физический смысл. ОТВЕТ Теплоёмкость - это количество теплоты, которое необходимо сообщить телу массой 1 кг для нагревания на 1
Теплоёмкость зависит от материала нагреваемого вещества, находится по таблице:
Фазовые превращения вещества: испарение, конденсация, плавление, кристаллизация и сублимация Плавление - переход вещества из твердого состояния в жидкое. Плавление каждого вещества происходит при определенной температуре, которая называется температурой плавления. Все подводимое тепло идет на разрушение кристаллической решетки, при этом увеличивается потенциальная энергия молекул. Кинетическая энергия остается без изменений и температура в процессе плавления не изменяется. Для расчета количества теплоты, необходимого для процесса плавления, следует применять формулу Q=λm Где λ (Дж/кг) - удельная теплота плавления – это количество теплоты, которое необходимо сообщить твердому телу массой 1 кг для превращения его в жидкость, если это тело нагрето до температуры плавления. Кристаллизация (отвердевание) – процесс, обратный плавлению. Осуществляется переход вещества из жидкого состояния в твердое. Происходит он при той же температуре, что и плавление. В процессе отвердевания температура также не изменяется. Количество теплоты, выделяемое в процессе отвердевания Q=-λm Испарение – переход вещества из жидкого состояния в газообразное. Испарение происходит интенсивнее при возрастании температуры. Кипение (парообразование) – переход вещества из жидкого состояния в газообразное. Происходит при определенной температуре, которую называют температурой кипения. В отличии от испарения, при кипении процесс парообразования идет со всего объема жидкости. Несмотря на то, что к кипящему веществу подводят тепло, температура не изменяется. Все затраты энергии идут на увеличение промежутков между молекулами. Температура кипения зависит от рода вещества и внешнего атмосферного давления. Количество теплоты, необходимое для процесса кипения, вычисляют по формуле Q=Lm Где L(Дж/кг) - удельная теплота парообразования -это количество теплоты, которое необходимо сообщить жидкости находящейся при температурекипения, чтобы испарить 1 кг Конденсация – процесс, обратный испарению. Сублимация – переход из твердого состояния в газ.
|
||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1487; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.169 (0.006 с.) |






 .
.



