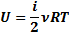Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Свойства твердых, жидких и газообразных телСодержание книги
Поиск на нашем сайте
Строение твердых, жидких и газообразных веществ Помните: химический состав молекул не зависит от агрегатного состояния
ЭКЗАМЕНАЦИОННЫЙ ВОПРОС №21 Запишите формулы, позволяющие вычислить массу атома или молекулы. Объясните физический смысл понятиям - концентрация вещества, число Авогадро. Объясните способ определения молярной массы вещества. Дайте определение понятиям: количество вещества, идеальный газ. Объясните, как создается давление газа, перечислите приборы, используемые для измерения давления газа. Перечислите единицы измерения давления газа. Объясните, как перевести мм тр. ст. в паскали. ОТВЕТ:
Число Авогадро – это число молекул содержащихся в одном моле вещества. 1 моль содержит Концентрация – это число молекул содержащихся в единице объема. (n - концентрация)
V – Объем; 1л=10 n=
Определение молярной массы:
Количество вещества - это число показывающее сколько молей содержится в веществе
Идеальный газ- это модель газа. Молекулы идеальные шарики, между которыми полностью отсутствует взаимодействие, столкновение между молекулами абсолютно упругое. Реальный газ, находящийся при низком давлении можно считать идеальными. Давление газа создается в результате ударов молекул о стенки сосуда, в котором находится газ. Давление газа измеряют с помощью манометра и барометра.
Манометр измеряет давление газов в сосуде. Барометр измеряет атмосферное давление. Ртутный барометр – прибор для определения атмосферного давления, создан Торричелли. Состоит из стеклянной трубки, запаянной с одного конца, длиной 1м, заполненной ртутью; широкого сосуда, в который выливается ртуть после поворота трубки. Единицы измерения давления: В “СИ” P=[Па]
1 атм=10 P=[бар] 1 бар=9,6х10 P=[мм.рт.ст] 1 мм.рт.ст=133Па P
ЭКЗАМЕНАЦИОННЫЙ ВОПРОС №22 Запишите основное уравнение молекулярно-кинетической теории идеального газа, объясните физический смысл формулы. Объясните зависимость давления газа от температуры. ОТВЕТ: 1. Основные уравнения МКТ идеального газа связывает макропараметры (давление, объем, температуру, массу) и микропараметры (массу молекул, скорость молекул, кинетическую энергию) 1) m0 – масса одной молекулы P – давление n – концентрация υкв – средняя квадратичная скорость движения молекул 2) Eк – средняя кинетическая энергия поступательного движения молекул газа 3)
2.Давление газа зависит от температуры, если температура увеличивается, то увеличивается скорость движения молекул, в результате, увеличивается число ударов молекул о стенки сосуда, а значит, возрастает давление газа.
k – постоянная Больцмана, k= 1.38*10-23 Дж/К T – термодинамическая температура, T= [K] кельвин T= t+273
Приложение:
k*NA= R – универсальная газовая постоянная
Mвозд= 29*10-3 кг/моль ЭКЗАМЕНАЦИОННЫЙ ВОПРОС №23 Сформулируйте понятие о температуре и объясните ее физический смысл. Дайте определение абсолютного нуля. Какая единица температуры используется в системе СИ? Объясните принцип построения абсолютной температурной шкала и шкалы Цельсия.
ОТВЕТ: 1. Температура – является макроскопическим параметром тела, характеризующим его состояние, а также возможные передачи тепла, так как тепло может переходить только от более горячего тела к более холодному. Температура является мерой средней кинетической энергии поступательного движения молекул
k= 1.38*10-23 Дж/К – постоянная Больцмана T – термодинамическая температура, T= [K] кельвин
От температуры тела зависит скорость движения молекул. Например: Средняя квадратичная скорость движения молекул газа R= 8.31Дж/моль*К – универсальная газовая постоянная M – молярная масса газа
2. Абсолютный нуль – это минимально возможная температура. Шарль изучал зависимость давления газа от его температуры при неизменном объеме. По результатам эксперимента он построил график зависимости Рот Т (прямо пропорциональная зависимость). Из графика видно, что давление газа будет равно нулю при температуре -2730С. При данной температуре молекулы и атомы полностью прекращают свое движение
-273ºС – абсолютный нуль -273ºС соответствует температуре 0 K
3.Используется теоретическая и практическая шкала измерения температур. По теоретической шкале в системе «СИ» температура измеряется в [К] кельвин. T=[К] кельвин Практическая шкала это ºС и ºF (Цельсия и Фаренгейт) t= [ºС] Цельсий T= t+273 TF= 32+1.8t
4.Шкала Цельсия за основу принимает агрегатные переходы воды: 0ºС – вода замерзает, 100 ºС – закипает. Термодинамическая шкала начинается с абсолютного нуля(отрицательных температур нет). При этом 1K=1ºС,то есть термодинамическая шкала сдвинута относительно шкалы Цельсия на 273ºС при этом Δt=ΔT Пример: Δt=t2- t1; T1= t1+273; T2= t2+273; ΔT= t2+273- t1+273= t2- t1= Δt
ЭКЗАМЕНАЦИОННЫЙ ВОПРОС №24 Запишите уравнение состояния идеального газа для произвольной массы газа и количества вещества (уравнение Клапейрона - Менделеева). Вычислите объем одного моля газа при нормальных условиях.
ОТВЕТ: 1. Уравнения состояния газа.
R= 8.31Дж/моль*К –универсальная газовая постоянная, Р(Па) - давление газа,
2. Дано:
Н.у. P0=105Па T=273K V -?
Решение
Вычисление:
ЭКЗАМЕНАЦИОННЫЙ ВОПРОС №25 Перечислите параметры, характеризующие состояние газа. Дайте определение понятию – изопроцессы. Сформулируйте понятия: изотермический, изохорный и изобарный процессы. Приведите формулы, связывающие параметры идеального газа при изотермическом, изобарном и изохорном процессах, объясните их физический смысл. Построите графики зависимости параметров состояния идеального газа при изотермическом, изобарном и изохорном процессах, объясните их физический смысл. ОТВЕТ: Состояние газа описывается с помощью макроскопических параметров: давления, объем, температура(P,V,T). Изопроцессами называются процессы, протекающие при постоянной массе газа и при постоянном одном из параметров.Согласно уравнению Менделеева - Клайперона.
Если m=const, то
ЭКЗАМЕНАЦИОННЫЙ ВОПРОС №26 Сформулируйте понятие внутренняя энергия и перечислите способы ее изменения. Приведите формулу, позволяющую определить внутреннюю энергию идеального газа, и объясните ее физический смысл. Дайте определение числа степеней свободы. Сформулируйте определение закона сохранения энергии в тепловых процессах (первый закон термодинамики), объясните правило знаков.
ОТВЕТ Внутренняя энергия сосредоточена «внутри» вещества и складывается из потенциальной энергии взаимодействующих молекул (или атомов) и кинетической энергии их движения. Где
Способы измерения внутренней энергии: совершением над телом работы и теплопередача. Теплопередача бывает 3-х видов: 1) Теплопроводность -это передача тепла от более нагретого участка к более холодному. 2) Конвекция -это передача тепла потоками жидкости или газа. 3) Излучение -это передача тепла посредством электромагнитных излучений. Внутренняя энергия идеального газа складывается только из кинетических энергий движения молекул т.к. молекулы идеального газа не взаимодействуют друг с другом. Формулы для определения внутренней энергии идеального газа
Где U=[Дж] – внутренняя энергия, m (кг)-масса газа, М- молярная масса газа, R=8,31 Дж/(моль*К) универсальная газовая постоянная, Т(К) - термодинамическая температура, Р (Па)-давление газа, V (м3) – объём газа,
i- степень свободы.
Степень свободы -это количество независимых величин, с помощью которых может быть задано положение системы (зависит от числа атомов содержащихся в молекуле); Если газ одноатомный(Ar;Ne; He) i = 3; Если газ двухатомный Н2;О2;N2; i=5; Если газ трехатомный и более атомный H2O;NH3, i=6 Исключение – СО3: i= 5
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 952; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.195.178 (0.012 с.) |



 - масса 1-ой молекулы,
- масса 1-ой молекулы,  - масса всего вещества,
- масса всего вещества,  - число молекул
- число молекул
 - молярная масса,
- молярная масса,  =[кг/моль],
=[кг/моль], 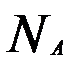 - число Авогадро
- число Авогадро  =6,02х
=6,02х 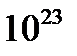 моль
моль 
 молекул
молекул
 м
м  n=[1/м
n=[1/м  ]=[м
]=[м  ]
]
 -плотность
-плотность 
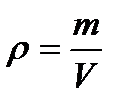
 [кг/м
[кг/м  ]
] Ar
Ar кг/моль, получаем молярную массу
кг/моль, получаем молярную массу - количество вещества
- количество вещества  ;
; 
 Па
Па Па
Па =10
=10  Па (нормальное условие).
Па (нормальное условие).


 - плотность газа
- плотность газа












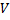 (м3)- объем газа,
(м3)- объем газа, (кг) – масса газа, Т(К) – абсолютная температура, М (кг/моль) – молярная масса газа
(кг) – масса газа, Т(К) – абсолютная температура, М (кг/моль) – молярная масса газа
 - количество вещества
- количество вещества
 (кг/м3)- плотность газа
(кг/м3)- плотность газа




 ,
, 
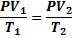
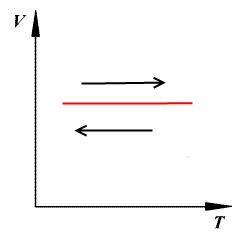
 Закон Гей Люсака
Если V↑, T↑
V↓, T↓
Закон Гей Люсака
Если V↑, T↑
V↓, T↓
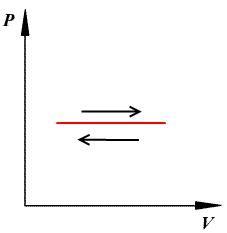



 Закон Бойля Мариотта
P↑, V↑
P↓, V↓
Закон Бойля Мариотта
P↑, V↑
P↓, V↓




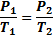 Закон Шарля
V↑, T↑
Закон Шарля
V↑, T↑