Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периплазматическое пространствоСодержание книги
Поиск на нашем сайте
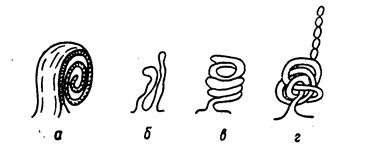
Периплазматическое пространство (периплазма) представляет собой зону между клеточной стенкой и ЦПМ. Толщина периплазмы составляет около 10 нм, объем зависит от условий среды и, прежде всего, от осмотических свойств раствора. Периплазма может включать до 20% всей находящейся в клетке воды, в ней локализуются некоторые ферменты (фосфатазы, пермеазы, нуклеазы и др.) и транспортные белки – переносчики соответствующих субстратов. Мезосомы Мезосомы представляют собой мембранные структуры, образуемые при закручивании ЦПМ. Морфологически мезосомы выглядят как ламеллярные стопки или спирально упакованные ламеллы, везикулярные или тубулярные структуры, а также смешанные мембранные системы, образованные трубочками, пузырьками и ламеллами (рис. 7). По расположению в клетке различают: мезосомы, образующиеся в зоне клеточного деления и формирования клеточной перегородки (септальные мезосомы) и мезосомы, сформированные в результате инвагинации периферических участков ЦПМ (латеральные мезосомы).
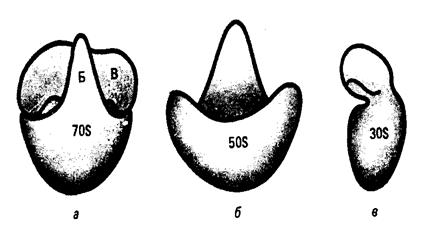
Рис. 7. Типы строения истинных мезосом. а - ламеллярный; б - г - тубулярные типы (Бирюзова, Поглазова, 1977). Предполагается, что мезосомы полифункциональны, содержат различные ферментные системы и играют определенную роль в энергетическом метаболизме. Считают, что они являются сайтом для формирования клеточной стенки бактерий и прикрепления нуклеоида в процессе репликации ДНК. Септальные мезосомы участвуют в построении поперечной перегородки при делении бактерий. Цитоплазма Содержимое клетки, окруженное ЦПМ, составляет цитоплазму бактерий. Та часть цитоплазмы, которая имеет гомогенную коллоидную консистенцию и содержит растворимые РНК, ферменты, субстраты и продукты обмена веществ, обозначается как цитозоль. Другая часть цитоплазмы представлена различными структурными элементами: мезосомами, рибосомами, включениями, нуклеоидом, плазмидами. Рибосомы - субмикроскопические рибонуклеопротеидные гранулы диаметром 15-20 нм. В рибосомах находится примерно 80-85% всей бактериальной РНК. Рибосомы прокариот имеют константу седиментации 70 S. Они построены из двух частиц: 30 S (малая субъединица) и 50 S (большая субъединица) (рис. 8). Рибосомы служат местом синтеза белка.
Рис. 8. Рибосома (а) и ее субчастицы -большая (б) и малая (в) (Блинов Н.П., 1989). Некоторые бактерии способны накапливать фосфорную кислоту в виде гранул полифосфата (зерна волютина, метахроматические зерна, зерна Бабеша-Эрнста). Они играют роль фосфатных депо и регулярно выявляются у коринебактерий, микобактерий и спирилл в виде плотных, хорошо контурированных образований в форме шара или эллипса, располагающихся, в основном, у полюсов клетки. Обычно на полюсах бывает по одной грануле. Наличие зерен волютина у бактерий определяют методом Нейссера. Метод окраски по Нейссеру 1. Фиксированный мазок окрашивают уксуснокислой синей 4 мин, затем сливают краску. 2. Промывают водой и наливают раствор Люголя на 20-30 сек. 3. Не промывая водой, окрашивают везувином 1-3 мин. 4. Промывают водой, высушивают. Тела бактерий окрашиваются в нежный светло-коричневый цвет, зерна волютина - в темно-синий, почти черный цвет. Нуклеоид Нуклеоид – ядерный аппарат бактерий. Представлен молекулой ДНК, соответствующей одной хромосоме. Она циркулярно замкнута, располагается в ядерной вакуоле, не имеет ограничивающей от цитоплазмы мембраны и митотического аппарата. С ДНК связано небольшое количество РНК и РНК-полимеразы. ДНК свернуто вокруг центрального стержня, состоящего из РНК и представляет собой высокоупорядоченную компактную структуру. Хромосомы большинства прокариот имеют молекулярную массу в пределах 1-3х109, константу седиментации 1300-2000 S. Молекула ДНК включает 1,6х107 нуклеотидных пар. Различия в генетическом аппарате прокариотных и эукариотных клеток обуславливает его название: у первых – нуклеоид (образование подобное ядру), в отличие от ядра у вторых. В нуклеоиде бактерий содержится основная наследственная информация, которая реализуется в синтезе специфических белковых молекул. С ДНК бактериальной клетки связаны системы репликации, репарации, транскрипции и трансляции. Нуклеоид в прокариотной клетке может быть выявлен в окрашенных препаратах с помощью светового или фазово-контрастного микроскопа. Для окрашивания ядерного вещества используется краситель Фельгена, который специфически окрашивает ДНК. Метод окраски ДНК по Фельгену 1. Мазок из культуры бактерий фиксируют 2-3 мин метиловым спиртом и помещают в холодную 1% HCl на 1 мин. 2. Подвергают гидролизу при 600С в 1% HCl 5-10 мин и споласкивают дистиллированной водой. 3. Помещают мазок в реактив Шиффа на 40-60 мин, промывают в водопроводной воде 2 мин. В результате взаимодействия свободных альдегидных групп с бесцветной фуксинсернистой кислотой появляется фиолетовая окраска, свойственная основному фуксину. У многих бактерий в цитоплазме обнаружены внехромосомные генетические элементы – плазмиды. Они представляют собой замкнутые в кольца двухцепочечные ДНК, состоящие из 1500-40 000 пар нуклеотидов и содержащие до 100 генов. Плазмиды могут существовать в клетке и в интегрированном состоянии с бактериальной хромосомой, сохраняя при этом способность переходить к автономии. Капсула Капсула – слизистый слой клеточной стенки бактерий, состоящий из полисахаридов (пневмококк) или полипептидов (бацилла сибирской язвы). Микрокапсулу (толщиной менее 0,2 мкм) способны формировать большинство бактерий, четко выраженную макрокапсулу (толщиной более 0,2 мкм) формируют пневмококк, клебсиеллы, возбудитель сибирской язвы и некоторые другие. У патогенных бактерий капсула образуется в макроорганизме, на искусственных питательных средах она обычно утрачивается (за исключением клебсиелл). В организме человека и животных капсула защищает патогенные бактерии от бактериофага, фагоцитоза и гуморальных факторов иммунитета, определяет антигенную специфичность микроорганизмов. Капсулы, имея консистенцию геля, плохо удерживают краситель, и для их выявления чаще всего применяют методы негативного контрастирования. Метод выявления капсулы по Бурри-Гинса 1. На середину предметного стекла наносят каплю черной туши и смешивают ее с помощью петли с каплей культуры капсульных бактерий. 2. Краем другого предметного стекла делают мазок по типу кровяного. Мазок сушат на воздухе и фиксируют в пламени горелки. 3. Окрашивают 5 мин карболовым фуксином, разведенным водой 1:3. 4. Осторожно промывают водой, высушивают. Бактерии окрашиваются в красный цвет, неокрашенные капсулы контрастно выделяются на темном фоне препарата. Жгутики Жгутики выполняют роль органа движения, позволяющего бактериям передвигаться со скоростью 20-60 мкм/сек. Бактерии могут иметь один (монотрихи) или несколько жгутиков, располагающихся по всей поверхности тела (перитрихи), либо собранные в пучки (лофотрихи). Перитрихиальное расположение жгутиков характерно для энтеробактерий, возбудителей анаэробной инфекции, столбняка, ботулизма; монотрихом является холерный вибрион, лофотрихом - псевдомонас. У некоторых видов спирилл различают амфитрихиальное расположение жгутиков. Толщина жгутиков в среднем составляет 10-30 нм, а длина достигает 10-20 мкм. Основу жгутика составляет длинная спиральная нить (фибрилла), которая у поверхности клеточной стенки переходит в утолщенную изогнутую структуру- крюк и прикрепляется к базальной грануле, вмонтированной в клеточную стенку и ЦПМ (рис. 10). Базальные гранулы имеют диаметр около 40 нм и состоят из нескольких колец (одна пара у грамположительных бактерий, четыре - у грамотрицательных прокариот). Удаление пептидогликанового слоя клеточной стенки ведет к потере способности бактерий к движению, хотя жгутики при этом остаются неповрежденными.
Рис. 10. Схематическая модель базального конца жгутика Е. coli, основанная на электронных микрофотографиях выделенной органеллы (Стейниер Р. и др., 1979). Жгутики почти полностью состоят из белка флагеллина с некоторым содержанием углеводов и РНК. Под микроскопом жгутики можно увидеть лишь после специальных методов протравливания и импрегнации солями серебра и ртути с последующей окраской метиленовой синью (метод Леффлера). При этом необходимо учитывать, что жгутики очень чувствительны к различным механическим воздействиям. О наличии жгутиков можно косвенно судить по направленному характеру движения в «висячей» и «раздавленной» капле в темнопольном и фазово-контрастном микроскопах, либо при светлопольной микроскопии при опущенном конденсоре и частично прикрытой диафрагме микроскопа. Окраска жгутиков методом Леффлера В основе выявления жгутиков лежит осаждение на них красителя, чем достигается увеличение толщины жгутиков и уменьшение их прозрачности. 1. Препарат готовят из 16-18 часовой культуры, которую вносят в 1-2 мл стерильной водопроводной воды до получения тонкой опалесцирующей взвеси. 2. Через 20 мин капля суспензии наносят на поверхность чистого обезжиренного стекла и высушивают на воздухе. 3. Обрабатывают в течение 15 мин протравой следующего состава: 1 мл насыщенного спиртового раствора основного фуксина, 10 мл 25% водного раствора таннина, 5 мл насыщенного водного раствора сернокислого железа. 4. Препарат промывают водой. 5. Окрашивают карболовым фуксином Циля, разведенным водой в соотношении 1:1, в течение 5 мин при легком подогревании. 6. Промывают водой, высушивают. При микроскопии готового препарата жгутики видны как тонкие нитевидные структуры. Ворсинки (фимбрии, пили) Поверхность энтеробактерий и нескольких других микроорганизмов покрыта большим числом (от 10 до нескольких тысяч) ворсинок – нитевидных образований белковой природы. Как и жгутики, они построены из одного вида белка – пилина, субъединицы которого организованны в виде полой внутри нити и берут начало от ЦПМ. Они короче и тоньше жгутиков, их ширина 10-12 нм и длина до 12 мкм. Ворсинки полифункциональны: обеспечивают трансмиссивную передачу генов (конъюгация), являются рецепторами для фагов, органом прикрепления бактерий к питательному субстрату (адгезия), участвуют в транспорте метаболитов. У стрептококков имеется наружный слой протеиновых волосков (фимбрий), которые получили название белок М (М-протеин). Этот белок играет важную роль в процессах взаимоотношений бактерий с макроорганизмом. Споры Некоторые бактерии в конце периода активного роста способны образовывать споры. Этому предшествует обеднение среды питательными веществами, изменение ее рН, накопление ядовитых продуктов метаболизма. Как правило, одна бактериальная клетка образует одну спору – локализация спор различна (центральная, терминальная, субтерминальная) (рис. 11).
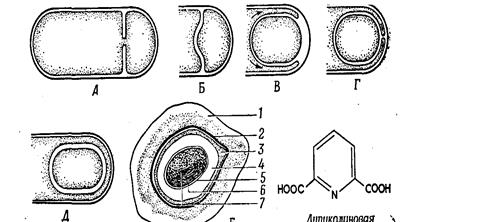
Pис. 11. Типичные формы спорообразующих клеток. 1. Спора расположена в центре; материнская клетка не увеличена (Bacillus megaterium). 2. Спора расположена терминально, материнская клетка не увеличена; заметны белковые включения (Bacillus thuringiensis). 3. Спора расположена терминально, материнская клетка раздута в форме булавы (Bacillus polymyxa). 4. Спора расположена в центре; материнская клетка деформирована и приобрела форму веретена - клостридиальная форма (Bacillus polymyxa). 5. Спора расположена терминально; круглая материнская клетка имеет форму барабанной палочки - плектридиальная форма (Bacillus sphaericus). 6. Спора расположена латерально; материнская клетка приобрела веретенообразную форму (Bacillus laterosporus) (Шлегель Г., 1987). Если размеры спор не превышают поперечного размера палочковидной бактерии, то последняя называется бациллой (возбудитель сибирской язвы). Когда диаметр споры больше – бактерии имеют форму веретена и носят название клостридий (возбудители анаэробной инфекции). Клостридии столбняка имеют круглую спору и напоминают барабанные палочки. Клостридии ботулизма отличаются большими овальными спорами, что придает им вид теннисной ракетки. По химическому составу различие спор от вегетативных клеток состоит лишь в количественном содержании химических соединений. Споры содержат меньше воды и больше липидов. Формирование спор связано с уплотнением и обособлением определенного участка цитоплазмы вегетативной клетки с последующим образованием внутри бактерии круглого или овального тельца, покрытого плотной многослойной оболочкой, которая пропитана большим количеством липидов, кальция, дипиколиновой кислоты (рис. 12).
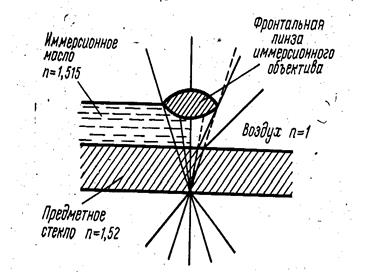
Рис. 12. Схема образования споры. А и Б. Образование септы. В и Г. Окружение протопласта споры протопластом материнской клетки. Д. Образование кортекса и оболочек споры. Е. Схема строения зрелой споры. 1 - экзоспориум; 2 - наружная оболочка споры; 3 - внутренняя оболочка споры; 4 - кортекс; 5 - клеточная стенка зародыша; 6 - цитоплазматическая мембрана; 7 - цитоплазма с ядерным веществом (Шлегель Г., 1987). После полного созревания споры вегетативная часть клетки может лизироваться. Среди патогенных микробов способностью к спорообразованию обладают только палочковидные грамположительные бактерии. Большинство из них подвижны, благодаря перитрихиально расположенным жгутикам. В состоянии споры микроорганизмы метаболически неактивны, выдерживают высокую температуру (140°-150°С), воздействие химических дезинфицирующих веществ и длительно сохраняются в окружающей среде. Устойчивость к высокой температуре связана с очень низким содержанием воды и высоким содержанием дипиколиновой кислоты. Попадая в организм человека и животных, споры прорастают в вегетативные клетки. Процесс прорастания спор включает три стадии: активации, начальной стадии и стадии роста. К активирующим агентам, нарушающим состояние покоя, относят повышенную температуру, кислую реакцию среды, механические повреждения и др. Спора начинает поглощать воду, освобождается от дипиколата кальция, с помощью гидролитических ферментов разрушает многие собственные структурные компоненты. После разрушения наружных слоев наступает период формирования вегетативной клетки с активацией биосинтеза, заканчивающейся делением клетки. Окраску спор производят специальным методом, который включает предварительное прогревание споры, а также воздействие концентрированных растворов красок при высокой температуре. Метод окраски спор по Ожешко 1. На высушенный мазок наливают 0,5 % раствор хлористоводородной кислоты и подогревают 1-2 мин. 2. Препарат промывают водой и фиксируют над пламенем горелки. 3. Окрашивают по способу Циля-Нильсена. Споры прочно удерживают карболовый фуксин и окрашиваются в красный цвет, цитоплазма бактерий обесцвечивается 5% серной кислотой и после докрашивания метиленовым синим приобретает синий цвет. МЕТОДЫ МИКРОСКОПИЧЕСКОГО ИССЛЕДОВАНИЯ МИКРООРГАНИЗМОВ Мельчайшие размеры микроорганизмов обусловливают использование для изучения морфологии бактерий точных оптических приборов – микроскопов. Наиболее часто применяются светлопольная микроскопия, микроскопия в темном поле, фазово-контрастная и люминесцентная микроскопия. Для специальных микробиологических исследований используется электронная микроскопия. Светлопольная микроскопия Светопольная микроскопия осуществляется с помощью обычного светового микроскопа, основной частью которого является объектив. На оправе объективов обозначается увеличение: 8, 10, 20, 40, 90. При исследовании микробов применяется иммерсионная система (объектив). Иммерсионный объектив погружают в каплю кедрового масла, нанесенного на препарат. Кедровое масло имеет такой же коэффициент преломления, как и стекло, и этим достигается наименьшее рассеивание световых лучей (рис. 13).
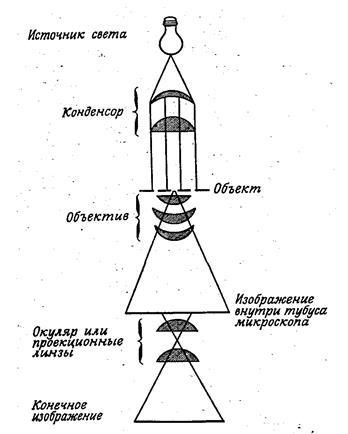
Рис. 13. Ход лучей в иммерсионном объективе. Изображение, получаемое в объективе, увеличивает окуляр, состоящий из двух линз. В отечественных микроскопах применяются окуляры с увеличением: 7, 10, 15 (рис. 14). Общее увеличение микроскопа определяется произведением увеличения объектива на увеличение окуляра. В микробиологии обычно используются увеличения в 900-1000 раз. Качество микроскопа зависит не от степени увеличения, а от его разрешающей способности.
Рис. 14. Схема сложного светового микроскопа для наблюдения в светлом поле, отрегулированного для освещения по Келеру (Стейниер Р. и др., 1979). Под этим надо понимать наименьшее расстояние между двумя точками препарата, при котором они еще четко различимы под микроскопом. Разрешающая способность обычных световых микроскопов с иммерсионной системой равна 0,2 мкм. Темнопольная микроскопия Микроскопия в темном поле зрения основана на следующем принципе (рис. 15). Лучи освещают объект не снизу, а сбоку и не попадают в глаза наблюдателя, поле зрения остается темным, а объект на его фоне оказывается светящимся. Это достигается с помощью специального конденсора (параболоид), или обычного конденсора, прикрытого в центре кружком черной бумаги.
Рис. 15. Схема микроскопа для наблюдения в темном поле (Стейниер Р. и др., 1979). Препараты для темнопольной микроскопии готовят по типу раздавленной капли. Исследуемый материал (бактериальная культура в физиологическом растворе) наносят на предметное стекло, которое покрывают покровным. Капля материала заполняет все пространство между покровным и предметным стеклом, образуя ровный слой. Темнопольная микроскопия используется для изучения живых неокрашенных микроорганизмов.
|
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 574; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.224.105 (0.009 с.) |