Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Заболевания желудочно-кишечного тракта,Содержание книги
Поиск на нашем сайте НАРУШЕНИЯ ФУНКЦИЙ ПИЩЕВОДА Пищевод представляет собой полый мышечный орган, основной функцией которого является обеспечение продвижения пищевого комка из глотки в желудок. Это достигается за счет перистальтических сокращений мышц пищевода и координированных процессов сокращений и расслаблений нижнего пищеводного сфинктера (НПС). Нарушения моторной функции пищевода приводят как к увеличению давления в его просвете, так и к снижению внутрипищеводного давления. Увеличение внутрипищеводного давления наблюдается при ахалазии пищевода; диффузном спазме мышц пищевода; «гипертонусе» нижнего пищеводного сфинктера, при системной склеродермии, сахарном диабете, интоксикациях алкоголем и его суррогатами, а также при психических расстройствах (истерии). Стриктуры пищевода, представляющие собой анатомическое сужение его просвета в результате разрастания соединительной ткани после повреждения его стенок (кислотами, щелочами, прижигающими ядами и пр.) также характеризуются увеличением внутрипищеводного давления проксимальнее места его сужения. Ахалазия пищевода (греч. «а» - отсутствие, «халазис» - расслабление) – заболевание, основной причиной которого является дегенерация нервных ганглиев в стенке пищевода. В механизмах развития этого заболевания определенная роль принадлежит наследственному дефициту конституциональной NO-синтазы в окончаниях нервов, иннервирующих мускулатуру тела пищевода. В этих нервных окончаниях также снижено содержание вазоинтестинального пептида, который в физиологических условиях стимулирует активность NO-синтазы. Недостаточное образование оксида азота приводит к увеличению содержания ионизированного Ca2+ в мышечных клетках пищевода, и поэтому они сокращаются. Аахлазия пищевода также развивается в результате Валлеровской дегенерации аксоплазмы вагуса. Устранение или уменьшение степени влияния на мускулатуру пищевода «ингибиторных нервов» способствует нарушению расслабления нижнего пищеводного сфинктера и увеличению давления в просвете пищевода. Поэтому пищевой комок, попавший в пищевод, встречает препятствие при его продвижении в дистальном направлении. Возникает дисфагия – расстройство глотания, причем наиболее затруднено прохождение по пищеводу твердой пищи. Переполнение пищевода съеденной пищей может вызывать боль и приводить к регургитации (срыгиванию). Возникает расширение участка тела пищевода проксимальнее НПС. Ферментативное расщепление пищи уже в просвете пищевода сопровождается накоплением в нем молочной кислоты и изжогой. Патогенетическим методом лечения ахалазии пищевода является применение нитратов и антагонистов кальциевых каналов, снижающих тонус НПС. Расслабления НПС также можно достичь путем введения в стенку пищевода ботулинического токсина. Снижение тонуса НПС является основным звеном патогенеза гастроэзофагеальной рефлюксной болезни (ГЭРБ). В физиологических условиях заброса кислого желудочного содержимого в пищевод не происходит, так как: ü желудок натощак не содержит остатков пищи. ü НПС, имеющий длину 3-4 см и создающий давление 10-30 мм рт. ст., является анатомическим барьером для проникновения желудочного содержимого в пищевод. Однако НПС кратковременно (не более 20 сек.) расслабляется не более 20-30 раз в 1 час. Это физиологическое явление, связанное с актом глотания или возникающее после приема пищи, представляет собой гастроэзофагеальный рефлюкс. Наличие этого механизма облегчает проникновение пищи в желудок и способствует выходу из него воздуха, случайно попавшего с пищей. ü Правая ножка диафрагмы плотно охватывает нижний сегмент пищевода и механическим путем предотвращает снижение тонуса НПС при увеличении внутрибрюшного давления. ü Координированные перистальтические волны сокращений мускулатуры пищевода, а также выделение слюны, имеющей щелочную реакцию, «нейтрализуют» небольшие количества желудочного содержимого, попавшего в пищевод. Гастроэзофагеальная рефлюксная болезнь характеризуется частыми (более 50 раз в течение часа) эпизодами расслабления НПС, попаданием кислого содержимого желудка в пищевод и повреждением вследствие этого слизистой оболочки пищевода. Причины, приводящие к возникновению ГЭРБ, многочисленные: 1. Растяжение кардиального отдела желудка 2. Значительное увеличение внутрибрюшного давления 3. Наличие грыжи пищеводного отверстия диафрагмы 4. Анатомические нарушения строения НПС 5. Угнетение нормальной перистальтической активности пищевода 6. Гипосаливация, снижение рН слюны 7. Активация блуждающего нерва 8. Функциональные причины: употребление кофе, алкоголя; прием некоторых лекарственных препаратов (антагонистов кальциевых каналов, нитратов, b-адреноблокаторов); увеличение содержания прогестерона в крови или прием синтетических гестагенов; повышение образования вазоинтестинального пептида, оксида азота и гистидинизолейцина, расслабляющих НПС. Если в физиологических условиях рН в пищеводе имеет «щелочные» значения, при ГЭРБ рН в просвете пищевода может снижаться до 4 и менее. В этих условиях возникает повреждение слизистой оболочки пищевода и развивается воспаление – эзофагит. В начальных стадиях заболевания слизистая оболочка пищевода гиперемирована, далее могут появиться линейные эрозии. При прогрессировании заболевания или отсутствии лечения эрозии становятся циркулярными, и, в конце концов, развивается т.н. «пищевод Барретта». Это осложнение ГЭРБ может быть результатом заброса в пищевод не только кислого желудочного содержимого, но при наличии дуоденогастрального рефлюкса – попадания в пищевод желчи. При этом нормальный пищеводный эпителий постепенно замещается на эпителий кишечного типа, т.е. происходит метаплазия пищеводного эпителия, и возрастает риск развития аденокарциномы пищевода. Механизмы развития MALT-лимфомы желудка При длительной хеликобактерной инфекции Риск развития MALT-лимфомы желудка особенно велик при неатрофическом гастрите, вызванном Helicobacter Pylori. Его антигены распознаются антиген-представляющими клетками. Далее, эти клетки представляют соответствующую информацию Т-лимфоцитам, несущим кластеры CD4. CD4-клетки продуцируют цитокины, которые вызывают пролиферацию В-клеток. В геноме В-лимфоцитов в условиях длительной хеликобактерной инфекции могут появляться мутации, и клоны мутированных В-клеток пролиферируют и синтезируют большие количества Ig A, G, M. В-клетки могут дифференцироваться и в зрелые плазматические клетки. Доказательством достоверной связи развития MALT-лимфомы желудка с инфицированием и длительной персистенцией в желудке Helicobacter Pylori является факт регрессирования этой опухоли у 75% пациентов после назначения им «антихеликобактерной» терапии.
СИНДРОМ МАЛЬАБСОРБЦИИ
Синдром мальабсорбции («mal» фр. – «плохой»), или синдром недостаточного всасывания нутриентов наблюдается при различных заболеваниях органов ЖКТ, печени и поджелудочной железы. Фактически, нарушение всасывания нутриентов является следствием нарушения переваривания пищи (мальдигестия) и собственно мальабсорбции. Рассмотрим причины и механизмы возникновения мальабсорбции при некоторых формах патологии. ü Нарушения пищеварения в полости рта. Они имеют место при расстройствах жевания (например, при поражении височно–нижнечелюстного сустава при ревматоидном артрите и других заболе
ü ваниях зубочелюстной системы), а также при уменьшении слюноотделения или изменении качественного состава слюны. Недостаточная секреция слюны (ксеростомия) встречается при радиационном или аутоиммунном поражении слюнных желез, а также при приеме антихолинергических препаратов и некоторых антидепрессантов. При нарушении ротового пищеварения могут страдать процессы переваривания в желудке. ü Расстройства желудочного пищеварения. Синдром мальабсорбции может наблюдаться при снижении и повышении секреторной функции желудка и/или при нарушении его моторной функции. Механизм возникновения мальабсорбции при гиперсекреции и гиперхлоргидрии желудочного сока следующий: желудочное содержимое с более низким, чем в физиологических условиях рН поступает в 12-перстную кишку и далее в тощую кишку. В этих условиях инактивируются многие панкреатические ферменты, и нарушается полостное пищеварение в кишечнике. В том случае, если секреторная функция желудка снижена, нарушения переваривания и всасывания пищи в кишечнике объясняются недостаточной ферментативной обработкой пищи в желудке. ü Нарушения экзокринной функции поджелудочной железы. Они имеют место при хронических панкреатитах, раке и фиброзе поджелудочной железы. В начальной стадии панкреатической недостаточности мальабсорбция обусловлена преимущественным нарушением всасывания жиров из-за уменьшения секреции липазы. При вышеуказанных формах патологии часто уменьшается секреция бикарбонатов клетками поджелудочной железы. Это способствует инактивации липазы, усилению преципитации желчных кислот и ещё большему нарушению переваривания и всасывания жиров. Поэтому в кишечном содержимом значительно возрастает содержание нерасщепленных жиров, что проявляется стеатореей («стеторея» - греч. – «жирный стул»). Далее, при прогрессировании заболевания снижается выделение трипсиногена, химотрипсиногена, проэластазы и карбоксипептидаз, переваривающих белки. Это приводит к нарушению переваривания пептидов и уменьшению всасывания аминокислот в тонком кишечнике. Активность амилазы, расщепляющей углеводы, даже в поздних стадиях заболевания снижена незначительно, и нарушения всасывания углеводов наблюдаются редко. ü Дефицит желчных кислот в просвете кишечника встречается при заболеваниях печени, сопровождающихся нарушениями образования желчи, а также при обструкции желчевыводящих путей (камнями, опухолью, стриктурами, паразитами и др.). При уменьшении поступления желчи в просвет 12-перстной кишки угнетаются процессы эмульгирования жирных кислот, что проявляется стеатореей. Кроме того, страдает всасывание жирорастворимых витаминов А, Д, Е, К, и развиваются признаки их недостаточности. ü Деконъюгация желчных кислот в просвете кишечника. Ее возникновению способствует замедление пассажа кишечного содержимого, например, вследствие диабетической полинейропатии, системных заболеваний соединительной ткани с поражением кишечника; после оперативных вмешательств на кишечнике, когда образуются «слепые петли» кишечника; при наличии дивертикулов кишечника и др. После деконъюгации кишечной микрофлорой желчные кислоты становятся амфифильными, стимулируют секреторную активность энтероцитов и плохо эмульгируют жирные кислоты. ü Нарушения пристеночного пищеварения в тонком кишечнике. Они наблюдаются, если: 1. уменьшается площадь всасывания нутриентов при резекциях тонкого кишечника; при наличии фистул, соединяющих петли тонкого кишечника с желудком; а также при заболеваниях тонкого кишечника, протекающих с повреждениями его слизистой оболочки. 2. нарушаются метаболические процессы, протекающие в энтероцитах. Например, при абеталипопротеинемии энтероциты не способны образовывать хиломикроны и липопротеины. 3. нарушаются процессы транспорта всосавшихся нутриентов из энтероцитов в кровеносные и лимфатические сосуды (при болезни Уиппла, лимфоме кишечника, наследственной лимфоангиэктазии. Рассмотрим некоторые заболевания, приводящие к нарушению пристеночного пищеварения в тонком кишечнике. Целиакия (нетропическая спру, глютеновая энтеропатия) – хроническое наследственное заболевание аутоиммунной природы, характеризующееся непереносимостью глиадина. Глиадин представляет собой один из компонентов белковой фракции глютена, содержащегося в злаковых и бобовых культурах. При этой форме патологии развивается аллергическая реакция IV типа, в результате которой энтероциты утрачивают ворсинки и повреждаются. Наиболее выражены изменения слизистой оболочки проксимальных отделов тонкого кишечника. Наблюдаются выраженная мальабсорбция и диарея. При соблюдении пациентом аглютеновой диеты может быть достигнута ремиссия. Болезнь Уиппла – редкое системное заболевание с преимущественным воспалительным поражением тонкого кишечника. Для него характерны лихорадка, анемия, лимфаденопатия, артриты, перикардиты, эндокардиты и поражения центральной нервной системы. Возбудителем заболевания является Tropheryma whippelii, имеющий сходство с микобактериями. Возникновению болезни также способствуют нарушения функции Т-лимфоцитов. Морфологические изменения слизистой оболочки тонкого кишечника при болезни Уиппла характеризуются: атрофией ворсинок энтероцитов; углублением крипт и инфильтрацией слизистой оболочки преимущественно макрофагами и плазматическими клетками. Болезнь Крона, НЯК (см. выше). Непереносимость лактозы. Лактоза – один из наиболее распространенных дисахаридов, содержащихся в пище человека. Непереносимость лактозы является следствием дефицита фермента лактазы, расщепляющей этот дисахарид. Недостаточность лактазы может быть врожденной (встречается реже) и приобретенной. Приобретенная форма недостаточности лактазы возникает в результате различных инфекционных заболеваний тонкого кишечника; при глютеновой энтеропатии; лучевых поражениях тонкого кишечника и др. При этом употребление в пищу цельного молока и молочных продуктов сопровождается нарушением переваривания лактозы. Она подвергается ферментативному расщеплению микрофлорой кишечника, что приводит к осмотической диарее. Исключение из диеты молочных продуктов способствует прекращению диареи и предупреждает ее возникновение в дальнейшем. Абеталипопротеинемия наследуется по аутосомно-рецес-сивному типу и характеризуется нарушением образования апопротеина В, необходимого для синтеза ЛПНП. Недостаток апопротеина В приводит к нарушению формирования хиломикронов, в составе которых переваренные жиры транспортируются к клеткам. Эта форма патологии проявляется нарушениями транспорта липидов, изменением формы эритроцитов (акантоцитоз) и гемолитической анемией, демиелинизацией нервных окончаний и атаксией, а также пигментной дегенерацией сетчатки. Радиационный энтерит (лучевая энтеропатия). Радиационный энтерит может быть острым, возникающим в первые 2 нед. после окончания воздействия ионизирующего излучения, и хроническим. Острый радиационный энтерит чаще всего является осложнением лучевой терапии злокачественных новообразований органов брюшной полости. При этом нарушается пролиферация энтероцитов, обнаруживаются их отек и атрофия ворсинок энтероцитов. При хроническом радиационном энтерите чаще встречаются изъязвления слизистой оболочки, слущивание эндотелиоцитов сосудов микроциркуляторного русла кишечника и тромбозы этих микрососудов. Ишемия слизистой оболочки кишечника и нарушения моторной функции кишечника приводят к усилению роста патогенной кишечной микрофлоры и нарушению пассажа пищевых масс по кишечнику. Мальабсорбция сочетается с диареей. Лимфоангиэктазия может быть наследственной и приобретенной. Одним из ее важнейших проявлений является протеинтеряющая энтеропатия. Механизм потерь белка в просвет кишечника следующий: расширение лимфатических сосудов кишечника ® рост в лимфатических сосудах гидростатического давления ® выход лимфы и белков в просвет кишечника. Лимфоангиэктазия наблюдается при болезни Милроя, а также при различных опухолях ЖКТ, ретроперитонеально расположенных лимфомах, туберкулезе и саркоидозе с поражением внутрибрюшных лимфатических узлов, хроническом панкреатите и фиброзе забрюшинной клетчатки. При этих формах патологии нарушается отток лимфы от кишечника. Мальабсорбция характеризуется уменьшением всасывания белков. Ишемическая энтеропатия – результат хронической ишемии брыжейки на фоне закупорки ее сосудов атеросклеротическими бляшками, тромбами или эмболами. Продолжительная ишемия кишечника приводит к повреждению микроворсинок энтероцитов и мальабсорбции. Резекция различных участков тонкой кишки также сопровождается мальабсорбцией. Существует «правило 100 см», которое гласит о том, что при удалении менее 100 см терминального отдела подвздошной кишки нарушается абсорбция желчных кислот, а при резекции свыше 100 см терминального отдела подвздошной кишки выраженность мальабсорбции и диареи увеличиваются из-за прогрессирующего нарушения всасывания жиров.
Осмотическая диарея Она является следствием увеличения содержания в просвете кишечника электролитов, вслед за которыми по градиенту концентрации устремляется вода. Этот механизм диареи наблюдается при: ü Приёме слабительных препаратов (например, солевых слабительных), а так же антацидных препаратов, содержащих Mg 2+; ü Употреблении в пищу продуктов с высоким содержанием в них ксилита, сорбитола, маннитола (ксилит и сорбитол содержатся в жевательных резинках); ü Приёме некоторых лекарственных препаратов (лактулозы, холестирамина, неомицина и др.); ü Наследственном дефиците дисахаридаз (лактазы, сахаразы – изомальтазы, трегалазы). В результате дефицита и/ или нарушения активности этих ферментов нарушается расщепление нереабсорбируемых из просвета кишечника дисахаридов до моносахаридов, способных к всасыванию. При этом реабсорбция воды из просвета кишечника замедляется, и возникает диарея. ü Нарушении всасывания в кишечнике глюкозы, галактозы или фруктозы; ü Целиакии (глютеновой энтеропатии); ü Недостаточности экзокринной функции поджелудочной железы. Механизм возникновения осмотической диареи при этом следующий: недостаточное образование ферментов, участвующих в переваривании углеводов и жиров, приводит к тому, что эти вещества, достигая толстого кишечника, гидролизуются кишечной микрофлорой до органических соединений с невысокой молекулярной массой. Количество этих веществ значительно превышает возможности слизистой оболочки толстого кишечника к их абсорбции. Увеличение осмолярности содержимого толстого кишечника приводит к диарее. Важной особенностью осмотической диареи является её прекращение в течение 2- 3 суток после голодания. Секреторная диарея Эта разновидность диареи возникает в результате значительного повышения секреторной функции эпителиоцитов слизистой оболочки кишечника. Секреторная диарея может быть неинфекционной и инфекционной. Неинфекционная секреторная диарея наблюдается при приёме некоторых слабительных препаратов (сенны, касторового масла, фенолфталеина, бисакодила, и др.); некоторых других лекарственных препаратов (холиномиметиков, ингибиторов холинэстеразы, тиазидных диуретиков и др.); интоксикациях (солями мышьяка, токсинами некоторых грибов и др.). Гормонопродуцирующие опухоли, характеризующиеся избыточной продукцией стимуляторов секреции, также приводят к секреторной диарее. Стимуляторами кишечной секреции являются: вазоинтестинальный пептид (ВИП), ацетилхолин, субстанция Р, серотонин, нейротензин, гистамин, брадикинин, аденозин, эндотелин-1 и др. Рассмотрим некоторые заболевания, обусловленные гиперпродукцией стимуляторов кишечной секреции. ВИПома, или панкреатическая холера – заболевание, обусловленное опухолью клеток поджелудочной железы, вырабатывающих ВИП. Он стимулирует аденилатциклазу эпителиоцитов слизистой оболочки кишечника. В этих клетках увеличивается содержание цАМФ, который вызывает потери со стулом Na+, K+ и воды. При этой форме патологии наблюдаются тяжелая водянистая диарея, гипокалиемия и гипохлоргидрия желудочного сока. Гипохлоргидрия развивается потому, что ВИП ингибирует секрецию соляной кислоты в желудке. Синдром Золлингера – Эллисона (гастринома). Гастринома – опухоль, субстратом которой являются клетки, продуцирующие гастрин. Эта опухоль чаще располагается в поджелудочной железе, реже – в 12-перстной кишке. Гастрин стимулирует продукцию соляной кислоты в желудке. Это приводит, во-первых, к развитию язвенной болезни, и, во-вторых, к возникновению диареи. Диарея при этом заболевании обусловлена тем, что гиперхлоргидрия желудочного сока вызывает закисление содержимого тонкого кишечника. В условиях низких значений рН снижается активность ферментов поджелудочной железы, поступающих в просвет тонкого кишечника. Желчные кислоты преципитируются, и возникает синдром мальабсорбции. Увеличивается секреция воды и солей в просвет кишечника. Карциноидный синдром. Карциноидные опухоли, часто поражающие кишечник и бронхи, могут сопровождаться диареей. Её вызывают избыточные количества серотонина, брадикинина, субстанции Р и гистамина, которые образуются клетками этих опухолей. Медуллярная карцинома щитовидной железы. Клетки этой опухоли секретируют кальциотонин и простагландины, стимулирующие секрецию солей и воды энтероцитами. В настоящее время известно две редко встречающиеся формы наследственной диареи, при которых нарушена абсорбция жидкости из просвета кишечника. Обе эти формы патологии наследуются по аутосомно-рециссивному типу. Наследственная хлоридная диарея возникает в результате мутации гена, ответственного за синтез белка щёточной каемки энтероцитов, осуществляющего Cl-/HCO3- обмен. При этом увеличиваются потери ионов хлора со стулом, рН стула смещается в кислую сторону, а у пациентов часто развивается метаболический алкалоз. Наследственная хлоридная диарея относительно часто встречается в Финляндии, Саудовской Аравии, Кувейте, и реже – в Польше. Наследственная диарея с повышенной секрецией Na+ - следствие мутации гена, кодирующего образования белка щеточной каемки энтероцитов, который обменивает ионы Na+ на протоны Н+. Обе эти формы наследственной диареи проявляются ещё у плода, а у беременной женщины обнаруживают многоводие. Классическим примером заболевания, при котором возникает секреторная инфекционная диарея, является холера. Энтеротоксин Vibrio cholerae состоит из двух субъединиц: А и В. В-субъединицы очень прочно связываются с компонентами щёточной каёмки энтероцитов, а субъединица А ковалентно связывается с a-субъединицей G-протеина, стимулирующего аденилатциклазу. Увеличение образования цАМФ в энтероцитах приводит к повышению секреции ионов Na+. Вслед за Na+ по законам осмоса в просвет кишечника устремляется вода. В содержимом кишечника также возрастает концентрация анионов Cl- и HCO3-. В плазме же крови концентрация Na+, Cl- и HCO3- падает. Диарея при холере выраженная, объём секретируемой жидкости может достигать 10 л/сут, что приводит к гипогидратации, нарушениям электролитного баланса и кислотно-основного равновесия крови. Секреторная инфекционная диарея также встречается при инфицировании человека токсигенными штаммами E. сoli. Эти микроорганизмы образуют два вида энтеротоксинов, вызывающих диарею. Один из них, термолабильный энтеротоксин, активирует аденилатциклазу в энтероцитах, что приводит к увеличению секреции этими клетками ионов Na+, Cl- и HCO3-. Второй, термостабильный энтеротоксин, повышает активность гуанилатциклазы в клетках кишечного эпителия. В результате еще больше возрастает секреция Cl- и HCO3- в просвет кишечника. Попадание некоторых других микроорганизмов в просвет кишечника (Helicobacter jejuni, Yersinia enterocolitica, Clostridium difficile, Staphylococcus aureus и др.) является еще одной частой причиной секреторной диареи. Экссудативная диарея Возникновение этой разновидности диареи обусловлено повреждением эпителиальных клеток кишечника и утратой плотных межклеточных контактов между соседними энтероцитами под действием патогенного фактора. При этом из кровеносных и лимфатических сосудов в просвет кишечника начинают усиленно проникать вода, электролиты, белки и иногда – эритроциты и лейкоциты. По этиологии экссудативная диарея может быть инфекционной и неинфекционной. Инфекционную диарею вызывают патогенные штаммы Shigella, Salmonella, Yersinia, Escherichia, Aeromonas и др., а также некоторые вирусы (ротавирусы, аденовирусы, ВИЧ и др.) и простейшие (амебы). Неинфекционная экссудативная диарея часто встречается у пациентов, страдающих неспецифическим язвенным колитом. Отличительным признаком экссудативной диареи является присутствие в каловых массах примеси крови и высокое содержание полиморфноядерных нейтрофилов.
Моторной функции кишечника Как усиление моторики кишечника, так и ее ослабление могут приводить к диарее. Одним из примеров диареи, развивающейся в результате повышения моторной функции кишечника, является диарея при некоторых разновидностях синдрома раздраженного кишечника. У некоторых таких пациентов миоэлектрическая активность толстого кишечника снижена, зато имеет место дисбаланс нейротрансмиттеров и гиперчувствительность слизистой оболочки толстого кишечника. Это приводит к ускорению пассажа кишечного содержимого и частым дефекациям. Поэтому у таких больных часто отмечается не истинная диарея, а псевдодиарея. Усиленная моторика кишечника также является одним из звеньев патогенеза демпинг-синдрома, развивающегося после удаления желудка или его частей и создании желудочно-кишечных анастомозов. При этом синдроме нарушаются процессы перемешивания пищи, и большое количество химуса поступает в кишечник. Выделение большого количества веществ, стимулирующих моторную и секреторную функции кишечника, спсообствует возникновению диареи в течение первого часа после приема пищи. Ускорение прохождения пищи по кишечнику наблюдается и при гипертирозе, особенно при тиротоксикозе. При этом уменьшается продолжительность переваривания и всасывания жиров, что приводит к диарее и стеаторее. Диарея прекращается при нормализации функции щитовидной железы. Снижение моторной функции кишечника у больных с диабетической полинейропатией, системными заболеваниями соединительной ткани (например, склеродермией, дерматомиозитом), и у пациентов с дивертикулами кишечника также может вызывать диарею. Рассмотрим подробнее механизм ее возникновения при диабетической полинейропатии: некорригируемый (или плохо корригируемый) сахарный диабет ® диабетическая полинейропатия ® дегенерация адренергических нервных окончаний в стенке кишечника ® снижение моторной функции кишечника ® рост патогенной кишечной микрофлоры и колонизация ею верхних отделов толстого и части тонкого кишечника ® деконъюгация и дегидроксилирование патогенной микрофлорой желчных кислот ® уменьшение концентрации в просвете кишечника солей желчных кислот ® нарушение переваривания жиров ® гидроксилирование жиров микрофлорой кишечника с превращением их в амфифильные соединения ® стимуляция секреции кишечными энтероцитами солей и воды ® диарея.
Следствия диареи Выраженная диарея может приводить к гиповолемии, гипо- и дегидратации, нарушениям электролитного баланса и кислотно-основного равновесия крови. Особенно опасна диарея у новорожденных и детей 1-го года жизни, так как обезвоживание у них развивается особенно быстро и вызывает развитие дегидратационного шока, ДВС-синдрома и полиорганной недостаточности. Гибель может наступить от нарушений сердечной деятельности.
Принципы лечения диареи Принципы лечения диареи заключаются в следующем: 1. Лечение начинается после установления причины диареи и основного механизма ее развития. 2. При неинфекционной диарее необходимо лечение основного заболевания, приведшего к ее появлению. 3. При секреторной диарее патогенетически обоснованным является перроральная регидратация, а при невозможности ее выполнения или ее неэффективности осуществляется инфузионная терапия. Целесообразность перроральной регидратации при секреторной диарее объясняется тем, что при этом виде диареи абсорбционная способность энтероцитов, как правило, не нарушена. Растворы для перроральной регидратации, помимо электролитов в изоосмотических концентрациях, должны содержать глюкозу из-за наличия механизмов ее Na+-зависимого транспорта из просвета кишечника в энтероциты. При секреторной диарее также могут использоваться ингибиторы энкефалиназы – фермента, деградирующего энкефалины. В результате их применения в слизистой оболочке кишечника увеличивается содержание энкефалинов, которые обладают антисекреторным действием. 4. При выраженной диарее, вызванной бактериями или простейшими, проводится этиотропная терапия, т.е. назначаются антибиотики или антибактериальные препараты. 5. Диарея, возникающая в результате усиления моторной функции кишечника, требует назначения препаратов, угнетающих ее. Одним из таких препаратов является лоперамид (имодиум). 6. В том случае, если диарея обусловлена гормон-продуцирующей опухолью, необходимо ее удаление. При невозможности оперативного лечения таким пациентам назначают препарат октреотид – аналог соматостатина. Он предотвращает избыточное образование гормоноподобных веществ клетками опухоли и тем самым подавляет секреторную активность энтероцитов. 7. В настоящее время разработаны принципиально новые классы антидиарейных препаратов, которые проходят различные стадии испытаний. К таким препаратам относятся блокаторы анионных каналов энтероцитов и антагонисты цАМФ-зависимых калиевых каналов. По предварительным данным, оба класса этих препаратов эффективно подавляют механизмы возникновения секреторной диареи.
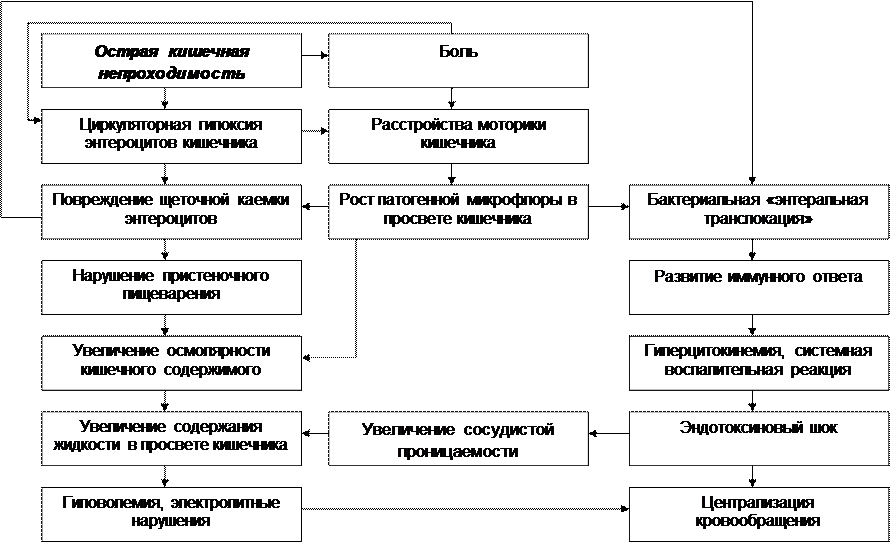
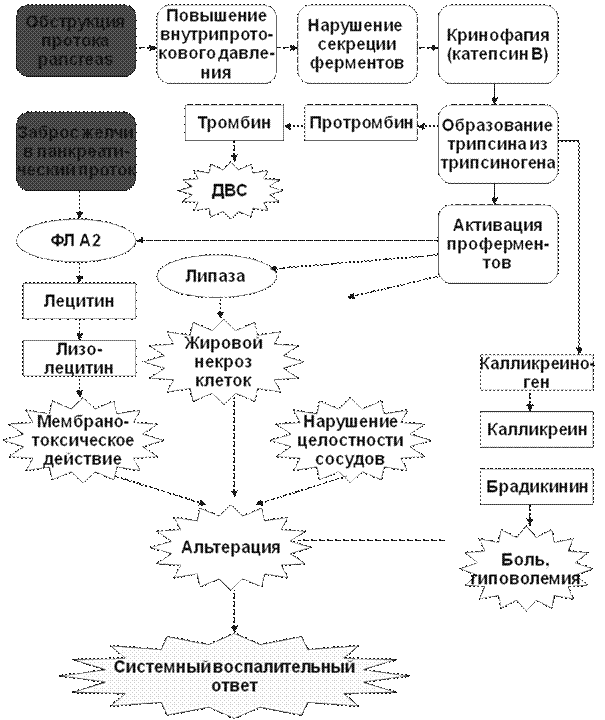
Рис. Патофизиологические механизмы синдрома раздраженного кишечника (Horwitz B.J., Fisher R.S., 2001) ПАНКРЕАТИТЫ Панкреатит – воспалительное заболевание поджелудочной железы, характеризующееся преимущественным поражением ее ацинусов. Различают острый и хронический панкреатит. Острый панкреатит В физиологических условиях клетки поджелудочной железы, продуцирующие пищеварительные ферменты, защищены от самопереваривания благодаря наличию уникальных механизмов. Во-первых, эти ферменты вырабатываются в виде неактивных форм. Во-вторых, субклеточные компартменты, содержащие зимогенные гранулы, анатомически разделены. В-третьих, проферменты в секреторных гранулах упакованы в комплексе с ингибиторами протеаз и окружены белком паракристаллином. И, наконец, в-четвертых, в зимогенных гранулах присутствуют низкие концентрации ионизированного кальция, а рН внутренней среды гранул смещено в кислую сторону, что препятствует преждевременной активации проферментов в клетках поджелудочной железы. При несостоятельности этих механизмов создаются условия для внутриклеточной активации проферментов и самопереваривания (аутодигестии) клеток поджелудочной железы, т.е. для развития острого панкреатита. Причины, вызывающие острый панкреатит, бывают экзогенные и эндогенные. К экзогенным причинам относятся: ü прием больших доз алкоголя, особенно при наличии сопутствующей желчнокаменной болезни (ЖКБ); ü вирусы (эпидемического паротита, Коксаки и др.); ü травмы, хирургические вмешательства, инвазивные диагностические исследования; ü прием некоторых лекарственных препаратов (диуретиков тиазидового ряда, этакриновой кислоты, фуросемида; азатиоприна, вальпроевой кислоты, эстроген-содержащих препаратов, тетрациклина, сульфаниламидов, пентамидина и др.); ü укус скорпиона. Острый панкреатит может быть вызван эндогенными причинами: ü обструкцией общего желчного протока конкрементами при ЖКБ, а также рефлюксом желчи в панкреатические протоки; ü отеком или спазмом сфинктера Одди; ü гиперкальциемией, например, при гиперфункции паращитовидных желез; ü пенетрацией в поджелудочную железу пептической язвы. Дислипопротеинемии I, IV, V типов, заболевания соединительной ткани и почечная недостаточность также часто осложняются развитием острого панкреатита. Иногда точную причину острого панкреатита установить не удается, и в этом случае говорят об идиопатическом остром панкреатите. Патогенез острого панкреатита можно представить в виде схемы: (1) действие патогена ® развитие универсальных механизмов повреждения экзокринных клеток поджелудочной железы («окислительный» и «нитрозилирующий» стресс, уменьшение образования АТФ, увеличение содержания внутриклеточного ионизированного кальция) ® повреждения структуры внутриклеточных микротрубочек и микрофиламентов ® нарушение выделения зимогенных гранул в панкреатические протоки ® ”панкреастаз” ® смешивание содержимого гранул лизосом и зимогенных гранул ® внутриклеточная активация трипсиногена и превращение его в трипсин ® запуск каскада активации остальных проферментов и других биологически активных веществ. Трипсин способен активировать панкреатическую липазу, которая разрушает мембраны клеток поджелудочной железы и вызывает их жировой некроз. Активация фосфолипазы А2 (ФЛ А2) под влиянием трипсина приводит к расщеплению лецитина клеточных мембран до лизолецитина, лизолецитина, обладающего мембранотоксическим действием и усугубляющим выраженность повреждения клеток поджелудочной железы. Трипсин также способствует превращению панкреатической проэластазы в активную эластазу. Последняя нарушает целостность кровеносных сосудов поджелудочной железы и увеличивает их проницаемость, способствуя тем самым усилению отека поджелудочной железы. Кроме того, под влиянием трипсина из калликреиногена образуются большие количества калликреина и брадикинина. Эти медиаторы воспаления способны активировать эндотелиоцитарную конституциональную NO-синтазу кровеносных сосудов не только поджелудочной железы, но и всего организма. Увеличение образования оксида азота в кровеносных сосудах ведет к снижению их тонуса, увеличению их проницаемости, отеку поджелудочной железы и артериальной гипотензии. Брадикинин, взаимодействуя с соответствующими рецепторами, вызывает боль, которая при остром панкреатите может быть нестерпимой; некоторые пациенты характеризуют ее как «чувство вбитого кола в подреберье». Трипсин также способствует превращению протромбина в тромбин, что, совместно с активацией тромбоцитов провоспалительными цитокинами и другими медиаторами воспаления приводит к развитию ДВС-синдрома. (2) Попадание содержимого секреторных гранул в интерстиций поджелудочной железы ® хемоаттрактантное действие компонентов гранул ® привлечение в очаг воспаления клеток лейкоцитарного ряда ® активация нейтрофилов и макрофагов ® выделение в интерстициальное пространство АФК и АФА, а также протеаз – катепсинов B, D, G, коллагеназы и эластазы; образование макрофагами провоспалительных цитокинов ФНО-a, ИЛ-6, ИЛ-8 ® амплификация локального воспаления ® развитие системного воспалительного ответа.
Рис. Патогенез острого панкреатита
Существуют некоторые особенности механизмов возникновения острого панкреатита при действии различных патогенов. Так, одна из наиболее частых причин острого панкреатита – употребление чрезмерных количеств алкого
|
|||||||||||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 329; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.014 с.) |