
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
То есть вся теплота, которую получает газ идёт на изменение его внутренней энергии.Содержание книги
Поиск на нашем сайте Изотермический процесс Первый закон термодинамики для изотермического процесса записывается в виде:
Где подразумевается, что внутренняя энергия системы в изотермическом процессе не изменяется. Изоэнтропийный процесс — процесс изменения состояния термодинамической системы при постоянной энтропии (S=const). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
где 44. Энтропия. Энтропия является функцией состояния термодинамической системы. Отношение общего количества тепла
Например, при температуре 0°C, вода может находиться в жидком состоянии и при незначительном внешнем воздействии начинает быстро превращаться в лед, выделяя при этом некоторое количество теплоты. При этом температура вещества так и остается 0 °C. Изменяется состояние вещества, сопровождающееся выделением тепла, вследствие изменения структуры. Изоэнтропийный процесс — процесс изменения состояния термодинамической системы при постоянной энтропии (S=const). Изоэнтропийным является, например, обратимый адиабатический процесс: в таком процессе не происходит теплообмена с окружающей средой. Идеальный газ в таком процессе описывается следующим уравнением:
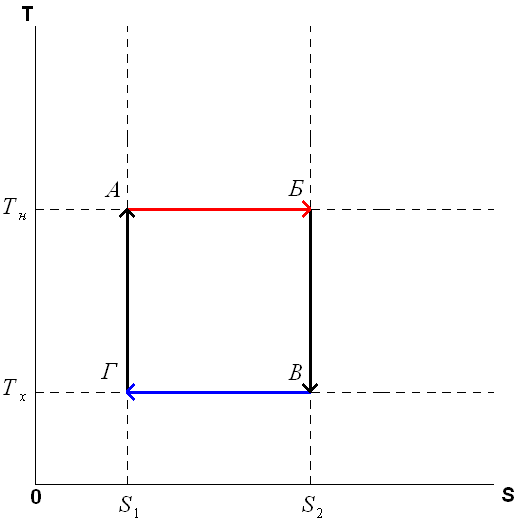
45. Второе начало термодинамики. Цикл Карно и его КПД для идеального газа. Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая, что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю. Цикл Карно́ — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Состоит из 2 адиабатических и 2 изотермических процессов. Описание цикла Карно Пусть тепловая машина состоит из нагревателя с температурой Цикл Карно состоит из четырёх стадий: 1. Изотермическое расширение (на рисунке — процесс A→Б). В начале процесса рабочее тело имеет температуру 2. Адиабатическое (изоэнтропическое) расширение (на рисунке — процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника. 3. Изотермическое сжатие (на рисунке — процесс В→Г). Рабочее тело, имеющее к тому времени температуру 4. Адиабатическое (изоэнтропическое) сжатие (на рисунке — процесс Г→А). Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя. При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия:
КПД тепловой машины Карно Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
Аналогично, при изотермическом сжатии рабочее тело отдало холодильнику
Отсюда коэффициент полезного действия тепловой машины Карно равен
Уравнение Ван-дер-Ваальса Уравнение состояния Для одного моля газа ур-е Ван-дер-Ваальса имеет вид:
Где p — давление, Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка a учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка b — объем молекул газа. Для v молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
Традиционный вывод. Рассмотрим газ, в котором частицы не взаимодействуют друг с другом, такой газ удовлетворяет:
Стоит заметить - вычитаемый объём b не будет в точности равен суммарному объёму всех частиц. Если частицы считать твёрдыми и абсолютно упругими шариками, то вычитаемый объём будет примерно в 4 раза больше. Это объясняется тем, что центры упругих шаров не могут приближаться на расстояние ближе 2r. Далее Ван-дер-Ваальс рассматривает силы притяжения между частицами газа и делает следующие допущения: · Частицы распределённые равномерно по всему объёму. · Силы притяжения стенок сосуда не учитываются, что в общем случае неверно. · Частицы, находящиеся внутри сосуда и непосредственно у стенок, ощущают притяжение по-разному: внутри сосуда действующие силы притяжения других частиц компенсируют друг друга. Таким образом, для частиц внутри сосуда силы притяжения не учитываются. А частицы, находящиеся непосредственно у края сосуда, затягиваются внутрь силой, пропорциональной концентрации: Число частиц, которые находятся непосредственно у стенок, в свою очередь тоже предполагается пропорциональным концентрации n. Можно считать, что давление на стенки сосуда меньше на некоторую величину, обратно пропорциональную квадрату объёма:
И зотермы Ван-дер-Ваальса — кривые зависимости р от V m при заданных Т, определяемые уравнением Ван-дер-Ваальса (61.2) для моля газа. Эти кривые (рассматриваются для четырех различных температур; рис. 89) имеют довольно своеобразный характер. При высоких температурах (T > T к) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре T к на изотерме имеется лишь одна точка перегиба К. Эта изотерма называется критической, соответствующая ей температура T к — критической температурой; точка перегиба К называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем V к, и давление р к называются также критическими. Состояние с критическими параметрами (p к, V к, T к) называется критическим состоянием. При низких температурах (Т < T к) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь. Для пояснения характера изотерм преобразуем уравнение Ван-дер-Ваальса (61.2) к виду
Уравнение (62.1) при заданных р и Т является уравнением третьей степени относительно V m; следовательно, оно может иметь либо три вещественных корня, либо один вещественный и два мнимых, причем физический смысл имеют лишь вещественные положительные корни. Поэтому первому случаю соответствуют изотермы при низких температурах (три значения объема газа V 1, V 2 и V 3 отвечают (символ «m» для простоты опускаем) одному значению давления р 1), второму случаю — изотермы при высоких температурах. Рассматривая различные участки изотермы при T < Т к (рис. 90), видим, что на участках 1 — 3 и 5 — 7 при уменьшении объема V m давление р возрастает, что естественно. На участке 3—5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3—5 означает, что при постепенном изменении объема вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом, истинная изотерма будет иметь вид ломаной линии 7 — 6—2—1. Часть 6–7 отвечает газообразному состоянию, а часть 2 – 1 — жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6—2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным. Данные выводы, следующие из анализа уравнения Ван-дер-Ваальса, были подтверждены опытами ирландского ученого Т. Эндрюса. Отличие экспериментальных (Эндрюс) и теоретических (Ван-дер-Ваальс) изотерм заключается в том, что превращению газа в жидкость в первом случае соответствуют горизонтальные участки, а во втором — волнообразные. Для нахождения критических параметров подставим их значения в уравнение (62.1) в запишем
(символ «m» для простоты опускаем). Поскольку в критической точке все три корня совпадают и равны V к уравнение приводится к виду
Tax как уравнения (62.2) и (62.3) тождественны, то в них должны быть равны и коэффициенты при неизвестных соответствующих степеней. Поэтому можно записать
Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая (рис. 91), ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму р,V m под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний (жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа — область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении. Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса (верхняя кривая на рис. 92), видим, что последняя имеет прямолинейный участок 2 — 6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5— 6 и 2 — 3. Эти неустойчивые состояния называются метастабильными. Участок 2-3 изображает перегретую жидкость, 5—6 — пересыщенный пар. Обе фазы ограниченно устойчивы. При достаточно низких температурах изотерма пересекает ось V m, переходя в область отрицательных давлений (нижняя кривая на рис. 92). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8—9 на нижней изотерме соответствует перегретой жидкости, участок 9—10 — растянутой жидкости.
|
||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 276; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |

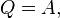

 — показатель адиабаты, определяемый типом газа.
— показатель адиабаты, определяемый типом газа. к величине абсолютной температуры Т (то есть тепло, переданное системе, при постоянной температуре):
к величине абсолютной температуры Т (то есть тепло, переданное системе, при постоянной температуре):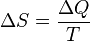 .
. , холодильника с температурой
, холодильника с температурой  и рабочего тела.
и рабочего тела. . При этом объём рабочего тела увеличивается.
. При этом объём рабочего тела увеличивается. .
. при
при  .
.

 .
. .
. .
.
 — молярный объём, T — абсолютная температура, R — универсальная газовая постоянная.
— молярный объём, T — абсолютная температура, R — универсальная газовая постоянная. где V — объём.
где V — объём.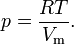 Предположим, что частицы этого газа являются упругими сферами одинакового радиуса r. Так как газ находится в сосуде конечного объёма, то пространство, где могут перемещаться частицы, будет несколько меньше. В исходной формуле следует вычесть из всего объёма некую его часть b. Получается следующее уравнение:
Предположим, что частицы этого газа являются упругими сферами одинакового радиуса r. Так как газ находится в сосуде конечного объёма, то пространство, где могут перемещаться частицы, будет несколько меньше. В исходной формуле следует вычесть из всего объёма некую его часть b. Получается следующее уравнение: 
 .
.
 окончательное уравнение
окончательное уравнение 48. Изотермы Ван-дер-Ваальса и их анализ.
48. Изотермы Ван-дер-Ваальса и их анализ. (62.1)
(62.1)
 (62.2)
(62.2) (62.3) или
(62.3) или
 (62.4). Решая полученные уравнения, найдем
(62.4). Решая полученные уравнения, найдем



