
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опытные законы идеального газа.Содержание книги
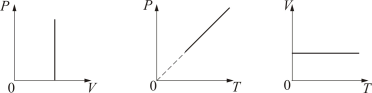
Поиск на нашем сайте В XVII – XIX веках были сформулированы опытные законы идеальных газов. Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным. 1. Изохорический процесс. Закон Шарля. V = const. Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля: При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.
2. Изобарический процесс. Закон Гей-Люссака. Р = const. Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака: При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
Уравнение изобары:
3. Изотермический процесс. Закон Бойля – Мариотта. T = const. Изотермическим процессом называется процесс, протекающий при постоянной температуре Т. Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта: При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
Уравнение изотермы:
4. Адиабатический процесс (изоэнтропийный): Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой. 5. Политропический процесс. Процесс, при котором теплоёмкость газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов. 6. Закон Авогадро. При одинаковых давлениях и одинаковых температурах, в равных объёмах различных идеальных газов содержится одинаковое число молекул. В одном моле различных веществ содержится NA =6,02·1023 молекул (число Авогадро). 7. Закон Дальтона. Давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в неё газов:
Парциальное давление Pn – давление, которое оказывал бы данный газ, если бы он один занимал весь объем. При
8. Объединённый газовый закон (Закон Клапейрона).
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 215; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.006 с.) |



 .
.



 , давление смеси газов:
, давление смеси газов:
 29. Уравнение Клапейрона-Менделеева.
Уравнение имеет вид:
29. Уравнение Клапейрона-Менделеева.
Уравнение имеет вид:
 ,
где
· р — давление,
·
,
где
· р — давление,
·  — молярный объём,
· R — универсальная газовая постоянная
· T — абсолютная температура, К.
Так как
— молярный объём,
· R — универсальная газовая постоянная
· T — абсолютная температура, К.
Так как  , где
, где  — количество вещества, а
— количество вещества, а  , где m — масса, M — молярная масса, уравнение состояния можно записать:
, где m — масса, M — молярная масса, уравнение состояния можно записать:
 30. Основное уравнение молекулярно-кинетической теории идеальных газов.
Основное уравнение МКТ
30. Основное уравнение молекулярно-кинетической теории идеальных газов.
Основное уравнение МКТ
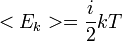 , где k является постоянной Больцмана, i — число степеней свободы молекул, T - абсолютная температура.
Вывод основного уравнения МКТ
Пусть имеется кубический сосуд с ребром длиной l и одна частица массой m в нём.
Обозначим скорость движения
, где k является постоянной Больцмана, i — число степеней свободы молекул, T - абсолютная температура.
Вывод основного уравнения МКТ
Пусть имеется кубический сосуд с ребром длиной l и одна частица массой m в нём.
Обозначим скорость движения  , тогда перед столкновением со стенкой сосуда импульс частицы равен
, тогда перед столкновением со стенкой сосуда импульс частицы равен  , а после —
, а после —  , поэтому стенке передается импульс
, поэтому стенке передается импульс  . Время, через которое частица сталкивается с одной и той же стенкой, равно
. Время, через которое частица сталкивается с одной и той же стенкой, равно  .
Отсюда следует:
.
Отсюда следует:
 Так как давление
Так как давление  , следовательно сила
, следовательно сила  Подставив, получим:
Подставив, получим:  Преобразовав:
Преобразовав:  Так как рассматривается кубический сосуд, то
Так как рассматривается кубический сосуд, то  Отсюда:
Отсюда:
 .
Соответственно,
.
Соответственно,  и
и  .
Таким образом, для большого числа частиц верно следующее:
.
Таким образом, для большого числа частиц верно следующее:  , аналогично для осей y и z.
Поскольку
, аналогично для осей y и z.
Поскольку  , то
, то 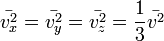 . Это следует из того, что все направления движения молекул в хаотичной среде равновероятны.
Отсюда
. Это следует из того, что все направления движения молекул в хаотичной среде равновероятны.
Отсюда  или
или  .
Пусть
.
Пусть  — среднее значение кинетической энергии всех молекул, тогда:
— среднее значение кинетической энергии всех молекул, тогда:
 , откуда, используя то, что
, откуда, используя то, что  (количество вещества), а
(количество вещества), а  , имеем
, имеем  .
31. Закон Максвелла для распределения идеального газа по скоростям и энергиям теплового движения.
Закон Максвелла о распределении молекул идеального газа по скоростям основан на предположениях, что газ состоит из большого числа N одинаковых молекул, его температура постоянна, а молекулы совершают тепловое хаотическое движение. При этом на газ не действуют силовые поля.
Функция распределения молекул по скоростям f(v)=dN(v)/Ndv определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv и имеет смысл плотности вероятности.
Для газа, подчиняющегося классической механике, в состоянии статистического равновесия функция распределения f Максвелла по скоростям имеет вид:
f(v) =n(m/2pkT)3/2exp(-mv2/2kT),
Где m — масса молекулы, Т — абсолютная температура системы, k — постоянная Больцмана.
Значение функции распределения f(v) зависит от рода газа (от массы молекул) и от температуры.
С помощью распределения Максвелла можно вычислять средние значения скоростей молекул и любых функций этих скоростей. В частности, средняя квадратичная скорость v2=3kT/m, а средняя скорость молекулы v= (8kT/pm)1/2.
Распределение по энергии
Наконец, используя соотношения
.
31. Закон Максвелла для распределения идеального газа по скоростям и энергиям теплового движения.
Закон Максвелла о распределении молекул идеального газа по скоростям основан на предположениях, что газ состоит из большого числа N одинаковых молекул, его температура постоянна, а молекулы совершают тепловое хаотическое движение. При этом на газ не действуют силовые поля.
Функция распределения молекул по скоростям f(v)=dN(v)/Ndv определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dv и имеет смысл плотности вероятности.
Для газа, подчиняющегося классической механике, в состоянии статистического равновесия функция распределения f Максвелла по скоростям имеет вид:
f(v) =n(m/2pkT)3/2exp(-mv2/2kT),
Где m — масса молекулы, Т — абсолютная температура системы, k — постоянная Больцмана.
Значение функции распределения f(v) зависит от рода газа (от массы молекул) и от температуры.
С помощью распределения Максвелла можно вычислять средние значения скоростей молекул и любых функций этих скоростей. В частности, средняя квадратичная скорость v2=3kT/m, а средняя скорость молекулы v= (8kT/pm)1/2.
Распределение по энергии
Наконец, используя соотношения  и
и  , мы получаем распределение по кинетической энергии:
, мы получаем распределение по кинетической энергии:
 32. Барометрическая формула.
Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести.
Для идеального газа, имеющего постоянную температуру Т и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения g одинаково), барометрическая формула имеет следующий вид:
32. Барометрическая формула.
Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести.
Для идеального газа, имеющего постоянную температуру Т и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения g одинаково), барометрическая формула имеет следующий вид:
 где p — давление газа в слое, расположенном на высоте h,
где p — давление газа в слое, расположенном на высоте h,  — давление на нулевом уровне (
— давление на нулевом уровне ( ), M — молярная масса газа, R — газовая постоянная, T — абсолютная температура. Из барометрической формулы следует, что концентрация молекул n (или плотность газа) убывает с высотой по тому же закону:
), M — молярная масса газа, R — газовая постоянная, T — абсолютная температура. Из барометрической формулы следует, что концентрация молекул n (или плотность газа) убывает с высотой по тому же закону:
 где m — масса молекулы газа, k — постоянная Больцмана.
где m — масса молекулы газа, k — постоянная Больцмана.



