Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Автор: ст. викл. Назаренко Н.С.Содержание книги Поиск на нашем сайте
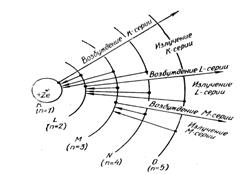
Лекція 13. "Радіоактивність. Види радіоактивності. Ядерні реакції, отримання радіонуклідів. Іонізуюче випромінювання, взаємодія з речовиною Використання радіонуклідів в медицині". Вкажіть вид радіоактивного розпаду
а) альфа – розпад; б) гамма – розпад; в) електронний бета – розпад; г) позитронний бета – розпад. Вкажіть вид радіоактивного розпаду
а) альфа – розпад; б) гамма – розпад; в) електронний бета – розпад; г) позитронний бета – розпад. 3. Альфа – випромінювання - це … а) потік позитронів; б) потік нейтронів; в) потік протонів; г) потік ядер атому гелія. 4. Бета – випромінювання - це … а) потік електронів або позитронів; б) потік нейтронів або протонів; в) потік ядер атому гелія; г) електромагнітні хвилі. 5. Гамма – випромінювання - це … а) потік протонів; б) потік нейтронів; в) потік електронів; г) електромагнітні хвилі. 6. Якщо в нестійкому ядрі є надлишок протонів, то відбувається … а) електронний бета - розпад; б) альфа-розпад; в) позитронний бета-розпад; г) гамма-розпад. 7. Якщо в нестійкому ядрі є надлишок нейтронів, то відбувається … а) електронний бета - розпад; б) альфа - розпад; в) позитронний бета - розпад; г) гамма - розпад.
Вкажіть, яке з перетворень в ядрі відповідає альфа-розпаду? а)
Вкажіть, яке з перетворень в ядрі відповідає електронному бета-розпаду?
Приклад якого радіоактивного розпаду вказано
а) альфа - розпад б) електронний бета – розпад в) позитронний бета – розпад г) гамма – розпад. До складу атома літію входить 3 електрони, 3 протони та 4 нейтрони. Визначте його масове число. а) 6 б) 7 в) 4 г) 10 12. Внаслідок електрон-позитронної анігіляції утворюється … а) 1 фотон; б) 2 фотони; в) 3 фотони; г) 4 фотони. 13. Основою позитронно емісійної томографії є явище … а) анігіляції; б) коагуляції; в) кавітації; г) поляризації. 14. За проміжок часу, що дорівнює 2 періодам піврозпаду, кількість ядер, які не розпались, становить … а) 20 % від початкової кількості; б) 25 % від початкової кількості; в) 50 % від початкової кількості; г) 75 % від початкової кількості. 15. За проміжок часу, що дорівнює 2 періодам піврозпаду, кількість ядер, які розпались, становить … а) 25 % від початкової кількості; б) 75 % від початкової кількості; в) 50 % від початкової кількості; г) 20 % від початкової кількості. 16. Яку кількість нейтронів містить ядро хімічного елемента 6N14? а) 6 б) 8 в) 14 г) 20 17. Яке з радіоактивних випромінювань не відхиляється магнітним полем? а) α - випромінювання б) електронне β - випромінювання в) γ – випромінювання г) протонне β – випромінювання. Яка з елементарних частинок Х називається протоном? а) -1X0 б) 1X1 в) 0X1 г) -1X1 19. Активність радіоактивної речовини з часом … а) збільшується за лінійним законом б) збільшується за експоненціальним законом в) зменшується за лінійним законом г) зменшується за експоненціальним законом 20. Одиницею вимірювання еквівалентної дози іонізуючого випромінювання в SI є … а) рентген б) грей в) зиверт г) керма Автор: ст. викл. Дідич В.М. Лекція № 14: "ОСНОВНІ УЯВЛЕННЯ КВАНТОВОЇ МЕХАНІКИ. ВИПРОМІНЮВАННЯ І ПОГЛИНАННЯ ЕНЕРГІЇ АТОМАМИ, МОЛЕКУЛАМИ " Тестові питання до дифзаліку (Підготував ст.викл. Желіба В.Т._27/4/2014)
Питання 1. Вибрати Рисунок, що відповідає Планетарній моделі атома Резерфорда: А) Питання 2. Які затруднення щодо Планетарної моделі атому Резерфорда спричинили подальшу необхідність удосконалення моделі атома: А) Лінійчатість спектрів випромінювання іі поглинання; Б) відсутність факту швидкого припинення існування атому, що перебувае в стаціонарному стані. В) Лінійчатість спектрів випромінювання і поглинання та відсутність факту швидкого припинення існування атому, що перебувае в стаціонарному стані. Г) Існування явища випромінювання та поглинання енергії атомом. Питання 3. Які факти (результати) вивчення природи речовини спонукав до висновку про притаманність атомам речовини квантових властивостей: А) Лінійчатість спектрів випромінювання іі поглинання (Рис.1) Та відсутність факту швидкого припинення існування атому (Рис.2), що перебувае в стаціонарному стані.
Г) Затруднення пояснити поцеси випромінювання більш складними атомами, ніж водень. Питання 4. В чому полягала геніальна «здогадка» Гейзенберга щодо поведінки електрона в атомі. А) Н еперервної траєкторії руху електрона в атомі НЕМАЄ! Е лектрон не буває «між» стаціонарними станами, наприклад, Б) Рух електрону в атомі не можна уявляти собі як рух малої кульки по траєкторіі. В) Електрон в атомі не можна розглядати як матеріальну частинку. Г) Електронам в атомі властива здатність дифрагувати та інтеферувати.
А) Електрони, які рухаються в атомі на окремих стаціонарних рівнях, не випромінюють і не поглинають електромагнітних хвиль.
В) Рух електрону в атомі не можна уявляти собі як рух малої кульки по траєкторіі. Г) Два доповнення: 1. Електрони, які рухаються в атомі на окремих стаціонарних рівнях, не випромінюють і не поглинають електромагнітних хвиль. 2. При переході електрона з однієї стаціонарної орбіти на іншу, наприклад, з 2-ої на 1-шу – випромінюється квант енергії
або поглинається квант енергії (з 1-шої на 2-гу), який дорівнює різниці енергій цих двох стаціонарних рівнів атома: n=1 та n=2. Питання 6. Вкажіть запис Першого Постулату Бора. А) Електрони, які рухаються в атомі на окремих стаціонарних рівнях, не випромінюють і не поглинають електромагнітних хвиль. Б) При переході електрона з однієї стаціонарної орбіти на іншу, наприклад, з 2-ої на 1-шу – випромінюється квант енергії В) Електрони, які рухаються в атомі на окремих стаціонарних рівнях, не випромінюють і не поглинають електромагнітних хвиль. Тільки при переході електрона з одного енергетичного рівня на інший відбувається випромінювання кванту енергії: Г) всякий мікрооб'єкт, будь то молекула, атом, електрон або фотон, являє собою утворення особливого роду, що поєднує в собі властивості і хвилі і частинки; при цьому мікротела не ведуть себе ні як частка, ні як хвиля. Питання 7. На основі 2-го постулату Бора знайдіть правильну відповідь з
А) атом випромінює (наприклад, при переході в Ne): з E1 на E5 ; Б) атом випромінює (наприклад, при переході в Ne): з Е5 на Е3 ; В) атом випромінює (наприклад, при переході в Не): тільки з Е'1 на Е'2; Г) атом не випромінює, а поглинає енергію (наприклад, при переході в Ne): з Е5 на Е3 та Е6; з Е4 на Е3; з Е3 на Е2; з Е2 на Е1. Питання 8. В чому полягає суть к орпускулярно - хвильового дуалізму речовини? А) Під часруху частинка (m ≠ 0) повинна проявляти хвильові властивості. Більшою мірою це відноситься до руху ( 𝓿 ⋍ С) електрона в атомі. Б)електродинаміка забороняє електрону рухатися в атомі лише по траєкторії і не відповідає за явища, які відбуваються при інших типах рухів. Все це означає, що в атомі електрони існують не у вигляді частинок (m = 0), а у вигляді деяких хвиль. В) Вквантовій фізиці з урахуванням хвильових властивостей частинок показано, що у частинки не існує одночасно точних значень координат і імпульсу і що ці величини між собою навіть не пов`язані. Г) За твердженнямПланетарної моделі атома: в центрі знаходиться ядро, що має позитивний заряд, а електрон – частинка, заряджена від’ємно, рухається навколо ядра по орбіті; Для нерелятивистской частинки, швидкість якої менше швидкості світла 𝓿 << c (c = 3· λ = Питання 9. Знайдіть формулу де Бройля і вірне пояснення до неї: А) λ = Б) ε = h ·ω, де ω = 2πν – колова частота коливань випромінювання кванта, Планка. В) ℏ = Г) | Ψ |2 = Питання 10. Знайдіть символ (запис) та вірне пояснення того, що визначають за допомогою головного квантового числа.
Рис. 2 Рис. 1
l і = s p, d, f, g, …
і пов'язаного з ним власного магнітного моменту е л е к т р о н а:
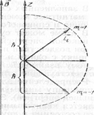
Питання 11. Знайдіть символ (запис) та пояснення того, що визначають за допомогою орбітального квантового числа. 1. n = 1, 2, 3, …; воно визначає дозволену енергію електрона обумовлену його взаємодією з ядром; за моделлю Резерфорда-Бора - визначають порядкові номери орбіт та їх радіуси (для еліптичних орбіт – велику напіввісь b – Рис.). Кожному значенню n відповідає свій енергетичний рівень. З збільшенням n квантовані значення енергії збільшуються, зростає розмір електронної хмари. 2. l і - визначає дозволені значення моменту кількості руху (імпульсу) електрона по орбіті:
l і = s p, d, f, g, …
4. і м п у л ь с у е л е к т р о н а -
Рис. Питання 12. Знайдіть символ (запис) та пояснення того, що визначають за допомогою магнітного квантового числа.
Кожному значенню n відповідає свій енергетичний рівень. З збільшенням n квантовані значення енергії збільшуються, зростає розмір електронної хмари. 2. l і - визначає дозволені значення моменту кількості руху (імпульсу) електрона по орбіті (рис.1):
д е s, p, d, f, g, …
4. і м п у л ь с у е л е к т р о н а -
Питання 13. Знайдіть символ (запис) та пояснення того, що визначають за допомогою спінового квантового числа.
Кожному значенню n відповідає свій енергетичний рівень. З збільшенням n квантовані значення енергії збільшуються, зростає розмір електронної хмари.
2. l і - визначає дозволені значення моменту кількості руху (імпульсу) електрона (рис.1) по орбіті:
l і = s p, d, f, g, …
3. m l - визначає можливу просторову орієнтацію електронних орбіт (рис.) в зовнішньому магнітному полі з індукцією 4.
Рис.
Питання 14. Рівняння Шредінгера. А) ℏ =
Б) | Ψ |2 =
В) Г) λ = Питання 15. Хвильова функція та її фізичний зміст. А) s = Acos ⦋ ω(t – Б) λ = швидкості світла υ << c (c = 3· В) де x- координата поширення хвилі; ℏ = Ψ - хвильова функція;
Г) Ψ = Ψ0 cos(ωx + φ0), де Ψ- хвильова функція. Фізичний зміст хвильової функції: | Ψ |2 = - це квадрат модуля хвильової функції | Ψ | 2 визначає об’ємну густину ймовірності Отже, за цією функцією можна визначити ймовірність знаходження електрону ев наперед визначеному просторі атому, об’єм якого Питання 16. Співвідношення невизначеностей Гейзенберга (в записаних формулах: ∆x - координата частинки; π = 3,14; h, ℏ = h / 2π – постійна Планка; m - маса матеріальної частинки; Δ𝓿 – швидкість руху частинки; r – радіус стаціонарної орбіти Електрона). А)
А) Це номер орбіти, на якій знаходиться електрон в атомі: n1=1; n2 = 2; n3 = 3; … Б) Це місце на орбіті електрона в атомі. В) Це значення енергії атома, визначеної для певного стану електрона в атомі Г) Це значення дозволеної енергії, яку може мати квантова система, наприклад атома тощо. Питання 18. Принцип Паулі. Примітка: Електрон, який під'єднується до атома, посідає в ньому вільний рівень з найменшою енергією. А) В атомі не може бути двох або більше електронів з 4 - ма однаковими квантовими числами n, Б) В атомі не може бути двох або більше електронів з 2 - ма однаковими квантовими числами Г) В атомі не може бути двох або більше електронів з 2 - ма однаковими квантовими числами n.
б) в) г)
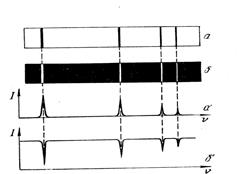
Питання 20. Атом водню має 4-ри найяскравіші лінії: червону, блакитну, синю, фіолетову (див. Рисунок 1.). Вкажіть з якого енергетичного рівня на який здійснює перехід атом водню, якщо утворюється с иня лінія випромінювання?
Рисунок 1. а) з n=4 на n=2; б) з n=2 на n=3; в) n=5 на n=2; г) з n=4 на n=3; Автор: cт. викладач кафедри БІтаМА Желіба В.Т.
|
||||
|
Последнее изменение этой страницы: 2016-06-29; просмотров: 417; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.1.100 (0.009 с.) |

 19К40 20Са40 + -1е0
19К40 20Са40 + -1е0 б) Z XA 2 α4 + Z-2 XA-4
б) Z XA 2 α4 + Z-2 XA-4 в) Z XA 2 α4 + Z-2 XA+4
в) Z XA 2 α4 + Z-2 XA+4 г) Z XA 2 α4 + Z-1 XA + γ
г) Z XA 2 α4 + Z-1 XA + γ а) 1p1 0n1 + +1e0 + γ
а) 1p1 0n1 + +1e0 + γ б) 1n1 1p1 + -1e0 + γ
б) 1n1 1p1 + -1e0 + γ в) - 1е0 + +1e0 2 γ
в) - 1е0 + +1e0 2 γ 15Р30 14Si30 + +1e0 + γ
15Р30 14Si30 + +1e0 + γ Б)
Б)  В)
В)  Г)
Г) 
 Б) Існування явища випромінювання та поглинання енергії атомом - Рис.1.(Для водню).
Б) Існування явища випромінювання та поглинання енергії атомом - Рис.1.(Для водню).

 В) Завдяки запропонованій Резерфордом Планетарної моделі атома: в центрі знаходиться ядро, що має позитивний заряд, а електрон – частинка, заряджена від’ємно, рухається навколо ядра по орбіті.
В) Завдяки запропонованій Резерфордом Планетарної моделі атома: в центрі знаходиться ядро, що має позитивний заряд, а електрон – частинка, заряджена від’ємно, рухається навколо ядра по орбіті.
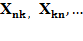 Але є «ДЕЩО» і це «ДЕЩО» повинно залежати тільки від того, КУДИ перейшов електрон і ЗВІДКИ він прийшов: з
Але є «ДЕЩО» і це «ДЕЩО» повинно залежати тільки від того, КУДИ перейшов електрон і ЗВІДКИ він прийшов: з  або з
або з 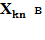
 де n та k – номери кінцевого та початкового стану електрона.
де n та k – номери кінцевого та початкового стану електрона. Питання 5. Які доповнення Бора до моделі атома Резерфорда дозволили перейти від планетарної моделі атома Резерфорда до квантово-механічної моделі Резерфорда-Бора? ( використати рис.)
Питання 5. Які доповнення Бора до моделі атома Резерфорда дозволили перейти від планетарної моделі атома Резерфорда до квантово-механічної моделі Резерфорда-Бора? ( використати рис.) Б) При переході електрона з однієї стаціонарної орбіти на іншу (рис.), наприклад, з 2-ої на 1-шу – випромінюється квант енергії:
Б) При переході електрона з однієї стаціонарної орбіти на іншу (рис.), наприклад, з 2-ої на 1-шу – випромінюється квант енергії: 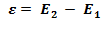 , або поглинається квант енергії (при переході з 1-шої на 2-гу), який дорівнює різниці енергій цих двох стаціонарних рівнів атома:
, або поглинається квант енергії (при переході з 1-шої на 2-гу), який дорівнює різниці енергій цих двох стаціонарних рівнів атома: 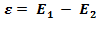 .
.
 ,
,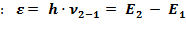 , або поглинається квант енергії (з 1-шої на 2-гу), який дорівнює різниці енергій цих двох стаціонарних рівнів атома.
, або поглинається квант енергії (з 1-шої на 2-гу), який дорівнює різниці енергій цих двох стаціонарних рівнів атома. .
. Рис.1
Рис.1 ), довжина хвилі речовини λ може бути визначена за формулою:
), довжина хвилі речовини λ може бути визначена за формулою:
 , де
, де  – постійна Планка,
– постійна Планка, 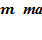
 маса та швидкість руху електрона в атомі.
маса та швидкість руху електрона в атомі. , де
, де  , де dРе - ймовірність знаходження електрона в просторі
, де dРе - ймовірність знаходження електрона в просторі  свого атома.
свого атома. 1. n = 1, 2, 3, …; воно визначає дозволену енергію електрона обумовлену його взаємодією з ядром; за моделлю Резерфорда-Бора - визначають порядкові номери орбіт та їх радіуси (для еліптичних орбіт – велику напіввісь b – Рис.).
1. n = 1, 2, 3, …; воно визначає дозволену енергію електрона обумовлену його взаємодією з ядром; за моделлю Резерфорда-Бора - визначають порядкові номери орбіт та їх радіуси (для еліптичних орбіт – велику напіввісь b – Рис.). Кожному значенню n відповідає свій енергетичний рівень. З збільшенням n квантовані значення енергії збільшуються, зростає розмір електронної хмари.
Кожному значенню n відповідає свій енергетичний рівень. З збільшенням n квантовані значення енергії збільшуються, зростає розмір електронної хмари. 2. l і - визначає дозволені значення моменту кількості руху (імпульсу) електрона (рис.1) по орбіті:
2. l і - визначає дозволені значення моменту кількості руху (імпульсу) електрона (рис.1) по орбіті:  (в моделі Бора-Зомерфельда – дозволені співвідношення малої a та великої b півосей еліптичних орбіт (рис. 2):
(в моделі Бора-Зомерфельда – дозволені співвідношення малої a та великої b півосей еліптичних орбіт (рис. 2):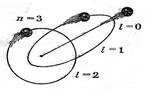



 , де
, де  = 0, 1, 2, 3, 4, …, (п — 1).
= 0, 1, 2, 3, 4, …, (п — 1).
 3. m l- визначає можливу просторову орієнтацію електронних орбіт (рис.) в зовнішньому магнітному полі з індукцією
3. m l- визначає можливу просторову орієнтацію електронних орбіт (рис.) в зовнішньому магнітному полі з індукцією  моменту імпульсу електрона
моменту імпульсу електрона  , і пов'язаного з ним магнітного моменту
, і пов'язаного з ним магнітного моменту  . Можлива така орієнтація вектора
. Можлива така орієнтація вектора  на даний напрямок Z - Z є кратною ℏ
на даний напрямок Z - Z є кратною ℏ 4.
4.  : в и з н а ч а є м о ж л и в і о р і є н т а ц і ї в л а с н о г о м о м е н т у і м п у л ь с у
: в и з н а ч а є м о ж л и в і о р і є н т а ц і ї в л а с н о г о м о м е н т у і м п у л ь с у 

 (рис.).
(рис.). (в моделі Бора-Зомерфельда – дозволені співвідношення малої a та великої b півосей еліптичних орбіт (рис.):
(в моделі Бора-Зомерфельда – дозволені співвідношення малої a та великої b півосей еліптичних орбіт (рис.):


 , де
, де  = 0, 1, 2, 3, 4, …, (п — 1).
= 0, 1, 2, 3, 4, …, (п — 1). 3.m l - визначає можливу просторову орієнтацію електронних орбіт (рис.) в зовнішньому магнітному полі з індукцією
3.m l - визначає можливу просторову орієнтацію електронних орбіт (рис.) в зовнішньому магнітному полі з індукцією  моменту імпульсу електрона
моменту імпульсу електрона  , і пов'язаного з ним орбітального магнітного моменту
, і пов'язаного з ним орбітального магнітного моменту  . Можлива така орієнтація вектора
. Можлива така орієнтація вектора  на даний напрямок Z - Z є кратною ℏ.
на даний напрямок Z - Z є кратною ℏ. : в и з н а ч а є м о ж л и в і о р і є н т а ц і ї в л а с н о г о м о м е н т у
: в и з н а ч а є м о ж л и в і о р і є н т а ц і ї в л а с н о г о м о м е н т у і пов'язаного з ним власного магнітного моменту
і пов'язаного з ним власного магнітного моменту (рис.).
(рис.).

 1. n = 1, 2, 3, …; воно визначає дозволену енергію електрона обумовлену його взаємодією з ядром; за моделлю Резерфорда-Бора - визначають порядкові номери орбіт та їх радіуси (для еліптичних орбіт – велику напіввісь b – Рис.).
1. n = 1, 2, 3, …; воно визначає дозволену енергію електрона обумовлену його взаємодією з ядром; за моделлю Резерфорда-Бора - визначають порядкові номери орбіт та їх радіуси (для еліптичних орбіт – велику напіввісь b – Рис.). (в моделі Бора-Зомерфельда – дозволені співвідношення малої a та великої b півосей еліптичних орбіт (рис. 2):
(в моделі Бора-Зомерфельда – дозволені співвідношення малої a та великої b півосей еліптичних орбіт (рис. 2):
 l і =
l і = 


 1. n = 1, 2, 3, …; воно визначає дозволену енергію електрона обумовлену його взаємодією з ядром; за моделлю Резерфорда-Бора - визначають порядкові номери орбіт та їх радіуси (для еліптичних орбіт – велику напіввісь b – Рис.).
1. n = 1, 2, 3, …; воно визначає дозволену енергію електрона обумовлену його взаємодією з ядром; за моделлю Резерфорда-Бора - визначають порядкові номери орбіт та їх радіуси (для еліптичних орбіт – велику напіввісь b – Рис.).






 де x - координата поширення хвилі;
де x - координата поширення хвилі; - постійна Планка; Ψ- хвильова функція;
- постійна Планка; Ψ- хвильова функція; 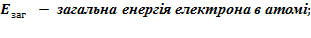


 ;
; − маса електрона).
− маса електрона). , де
, де  Ψ- хвильова функція;
Ψ- хвильова функція;
 , де
, де  - постійна Рідберга, k – номер енергетичного рівня, з якого електрон при випромінюванні атома, перейшов на рівень n;
- постійна Рідберга, k – номер енергетичного рівня, з якого електрон при випромінюванні атома, перейшов на рівень n;  - частота випромінювання кванта атомом.
- частота випромінювання кванта атомом. , де для нерелятивистской частинки масою m, швидкість якої менше швидкості світла υ << c (c = 3·
, де для нерелятивистской частинки масою m, швидкість якої менше швидкості світла υ << c (c = 3·  ), λ – довжина хвилі, h - постійна Планка.
), λ – довжина хвилі, h - постійна Планка. ) ] – рівняння хвилі частинки;
) ] – рівняння хвилі частинки;  швидкість поширення хвилі; зміст: визначае зміщення S матеріальної частинки від положення рівноваги в будь-якій точці простору (в даному випадку – з координатою
швидкість поширення хвилі; зміст: визначае зміщення S матеріальної частинки від положення рівноваги в будь-якій точці простору (в даному випадку – з координатою  ).
).


 − маса електрона).
− маса електрона). знаходження електрону е в певному місці електронної хмарки атома.
знаходження електрону е в певному місці електронної хмарки атома.
 імпульс частинки (наприклад, електрона);
імпульс частинки (наприклад, електрона); · ∆x ≥ ℏ; Б)
· ∆x ≥ ℏ; Б)  Питання 17. Що в квантовій механіці розуміють під поняттям «Енергетичні рівні»?
Питання 17. Що в квантовій механіці розуміють під поняттям «Енергетичні рівні»? ,
,  і
і 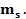
 . В) В атомі не може бути двох або більше електронів з 2 - ма однаковими квантовими числами
. В) В атомі не може бути двох або більше електронів з 2 - ма однаковими квантовими числами  .
. Питання 19. Атом водню з 4-х найяскравіших ліній: червону, блакитну, синю, фіолетову (див. рисунок 1.). Вкажіть з якого енергетичного рівня на який ( відповідно до наведеного Рисунка 1. ) здійснює перехід (переміщення) атом водню, якщо утворюється червона лінія випромінювання:
Питання 19. Атом водню з 4-х найяскравіших ліній: червону, блакитну, синю, фіолетову (див. рисунок 1.). Вкажіть з якого енергетичного рівня на який ( відповідно до наведеного Рисунка 1. ) здійснює перехід (переміщення) атом водню, якщо утворюється червона лінія випромінювання: ; з 1 на 5.
; з 1 на 5. ; з 2 на 5.
; з 2 на 5. ; з 3 на 2.
; з 3 на 2. з 2 на 5.
з 2 на 5.