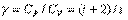Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос 19Первое начало термодинамикиСодержание книги
Поиск на нашем сайте
Рассмотрим термодинамическую систему, для которой механическая энергия не изменяется, а изменяется только ее внутренняя энергия. Внутренняя энергия системы может изменяться в результате совершения над системой работы или сообщения ей теплоты. Например, вдвигая поршень в цилиндр, в котором находится газ, мы сжимаем этот газ, в результате чего его температура повышается, т. е. тем самым увеличивается внутренняя энергия газа. С другой стороны, температуру газа и его внутреннюю энергию можно увеличить за счет сообщения ему некоторого количества теплоты – энергии, переданной системе внешними телами путем теплообмена. Таким образом, существует две формы передачи энергии от одних тел к другим: работа и теплота. Энергия механического движения может превращаться в энергию теплового движения, и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии; применительно к термодинамическим процессам этим законом и является первое начало термодинамики, установленное в результате обобщения многовековых опытных данных. Допустим, что некоторая система (газ, заключенный в цилиндр под поршнем), обладая внутренней энергией U1, получила некоторое количество теплоты Q и, перейдя в новое состояние, характеризующееся внутренней энергией U2, совершила работу А над внешней средой, т. е. против внешних сил. Количество теплоты считается положительным, когда оно подводится к системе, а работа – положительной, когда система совершаетее против внешних сил. Опыт показывает, что в соответствии с законом сохранения энергии при любом способе перехода системы из первого состояния во второе изменение внутренней энергии U=U2–U1 будет одинаковым и равным разности между количеством теплоты Q, полученным системой, и работой A, совершенной системой против внешних сил:
или
Уравнение (2.78) выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. Выражение (2.78) в дифференциальной форме будет иметь вид
где dU – бесконечно малое изменение внутренней энергии системы, А – элементарная работа, Q – бесконечно малое количество теплоты. В этом выражении dU является полным дифференциалом, а A и Q таковыми не являются. В дальнейшем будем использовать запись первого начала термодинамики в форме (2.79). Из формулы (2.78) следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж). Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии dU =0. Тогда, согласно первому началу термодинамики, A=Q, т. е. вечный двигатель первого рода – периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия, – невозможен (одна из формулировок первого начала термодинамики). Рассмотрим газ, находящийся под поршнем в цилиндрическом сосуде (рисунок 2.19).
Рисунок 2.19 Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу A=Fdl=pSdl=pdV. где S – площадь поршня, Sdl=dV – изменение объема системы. Таким образом,
Полную работу А, совершаемую газом при изменении его объема от V 1 до V 2, найдем интегрированием формулы (2.80):
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (2.81) справедливо при любых изменениях объема твердых, жидких и газообразных тел. Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Пусть изменение давления газа при его расширении изображается кривой на рисунке 2.20. При увеличении объема на d V совершаемая газом работа равна pdV, т. e. определяется площадью полоски с основанием d V, заштрихованной на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V1 до объема V2 определяется площадью, ограниченной осью абсцисс, кривой p=f(V) и прямыми V1 и V2. Графически можно изображать только равновесные процессы – процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны, но чем медленнее процесс протекает, тем он ближе к равновесному. В дальнейшем рассматриваемые процессы будем считать равновесными.
Вопрос 20 Теплоемкость Удельная теплоемкость вещества – величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
Единица удельной теплоемкости – джоуль на килограмм-кельвин (Дж/(кг×К)). Молярная теплоемкость – величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
где v=m/M – количество вещества. Единица молярной теплоемкости – джоуль на моль-кельвин (Дж/(моль×К)). Удельная теплоемкость с связана с молярной Сm соотношением
где М – молярная масса вещества. Если в процессе нагревания вещества его объем или давление поддерживается постоянными, то получают теплоемкости при постоянном объеме и постоянном давлении. Запишем выражение первого начала термодинамики (2.79) для 1 моль газа с учетом значений dQ и dА:
Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю (см. (2.80)) и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии:
т. е. молярная теплоемкость газа при постоянном объеме СV равна изменению внутренней энергии 1 моль газа при повышении его температуры на 1 К. Подставим
Если газ нагревается при постоянном давлении, то выражение (2.85) можно записать в виде
Учитывая, что
Выражение (2.89) называется уравнением Майера; оно показывает, что CP, всегда больше СV на величину молярной газовой постоянной. Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа. Использовав (2.87), выражение (2.89) можно записать в вид
Характеристикой для каждого газа является отношение СP к СV:
Молярные теплоемкости одноатомных газов определяются числом степеней свободы и не зависят от температуры в широком интервале температур. У двухатомных газов число степеней свободы зависит от температуры. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы. Из экспериментальной зависимости молярной теплоемкости СV водорода (рисунок 2.21) следует, что при низкой температуре (»50 К) СV=3/2R, при комнатной – СV=5/2R и при очень высокой – СV=7/2R. Следовательно, при низких температурах наблюдается только поступательное движение молекул, при комнатных – добавляетсяих вращение, а при высоких – к этим двум видам движения добавляются еще колебания молекул.
Рисунок 2.21 При вычислении теплоемкости надо учитывать квантование энергии вращения и колебаний молекул (возможны не любые вращательные и колебательные энергии, а лишь определенный дискретный ряд значений энергий). Если энергия теплового движения недостаточна, например, для возбуждения колебаний, то эти колебания «замораживается» и не вносят своего вклада в теплоемкос
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-28; просмотров: 245; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.186.26 (0.006 с.) |





 , тогда
, тогда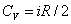

 не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от p, ни от V, а определяется лишь температурой Т) и всегда равна СV (см. (2.86)), и дифференцируя уравнение Клапейрона – Менделеева pVm=RT (2.16) пo T (p = const), получаем
не зависит от вида процесса (внутренняя энергия идеального газа не зависит ни от p, ни от V, а определяется лишь температурой Т) и всегда равна СV (см. (2.86)), и дифференцируя уравнение Клапейрона – Менделеева pVm=RT (2.16) пo T (p = const), получаем