Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опухоли забрюшинного пространстваСодержание книги Поиск на нашем сайте
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ «БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИСТЕТ» КАФЕДРА ОНКОЛОГИИ
М.Н. ШЕПЕТЬКО В.В. БАРЬЯШ
ОПУХОЛИ ЗАБРЮШИННОГО ПРОСТРАНСТВА
Учебно-методическое пособие
Минск 2008 Опухоли забрюшинного пространства. Забрюшинное пространство – это анатомическая область, ограниченная спереди – дорзальным листком брюшины, сзади mm. psoas et mm. quadratus lumborum, расположенных на начальной части апоневроза mm.transversus abdominis. В проксимальном направлении простирается до места, где брюшина переходит на печень, селезенку, соответствует Th 12 и 12-м ребрам; дистальная его граница находится у promontorium. Латеральные границы соответствуют боковым границам mm. quadratus lumborum [1]. В этом отделе топографически ориентированы следующие органы: - Поджелудочная железа, почки, надпочечники, мочеточники. - Большие сосудистые стволы брюшной полости (aorta abdominalis, v. cava inferior c ее парными и непарными ветвями). - Pars lumbalis симпатического ствола и разветвления симпатических нервов. - Лимфатические узлы поясничной области и cysterna chili. Первооткрывателем в области изучения опухолей этой необычной локализации считается Морганьи, который в 1761 году описал забрюшинную липому, а в 1829 г. Lobstein обосновал термин «ретроперитонеальная опухоль». Общая классификация опухолей забрюшинного пространства: Органные опухоли (почек, почечной лоханки, мочеточников, надпочечников, поджелудочной железы). Неорганные опухоли (мышечной ткани, нервной, жировой, сосудистые, эмбриональные). Системные (лимфомы/лейкозы). Метастатические (метастазы рака ободочной и прямой кишки, рака желудка, рака почки и других опухолей).
В соответствии с гистогенезом, забрюшинные опухоли, не исходящих из органов или неорганные, наиболее удачно можно разделить на три группы: - Опухоли мезенхимального происхождения - Опухоли нейрогенного происхождения - Кисты и тератомы [4] Все эти новообразования относятся к солидным[1] опухолям, представлены одним или несколькими узлами. Клинически проявляются неспецифическим комплексом симптомов в результате постепенно развивающейся компрессии внутренних органов. Среди опухолей, развивающихся в этой области, первое место занимают опухоли почек. В соответствии с особенностями диагностики, клиники, лечения и прогноза опухоли почек, почечной лоханки, мочеточников у взрослых выделены в отдельную группу новообразований в разделе онкоурология, и в настоящем пособии рассматриваться не будут. Новообразования надпочечника занимают особое место, у 0,1% здорового населения представлены объемным образованием, выявляемым пальпаторно, УЗИ исследовании или на КТ-граммах. При недавнем систематическом обзоре в мире среди общего числа опухолевой патологии надпочечника на долю аденомы (Рис.2) пришлось 41% случае, адренокортикальный рак составил 10%, феохромоцитома 8%, миелолипома 9%. Следует также отметить, что метастатическое поражение надпочечников из других источников имело место в 19% случаев (J. Lau, E. Balk et al) (Таблица 1).
Таблица 1. Новообразования надпочечников (Arthur E. Shwartz, Demetrius Pertsemblidis et al)
· - потенциально функционирующая
Молекулярные механизмы возникновения опухолей надпочечников не достаточно выяснены и являются темой пристального изучения. Тем не менее, возникновению адренокортикальных опухолей предшествуют или сопутствуют различные генетические синдромы. Среди них – синдромы Беквита-Видеманна[2], Ли Фраумени[3], MEN-1[4], триада Карни[5] и синдром Мак Куна-Олбрайта[6]. Схожие синдромы наблюдаются при выявлении опухолей мозгового вещества – MEN-2[7], болезнь Гиппеля-Линдау[8], нейрофиброматоз тип 1[9]. Опухоли надпочечников. Гиперплазия надпочечника - это увеличение количества клеток органа, сопровождающиеся его гиперфункцией. В качестве примера можно привести наиболее распространенную форму эндогенного гиперкортицизма АКТГ-секретирующую опухоль шишковидного тела, в результате которой продуцируется избыток кортизола т.н. болезнь Кушинга. При этом надпочечники увеличиваются вдвое от нормальных размеров. В этом случае вес каждого гиперпластического надпочечника колеблется от 6 до 12 г, тогда как нормальная масса органа 3-6 г. Та же картина наблюдается и при эктопической форме АКТГ-синдрома – внешний вид надпочечников будет тот же, однако масса их может быть в 2-3 раза большей и достигать 12-30 г. Микроскопические изменения представлены расширением внутренней зоны плотного ретикулярного слоя и отчетливой демаркационной линией внешней зоны. Макронодулярная гиперплазия надпочечников характеризуется узлами коркового вещества около 3 см в диаметре, весом от 30 до 50г. В отдельных случаях масса узлов может доходить до 100г. Такая патология является обычно вторичным ответом ткани надпочечника на стимуляцию АКТГ. Первичная пигментная микронодулярная гиперплазия (1-5 мм узлы с пигментными включениями и нормальным весом железы) более вероятно, является, автономной. Эта форма гиперплазии часто встречается у детей и может носить семейный характер.
Аденома коркового вещества надпочечников или кортикальная аденома – доброкачественная опухоль, возникающая из клеток коркового вещества. В большинстве своем аденомы могут быть случайной находкой и протекают клинически бессимптомно, но иногда могут автономно функционировать. Следовательно, чаще других синдромов развиваются синдромы Кушинга, адреногенитальный и синдром гиперпродукции альдостерона. Таким образом, гиперфункция надпочечников непосредственно связана с развитием гормонально активной опухоли. Размеры доброкачественного новообразования обычно не превышают 5 см в наибольшем измерении и имеют вес до 100 грамм. Полиморфизм клеток, некроз ткани опухоли не характерны для аденомы и присутствуют крайне редко. Полиморфизм, опухолевый некроз и митотическая активность – наиболее общие черты злокачественных опухолей надпочечников. Причем, четко отмечено, что новообразования более 100 граммов и/или более 6 сантиметров в наибольшем измерении уже имеют черты явно выраженного полиморфизма и очень часто злокачественные. Отмечено также, что клиническим признаком доброкачественности опухоли является синдромом гиперкортицизма и повышенной продукцией альдостерона. Доброкачественной аденоме адреногенитальный синдром сопутствует очень редко. При соответствующем лечении, прогноз при кортикальной аденоме с синдромом Кушинга, является благоприятным, а хирургическое удаление опухоли дает выраженный лечебный эффект. Альдостерон-продуцирующие опухоли составляют 65% наблюдений, известны под названием синдрома Конна и в большинстве своем доброкачественные. Данный тип новообразований имеет небольшие размеры (< 2 см в диаметре), их клетки вырабатывают избыточное количество альдостерона и его предшественника (18-гидроксикортикостерона). Для больных с явлениями гиперпродукции альдостерона прогноз в отношении выздоровления несколько хуже. В частности, после хирургического удаления опухоли резко уменьшаются явления артериальной гипертензии, гипокалиемии, однако у 30 % больных гипертоническая болезнь возвращается вновь. В литературе описано только 20 случаев злокачественных альдостерон-продуцирующих опухолей.
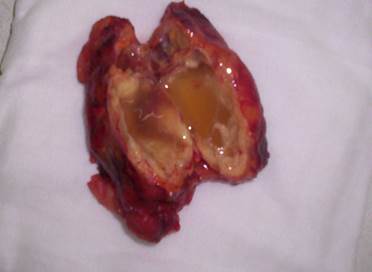
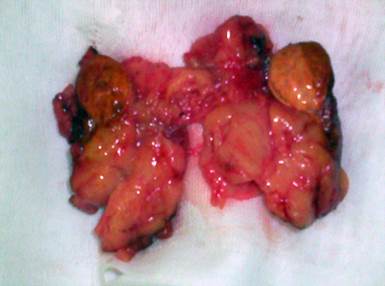
Адренокортикальная карцинома или адренокортикальный рак встречается достаточно редко и составляет 0,05% - 0,2% от всех злокачественных опухолей эпителиального происхождения, или 2 впервые выявленных случая на 1 000 000 населения всей популяции. У женщин развивается чаще функционирующая кортикальная карцинома, с другой стороны, не функционирующая кортикальная карцинома развивается чаще у мужчин. Заболеваемость имеет два возрастных пика – первый приходится на возраст до 5 лет и второй пик – между 40 и 50-ю годами. Адренокортикальная аденома может быть также описана как часть наследственного симптомокомплекса, включающего саркому, рак груди или рак легкого. Цитогенетический анализ первичной адренокортикальной карциномы выявил клональную реарранжировку некоторых аутосом и половых хромосом. Исследования показали, что самым значимым в патогенезе опухоли является потеря короткого плеча одиннадцатой хромосомы (11p). Адренокортикальная карцинома обычно имеет размеры более 6 сантиметров в наибольшем измерении и вес от 100 до 5000г. В макроструктуре опухоли присутствуют очаги некроза и геморрагии. Микроскопическая инвазия, клетки с большими ядрами, гиперхроматизм, увеличение ядрышек и микрометастазы являются признаками злокачественности. Для опухолей более 500 грамм наиболее часто встречается полиморфизм клеточных ядер. В пользу злокачественности также свидетельствуют сосудистая инвазия и множественные митозы. Пограничная десмопластическая линия ассоциируется с высоким метастатическим потенциалом. Однако диагноз злокачественной кортикальной опухоли от 50 до 100 грамм иногда бывает затруднительным и неопределенным и не всегда возможно их отличить друг от друга. Существует только один четкий критерий – это присутствие метастазов в регионарные лимфатические узлы, или наличие отдаленных метастазов. Затруднения могут также вызвать и различия между адренокортикальной карциномой и светлоклеточным раком почки. Иммуногистохимическими исследованиями доказано, что адренокортикальные опухоли дают положительную реакцию на виметин тогда, как почечно-клеточная карцинома с виметином реакции не дает, но положительна на другие иммуногистохимические типовые маркеры. Данные, используемые для дифференциальной диагностики доброкачественных от злокачественных адренокортикальных опухолей, включают следующие показатели: тип гормонов, продуцируемых опухолью, опухолевый некроз, фиброз, сосудистую инвазию, митозы и вес опухоли. Феохромоцитома Феохромоцитома – это опухоль мозгового слоя надпочечников из хромаффинных клеток, секретирующая биогенные амины и пептиды, в том числе адреналин, норадреналин и дофамин. После рождения большая часть хромаффинных клеток, разбросанных по организму, подвергается дегенерации, оставаясь неизмененными лишь мозговом веществе надпочечников. Аналогичные амины, продуцируют опухоли, развивающиеся из симпатических ганглиев, и имеющие единое происхождение. Первое сообщение о феохромоцитоме у ребенка было сделано Marchetti в 1904 г. Опухоль встречается в возрасте от 20 до 50 лет. Пик заболеваемости приходится на диапазон 6 – 14 лет (Hume, 1960). Причем дети заболевают редко и в структуре детской заболеваемости преобладают мальчики (63%). Правостороннее поражение надпочечника встречается чаще, чем левостороннее. В отличие от взрослых, у детей намного больше опухолей двусторонних, множественных и вненадпочечниковой локализации. У взрослых билатеральная, множественная или вненадпочечниковая локализация встречается только у 10% больных. Stokes и Hume у детей находили двусторонние и множественные опухоли почти в 1/3 случаев, 54% феохромоцитом были билатеральными, множественными или вненадпочечниковой локализации. Макроскопически опухоль в среднем не превышает 5-8 см в диаметре, весит от 50 до 200г., однако имеются сведения об опухолях, достигающих несколько килограммов. Крайне редко феохромоцитомы достигают больших размеров, редко пальпируются и вызывают синдромы обструкции или сдавливания внутренних органов. Микроскопически состоит из клеток с хорошо инкапсулированными гнездами хроматина. Клетки могут иметь различную форму с ядерным пикнозом, гигантскими или множественными ядрами. Несмотря на эти неопластические морфологические проявления, опухоль может расцениваться как доброкачественная, не обладать инвазивными свойствами, не инфильтрировать капсулу и не давать метастазов (Рис 1, 2). Кроме надпочечников соответствующие опухоли могут быть обнаружены в симпатических ганглиях вдоль аорты, каротидном тельце, в органах Цукеркандля[10], в органах мочеполовой системы, головном мозге, перикарде и дермоидных кистах. Нейробластома Нейробластома принадлежит к солидым злокачественным опухолям детского возраста, в отличие от феохромоцитомы, возникающей из хромаффинной ткани, имеет нейрогенное происхождение и локализуется в мозговом веществе надпочечников. Нейробластома встречается с частотой 10,5 на 1 млн. населения у детей младше 15 лет или 1 случай на 7000 новорожденных и составляет 7 – 10% от всей злокачественной патологии детского возраста. Пик заболеваемости приходится на возраст 18 месяцев, средний возраст в момент установления диагноза – 22 месяца и только 3% случаев диагностируются в возрасте старше 10 лет. Мальчики болеют чаще девочек в соотношении 1,2: 1. Почти все дети младше 8 лет, из них половина имеет возраст до 2-х лет. У части новорожденных, больных метастатической формой нейробластомы наступает полная регрессия заболевания без всякого лечения. Среди детей старших возрастных групп нейробластома со временем превращается в доброкачественную ганглионеврому. Большинство больных имеют агрессивную метастатическую форму заболевания, несмотря на проводимую мультимодальную терапию. В забрюшинном пространстве, а именно в мозговом веществе надпочечников она встречается в 50% наблюдений. Остальные случаи возникновения разбросаны в местах распределения симпатических нервных стволов и ганглиев: в грудной полости 20%, на шее и в полости малого таза – 5% случаев. Природа возникновения опухоли до настоящего времени неизвестна, уже хорошо известно, что состояние окружающей среды играет немаловажную роль. Генетические исследования выявили поломку в локусе 16p12-13 хромосомы у больных нейробластомой. Использование лекарств в пренатальном и постнатальном периодах, экспозиция химических агентов или радиация существенно не повышают риск развития заболевания. Опухоль ассоциируется с синдромом Беквита-Видеманна, нейрофиброматозом I типа, болезнью Гиршпрунга[11], синдромом Клиппел-Фейл[12] и другими нейропатиями. Это наводит на мысль о том, что существует спектр заболеваний, при которых в эмбриогенезе повреждается нервная трубка. Наблюдается увеличение частоты возникновения нейробластомы с синдром Тернера и снижение ее частоты у пациентов с синдромом Дауна. Причины такой диспропорции до настоящего времени не выяснены. Результаты исследований случаев семейной нейробластомы соответствуют теории двойной мутации Кнудсона[13], когда хромосомные аномалии наблюдаются у близнецов, а опухоль развивается только у одного. Наконец, 20% пациентов с семейными случаями нейробластомы имеют двухстороннее поражение надпочечников или мультифокальный рост опухоли. В подавляющем большинстве случаев нейробластома встречается как самостоятельное заболевание. Механизм спонтанной дифференцировки нейробластомы в ганглионеврому у новорожденных не выяснен. Предполагается, что в основе этого лежит изменения в рецепторах TrkA, TrkB и TrkC. Нервный ростовой фактор, ассоциированный нейротрофический фактор головного мозга, нейроторофин-3 являются лигандами для этих рецепторов.
Макроскопически новообразование представлено быстро растущей хрупкой солидной опухолью с явлениями некроза, кровоизлияний и формированием кист. Нейробластома хорошо васкуляризирована и обладает инвазивным ростом по направлению к окружающим структурам и тканям. Микроскопически нейробластома состоит из малых круглых клеток, обедненных цитоплазмой. Клетки собраны в розетки, в центре имеются нервные волокна. Электронная микроскопия показывает наличие нейрофибрилл и нейросекреторных гранул. Степень дифференцировки опухоли может быть различной. Таблица 2. Группировка нейробластомы по стадиям (по Evans et al. “Children Study Group” Neuroblastoma Staging System (INSS))
· - special (специальная)
Клинико-биологические маркеры и факторы прогноза. Пациенты, имеющие степень распространения опухолевого процесса в пределах I, II и IVs стадии заболевания имеют хороший прогноз в более чем 90% случаев. Для больных с III и IV стадией опухоли 2-х летняя безрецидивная выживаемость находится в диапазоне 20 – 40% (таблица 2). Для детей младше 1 года прогноз более благоприятный в сравнении со старшими возрастными группами, для тех же стадий распространения заболевания. Однако отмечено, что больные с IV стадией нейробластомы и амплификацией Myc онкогена имеют худший прогноз заболевания. Суммируя полученные данные, данные мировой литературы сделаны выводы о том, что факторами прогноза являются не только возраст, стадия заболевания в соответствии с INSS, гистопатологический вариант опухоли, но и существующие изменения ДНК у данной категории больных. Экспрессия TrkA, RAS, активность теломеразы на мембранах опухолевых клеток являются предметом пристального изучения в отношении прогноза и контроля за эффективностью проведенного лечения.
Тератомы Тератома (teratoma; греч. teras, terat [os] чудовище, уродство + -ōma; синонимы: сложная опухоль, эмбриома, смешанная тератогенная опухоль, тридермома, монодермома, паразитирующий плод) – опухоль, состоящая из тканей нескольких типов, производных одного, двух или трех зародышевых листков, присутствие которых не свойственно тем органам и анатомическим областям организма, в которых развивается опухоль. Тератома относится к группе герминогенных опухолей. Возникновение опухоли можно объяснить задержкой герминогенного эпителия на пути его миграции из стенки желточногомешка к месту закладки гонад на 4 – 5-й неделе внутриутробного развития. До настоящего времени нет единого мнения о происхождении тератомы. Развитие тератом наиболее полно разъясняет теория бластомеров сместившихся в ранних стадиях развития и сохранившихся до тех пор, пока неблагоприятные воздействия не дадут толчка к их бурному развитию (Marchand, 1897; Bonnet, 1900). Потерявшие связь с организмом смещенные клетки не могут обеспечить законченное нормальное развитие ткани, что приводит к развитию новообразования. Тератомы бывают зрелые и незрелые. Зрелые тератомы являются высокодифференцированными. Они могут быть как доброкачественные, так и злокачественные. Незрелые тератомы всегда злокачественные. Паренхима тератомы может состоять из тканей сразу трех типов: эндодермы, эктодермы, мезодермы. Кроме того, тератома может иметь признаки дифференциирования в различные ткани и органы организма. Гистологически различают зрелую тератому, незрелую тератому, тератому со злокачественной трансформацией. Микроскопически зрелые тератомы солидного и кистозного строения существенно не отличаются друг от друга. Они состоят из фиброзной соединительной ткани, в которой беспорядочно чередуются участки хорошо дифференцированного зрелого многослойного плоского эпителия, эпителия кишечного и респираторного типа, формирующие органоидные структуры. Встречаются часто структуры нервов, апокринные железы, кости, хрящ, зубы, ткань мозга, жировая клетчатка, гладкие мышцы. Незрелая тератома состоит из незрелых тканей, напоминающих ткани эмбриона. Макроскопически размеры опухоли варьируют в широких пределах. Она имеет неравномерно тестоватую консистенцию, на разрезе серовато-белого цвета, с мелкими кистами и участками слизеобразования. Микроскопически в опухоли определяются очаги пролиферации незрелого кишечного, респираторного, многослойного плоского эпителия. Незрелые поперечнополосатые мышцы, хрящ, располагающиеся среди незрелой, рыхлой, местами миксоматозной мезенхимальной ткани. Метастазируют тератомы такого строения лимфогенным и гематогенным путем. Строение метастазов может соответствовать первичному узлу, или в них преобладает один из его компонентов. Список литературы 1. Корнинг, Г.К. Топографическая анатомия / Г.К. Корнинг; пер. с нем. М., 1936. С. 440-441. 2. Arthur, E. Endocrine Surgery / Arthur E. Shwartz, Demetrius Pertsemblidis, Michel Gagner. New York, 2004. P.42. 3. Management of clinically Innaparent Adrenal Mass / J. Lau [et al] AHRQ publication No 02-E014. 4. Клиническая онкология / под ред. Н.Н. Блохина, Б.Е. Петерсона. М., 1971. Т.2. С. 229. 5. Дурнов, Л. А. Опухоли забрюшинного пространства и брюшной полости у детей / Л.А. Дурнов, А.Ф. Бухны, В.И. Лебедев. М.: Медицина, 1972. 196 с. 6. Дурнов, Л. А. Опухоли у детей / Л.А. Дурнов. Л.: Медицина, 1985. 118 с. 7. Патологоанатомическая диагностика опухолей человека: руководство / под ред. Н.А. Краевского [и др.] М., 1982. C. 298. 8. Алгоритмы диагностики и лечения больных злокачественными новообразованиями // Онкологический журн. 2007. №3(3). С.207-209. 9. Principles and Practice of Oncology / Vincent T. Devita, Samuel Hellman, Steven A. Rosenber. 5-Edition. Philadelphia. Section 4. 1997. 10. Ackerman's Surgical Pathology / Rosai, J. 7-Edition. Washington, 1989. P. 1650-1660. [1] Solid (лат.) - плотный [2] Гигантизм при рождении, пупочная грыжа, гипогликемия, макроглоссия.
[3] Возникновение семейных опухолей: сарком мягких тканей, рака молочной железы, коры надпочечников и опухолей мозга.
[4] Аутосомно-доминантный наследственный синдром. Включает гиперплазию паращитовидных желез, секретирующую опухоль гипофиза и опухоли кишечника.
[5] Парагнглиомы, эпителиоидная лейомиосаркома желудка, доброкачественные хондромы легких у женщин и опухоли из леток Лейдига у мужчин.
[6] Фиброзная остеодисплазия, кожные пятна цвета «кофе с молоком», преждевременное половое созревание, гиперфункция многих эндокринных желез с гиперпродукцией гормона роста. Развивается преимущественно у девочек.
[7] MEN2a или синдром Сиппла: гиперпаратиреоз, медуллярная тиреоидная карцинома, феохромоцитома MEN2b: медуллярная тиреоидная карцинома, синдром Марфана, феохромоцитома.
[8] Гемобластомы сетчатки и мозжечка, феохромоцитомы
[9] Пятна цвета «кофе с молоком» у 5% больных с феохромоцитомой и у 1% больных нейрофиброматозом обнаруживается феохромоцитома
[10] Ганглии, находящиеся в непосредственной близости от нижней брыжеечной артерии, слева от бифуркации аорты.
[11] Врожденный кишечный аганглиоз
[12] Короткая, неподвижная шея, вследствие сращения шейных позвонков [13] Knudson и Strong доказывают, что оба близнеца имеют мутацию 11p13, но вторая мутация, приводящая к развитию опухоли наступает у одного близнеца. [14] Нарушение функции толстого кишечника и мочевого пузыря.
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ «БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИСТЕТ» КАФЕДРА ОНКОЛОГИИ
М.Н. ШЕПЕТЬКО В.В. БАРЬЯШ
ОПУХОЛИ ЗАБРЮШИННОГО ПРОСТРАНСТВА
Учебно-методическое пособие
Минск 2008
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 911; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.239.65 (0.013 с.) |