
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Современные представления о строении атомаСодержание книги
Поиск на нашем сайте
Для квантовомеханического описания атома необходимо решить уравнение Шредингера. Эта достаточно непростая задача успешно решена для атома водорода и водородоподобных ионов. Согласно квантовой механике, энергия электрона в атоме, его орбитальный момент импульса, проекция момента импульса на выделенное направление в пространстве и проекция собственного момента импульса электрона (спина) на это направление дискретны или квантованы. Состояние электрона в атоме описывается набором четырех квантовых чисел: n, l, m и s. n называется главным квантовым числом и характеризует энергию электрона в атоме:
Орбитальное число l характеризует момент импульса электрона в атоме: L =
Магнитное число m определяет проекцию момента импульса на выделенное направление в пространстве (например, на направление магнитного поля): L z =
Электрон и ряд других элементарных частиц обладают собственным механическим моментом импульса (спином), не связанным с их движением в пространстве. Спиновое число s характеризует проекцию момента импульса электрона на выделенное направление в пространстве. При переходе с одного энергетического уровня (Em) на другой (En) атом испускает или поглощает квант энергии электромагнитного поля (фотон) h n =Em – En. (2.9.7) Квантовомеханическое описание многоэлектронных атомов является еще более трудной задачей, нежели описание атома водорода. В многоэлектронных системах проявляются особые свойства, не имеющие аналогов в классической физике. В классической механике частицы, обладающие одинаковыми физическими параметрами (масса, электрический заряд, размер и др.), принципиально можно различить по их положению в пространстве и импульсам. Такие частицы называются тождественными. Волновые свойства микрообъектов приводят к тому, что тождественные микрочастицы принципиально неразличимы. Для микрочастиц неприменимо понятие траектории, состояние микрочастицы описывается волновой функцией, квадрат модуля которой позволяет вычислять лишь вероятность нахождения микрочастицы в окрестности той или иной точки пространства. В области перекрытия волновых функций вопрос об индивидуальности той или иной частицы лишен смысла. Принцип неразличимости тождественных частиц является одним из фундаментальных принципов квантовой механики.
Принцип неразличимости тождественных частиц приводит к особым чертам в поведении электронов в многоэлектронных атомах. Эти особенности сконцентрированы в принципе, сформулированном В. Паули (1925): в атоме не могут находиться два электрона, обладающих одинаковым набором квантовых чисел. Согласно принципу Паули, у любых двух электронов в атоме не может быть четырех одинаковых квантовых чисел (главное n, орбитальное l, магнитное m и спиновое s), значения по крайней мере одного квантового числа должны различаться. Принцип Паули лежит в основе заполнения электронных состояний в атоме и объясняет Периодическую систему элементов Д.И. Менделеева.
Строение атомного ядра Атомное ядро состоит из элементарных частиц – протонов и нейтронов. Протон (p) имеет положительный заряд, численно равный заряду электрона, и массу покоя, превышающую массу покоя электрона в 1836 раз. Нейтральная частица нейтрон (n) имеет массу, превышающую массу электрона в 1839 раз. Протоны и нейтроны называются нуклонами (от лат. nucleus – ядро). Общее число нуклонов в ядре называется его массовым числом А. Заряд ядра определяется числом протонов Z, которое называется зарядовым числом. Зарядовое число совпадает с порядковым номером химического элемента в Периодической системе элементов. Ядра принято обозначать в виде Известные к 2012 году 118 элементов имеют зарядовые числа ядер от 1 до 118. В настоящее время известно около 1500 ядер, отличающихся либо А, либо Z, либо тем и другим. Примерно 20% этих ядер устойчивы, остальные радиоактивны. Ядра с одинаковым зарядовым числом А (одинаковым числом протонов), но разным массовым числом Z (разным числом нейтронов) называются изотопами. Большинство химических элементов имеет по несколько изотопов: кислород имеет три стабильных изотопа (16О, 17О, 18О), у олова 10 изотопов и т.д. Водород имеет три изотопа: протий Радиус ядра пропорционален массовому числу А и составляет (1,3-1,7)×10–15 м. Плотность ядерного вещества примерно одинакова для всех ядер (1017 кг/м3).
Опыт показывает, что масса ядра меньше суммы масс составляющих нуклонов на величину D m, называемую дефектом массы ядра. Энергия, которую необходимо затратить, чтобы расщепить ядро на отдельные нуклоны, называется энергией связи ядра E св. Энергия связи ядра связана с его дефектом массы D m соотношением E св. = D mc 2 . Единая последовательная теория атомного ядра до настоящего времени не разработана. Среди моделей, описывающих свойства ядра, наиболее известны капельная и оболочечная модели. Капельная модель (Н. Бор, Я.И. Френкель, 1936) основана на аналогии между поведением нуклонов в ядре и поведением молекул в капле жидкости. Оболочечная модель (М. Гепперт-Майер, Х. Иенсен, 1950) предполагает распределение нуклонов в ядре по дискретным энергетическим уровням (оболочкам), заполняемым нуклонами согласно принципу Паули. Устойчивость ядер в этой модели связана с заполнением этих оболочек. Наиболее устойчивыми (магическими) оказываются ядра с полностью заполненными оболочками (4Не, 16О, 40Са, 48Са, 208Pb). Между составляющими ядро нуклонами действуют особые силы притяжения, значительно превышающие кулоновские силы отталкивания между протонами. Эти силы называются ядерными. Отличительные особенности ядерных сил состоят, в частности, в следующем: 1 Ядерные силы являются короткодействующими. Радиус действия ядерных сил составляет 10–15 м; на расстояниях, бóльших 10–15 м, ядерное притяжение протонов сменяется их кулоновским отталкиванием. 2 Ядерные силы обладают зарядовой независимостью. Взаимодействие протона с протоном, протона с нейтроном и нейтрона с нейтроном имеет одинаковую величину. 3 Ядерные силы обладают свойством насыщения. Каждый нуклон взаимодействует с ограниченным числом нуклонов. 4 Ядерные силы не являются центральными, т.е. действующими по прямой, соединяющей нуклоны. 5 Ядерные силы зависят от взаимной ориентации спинов взаимодействующих нуклонов. Сложный характер ядерных сил и трудность точного решения уравнений движения всех нуклонов не позволили до настоящего времени разработать единую последовательную теорию атомного ядра.
|
||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 331; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.124.204 (0.008 с.) |


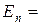 −
−  . (2.9.4)
. (2.9.4)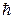
 . (2.9.5)
. (2.9.5) m. (2.9.6)
m. (2.9.6) , где X – символ химического элемента.
, где X – символ химического элемента. (1 протон), дейтерий
(1 протон), дейтерий  (1 протон, 1 нейтрон), тритий
(1 протон, 1 нейтрон), тритий  (1 протон, 2 нейтрона). Протий и дейтерий стабильны, тритий радиоактивен.
(1 протон, 2 нейтрона). Протий и дейтерий стабильны, тритий радиоактивен.


