
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон действующих масс для гетерогенных реакций.Содержание книги
Поиск на нашем сайте
Современная формулировка этого закона: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции». Для реакции a A + b B, то есть для a молей вещества А и b молей вещества В ЗДМ формально запишется в виде Константа скорости k определяется природой реагирующих веществ, зависит от температуры и присутствия катализатора, но не зависит от концентрации реагентов, участвующих в реакции. При гетерогенной реакции в уравнение ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k. Константа скорости k численно равна скорости, если концентрации реагентов постоянны и равны единице. Закон действующих масс, безусловно, выполняется только для элементарных химических реакций, протекающих в одну стадию. В других случаях фактическая и вычисленная по закону действующих масс скорости совпадают редко.
Растворы неэлектролитов. Идеальный раствор. Растворы неэлектролитов - многокомпонентные мол. системы, состав которых может изменяться непрерывным образом. В отличие от растворов электролитов в растворах неэлектролитов заряженные частицы в заметных концентрациях отсутствуют. Растворы неэлектролитов могут быть твердыми, жидкими и газообразными. Такие по св-вам считают близкими к идеальным. Идеальный раствор – раствор, образование которого не сопровождается изменением объема и тепловым эффектом. Силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором. Зависимость скорости реакции от температуры. Уравнение Аррениуса. Правило Вант-Гоффа. Уравнение Аррениуса: k = A • exp(-Ea/RT) A - постоянная, зависящая от природы реагирующих в-в;Ea - энергия активации(энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению).Чем больше Ea, тем сильнее ↑скорость реакции при увеличении температуры. Правило Вант-Гоффа: повышение температуры на 10 градусов увеличивает скорость реакции в 2-4 раз. При повышении кол-во активных частиц в системе возрастает.
Энергия и энтропия активации реакции. Гомогенный и гетерогенный катализ. Активированный комплекс. Энергетическая диаграмма реакции. Катализ - ускорение скорости реакции под действием какого-либо в-ва. Катализатор- в-во, ускоряющее или осуществляющее не идущую, но принципиально существующую реакцию. Гетерогенный катализ: Гетерогенный катализ (контактный катализ), изменение скорости хим. р-ции при воздействии катализаторов, образующих самостоят. фазу и отделенных от реагирующих в-в границей раздела.наиб. распространен случай, когда твердый кат. (контакт) ускоряет р-цию между газообразными реагентами или р-цию в р-ре. Каталитич. р-ция протекает обычно на пов-сти твердого кат. и обусловлена активацией молекул реагентов при взаимод. с пов-стью. Гомогенный катализ: Гомогенный катализ, ускорение хим. р-ции в присутствии катализатора, к-рый находится в одной фазе с исходными реагентами (субстратами) в газовой фазе или р-ре. При гомогенном катализе, как и при гетерогенном катализе, катализатор в р-ции нe расходуется, однако является ее необходимым участником; без катализатора р-ция протекает гораздо медленнее или не идет вовсе) Активированый комплекс: согласно теории при столкновении частиц происходит образование промежуточного активного комплекса, в котором рвутся старые связи. Происходит затрата энергии при перераспределении связей. Этот комплекс в отличии от молекулы обладает повышенной энергией и распадается с образованием продуктов.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 2136; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.172.250 (0.007 с.) |

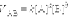

 -температурный коэффициент реакции, показывает во сколько раз увелилчилась скорость при воышении температуры на 10 градусов.
-температурный коэффициент реакции, показывает во сколько раз увелилчилась скорость при воышении температуры на 10 градусов. <0
<0 0
0


