
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нормальный водородный электрод.Содержание книги
Поиск на нашем сайте
Нормальный водородный электрод - платиновая пластинка, электролитически покрытая губчатой платиной и погруженная в раствор кислоты, через который пропускается водород.
Потенциал водородного электрода воспроизводится с очень высокой точностью. Поэтому водородный электрод и принят в качестве эталона при создании шкалы электродных потенциалов. Потенциал = -0,059рН
Гальвонический элемент Даниэля-Якоби. Этот элемент состоит из медной пластины,погруженной в р-р сульфата меди, и цинковой пластины, погруженной в р-р сульфата цинка. Р-ры разделены перегородкой из пористого материала. Источником электрич. энергии служит энергия хим. реакции: Zn + + CuSO4 → ZnSO4 + Сu. При работе гальванического элемента е от восстановителя переходят к окислителю по внешней цепи, на электродах идут электрохимические процессы, в р-ре наблюдается направленное движение ионов.
69.Критерий направленности Окислительно-восстановительной реакции на примере реакций коррозии металлов в растворах кислот, растворах щелочей и солей, воды. Zn + CuSO4 àCu(в осадке) +ZnSO4 В данной системе Zn-будет анод,аCu-катодом. В этой реакции протекают процессы окисления и восстановления. Процессы протекают самопроизвольно. Если их ЭДС >0. ЭДС-разность потенциалов(потенциал ок-я минус потенциал в-ля). ∆ Е=Е (ок-ля) – Е (в-ля) >0 ∆ Е=+0,34- (-0.76) >0 Такой процесс протекает самопроизвольно. Взаимодействие ме с растворами кислот.(рН<7) А) Кислоты, ок-лем в которых является Н+ HCl,HF,HBr,HI,H2SO4,H3PO4,H2CO3,HNO2 Некоторые Ме могут подвергаться солевой пассивации в р-рах кислот, т.к. они становятся пассивными по поношению к агрессивной среде) Это св-во зависит от растворимости соответствующей соли. С такими кислотами взаимодействуют металлы, которые имеют отрицательные потенциалы(выше Н) Б) Кислоты, в которых окислитель не Н+ Н2SO4 (конц.) и НNO3 (конц.разб) Н2SO4 окисляет все металлы до серебра включительно, степень окисления у катионов металла максимально возможная. H2S –выделяется в случае активных Ме до Zn включит. SO2 –выделяется в случае Ме средне активных и малоактивных.(до серебра) Взаимодействие Ме с р-рами щелочей.(рН>7) При взаимодействии Ме с р-рами щелочей наблюдается выделение водорода, что указывает на его восстановление в данной системе из воды.
Однако такому разрушению подвергаются тока те Ме,которые склонны к образованию гидроксо-комплексов в щелочных р-рах. Гидроксиды таких ме обладают амфотерными св-вами(Al,Br,Zn,Pb,Sr,Cr+3). Взаимодействие Ме с р-рами солей. 1.ме +р-р соли менее активного Ме. ∆ Е>0 Вывод: любой Ме вытесняет ниже стоящие в ряду стандартных электродных потенциалов из р-ров их солей. 2. Ме +р-р соли более активного Ме. Т.е его электродный потенциал меньше чем у 1-го Ме. Реакция. ∆ Е<0. Самопроизвольно идти не должна,но идет за счет гидролиза соли. Вывод: при взаимодействии менее активного Ме с р-ром соли более активного Ме причиной коррозии, т.е разрушения Ме является его взаимодействие с продуктом гидролиза соли.(т.е с кислотой или щелочью) 3.если активности Ме в реакции близки, но свободный Ме активнее, то может протекать одновременно процесс вытеснения и взаимодействия Ме с продуктом гидролиза. Взаимодействие металлов с водой Металл+вода 2Na+H2O=2NaOH+H2 Ba+2H2O=Ba(OH)2+H2
Взаимодействие металлов с азотной кислотой При взаимодействии Me с азотной кислотой H не выделяется так как ион H никогда не выделяется!!!!!!! Me+HNO3 A: 1)ЕСЛИ Me активный(щелочной) Me+HNO3→NH4NO3 -очень разбавленная к-та HNO3→NН3 -разбавленная к-та HNO3→N2O -концентрированная к-та 2)ЕСЛИMe активный и средней силы(до Zn включительно) Me+HNO3→N2O -очень разбавленная к-та HNO3→N2 -разбавленная к-та HNO3→NO -концентрированная к-та 3)ЕСЛИ Me средней силы и мало активный Me+HNO3→NO -разбавленная к-та HNO3→NO2 -концентрированная к-та
Методы защиты от коррозии Коррозия - это процесс самопроизвольного разрушения Me при химическом или электрохимическом взаимодействии с окружающей средой Защита от коррозии 1)Использование коррозионно стойких сплавов и сталей 2)Защита поверхности Me при помощи покрытий(лаки, краски) 3)Покрытие металла более активным металлом, который будет выполнять роль анода 4)покрытие металла менее активным металлом при условии что покрытие будет сплошным(золочение, хромирование)
|
|||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1380; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.213.201 (0.007 с.) |

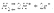
 очень сильный окислитель и с ионoм H не конкурирует
очень сильный окислитель и с ионoм H не конкурирует Me(NO3)n+H2O+A
Me(NO3)n+H2O+A


