
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
И регенерация костной ткани и костейСодержание книги
Поиск на нашем сайте Развитие костной ткани (остеогистогенез) начинается и наиболее активно протекает у эмбриона (эмбриональный остеогистогенез) продолжаясь и после рождения (постнатальный остеогистогенез). Процессы постнатального гистогенеза обеспечивают рост костей в детском и подростковом возрасте. Формирование костей (как органов) завершается, в среднем, к 25 годам, однако гистогенез костной ткани при этом не прекращается, поскольку у взрослого в физиологических условиях она подвергается постоянной внутренней перестройке. Резкая активация процессов гистогенеза костной ткани возникает в ответ на повреждение костей (репаративный остеогистогенез). Необычным вариантом развития костной ткани у взрослого служит ее образование вне скелета (эктопический остеогистогенез). Несмотря на некоторые частные отличия, при любом из вариантов гистогенеза костной ткани проявляются единые общие закономерности этого процесса. Перестройка кости обеспечивается сочетанием процессов ее разрушения и образования, которые осуществляются остеокластами и остеобластами, соответственно. Современные данные о клеточных механизмах процесса перестройки кости обобщены в теории сопряжения функции остеокластов и остеобластов. Теория сопряжения функции остеокластов и остеобластов основана на представлении о координации деятельности этих клеток, которая обеспечивается благодаря тому, что остеобласты стимулируют дифференцировку и активность остеокластов, а остеокласты, в свою очередь, индуцируют деятельность остеобластов. Регуляция такого сопряжения обеспечивается как непосредственным влиянием клеток этих двух типов друг на друга, так и через сложную систему контроля, опосредованную гормонами и факторами роста.
МЫШЕЧНЫЕ ТКАНИ Мышечные ткани представляют собой группу тканей различного происхождения и строения, объединенных на основании общего признака – выраженной сократительной способности, – благодаря которой они могут выполнять свою основную функцию - перемещать тело или его части в пространстве, осмуществлять движения различных органов внутри организма.
КЛАССИФИКАЦИЯ МЫШЕЧНЫХ ТКАНЕЙ Классификации мышечных тканей основаны на признаках их строения и функции (морфофункциональная классификация) и происхождения (гистогенетическая классификация). Морфофункциональная классификация выделяет поперечнополосатые и гладкие мышечные ткани. 1) Поперечнополосатые мышечные ткани образованы структурными элементами (клетками, волокнами), которые обладают поперечной исчерченностью вследствие особого упорядоченного взаиморасположения в них актиновых и миозиновых миофиламентов. К поперечнополосатым мышечным тканям относят скелетную (соматическую) и сердечную мышечную ткани; 2) Гладкие мышечные ткани состоят из клеток, не обладающих поперечной исчерченностъю. Наиболее распространенным видом этих тканей является гладкая мышечная ткань, входящая в состав стенки различных органов (бронхов, желудка, кишки, матки, маточной трубы мочеточника, мочевого пузыря и сосудов).
СКЕЛЕТНАЯ МЫШЕЧНАЯ ТКАНЬ Скелетная (соматическая) мышечная ткань по своей массе превышает любую другую ткань организма и является самой распространенной мышечной тканью тела человека. У детей она составляет около 25% массы тела, у взрослых женщин – 35%, у мужчин – более 40% (у тренированных – до 50%); при старении ее относительная масса падает ниже 30%. Помимо мышц, обеспечивающих перемещение тела и его частей в пространстве и поддержание позы (входящих в состав локомоторного аппарата), она образует глазодвигательные мышцы, мышцы стенки полости рта, языка, глотки, гортани, верхней трети пищевода.
Рис. 7.1. На электронной микрофотографии (х 300) изображены: продольный и поперечный срезы поперечно-полосатой мышцы. Мышечные волокна окрашены в красный цвет, коллагеновые в синий. На продольном срезе поперечно-полосатых мышечных волокон видна их цилиндрическая форма. Снаружи мышечное волокно покрыто сарколеммой, которая на препарате имеет вид контурной линии. Вокруг каждого волокна видны тонкие прослойки эндомизия (рыхлой соединительной ткани), оплетающие отдельные волокна. ТS – поперечный разрез, С – разрезы капилляров, Р – перимизий – прослойки рыхлой соединительной ткани, окружающие пучки мышечных волокон. ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ СКЕЛЕТНОЙ МЫШЕЧНОЙ ТКАНИ Скелетная (соматическая) мышечная ткань образована пучками поперечнополосатых мышечных волокон, являющихся ее структурно-функциональными единицами. Всего в скелетных мышцах человека содержится порядка 300 млн. мышечных волокон (рис. 7.1, 7.2).
Рис. 7.2. На микрофотографии (х 320) изображена: Скелетная мышца А – продольный разрез, Б – поперечный разрез Поперечно-полосатые волокна имеют цилиндрическую форму, расположены параллельно друг другу, ядра лежат под сарколеммой. Волокна имеют поперечную исчерченность. Между волокнами – эндомизий. С – разрезы капилляров, Р – перимизий. МЫШЕЧНОЕ ВОЛОКНО скелетной (соматической) мышечной ткани представляет собой цилиндрическое образование диаметром 10-100 мкм (в среднем - Миосимпластическая часть мышечного волокна включает от нескольких сотен до нескольких тысяч ядер, лежащих на периферии под сарколеммой, и саркоплазму, образующую его центральную часть. Саркоплазма миосимпласта содержит все органеллы общего значения (за исключением центриолей) и некоторые специальные органеллы, а также включения. Эти структуры образуют несколько функциональных аппаратов: 1) сократительный, 2) передачи возбуждения (с сарколеммы на сократительный аппарат), 3) опорный, 4) энергетический, 5) синтетический, 6) лизосомальный (аппарат внутриклеточного переваривания). Сократительный аппарат мышечного волокна представлен миофибриллами – специальными органеллами, которые располагаются продольно в центральной части саркоплазмы и отделяются друг от друга рядами вытянутых митохондрий и цистерн саркоплазматической сети. Миофибриллы имеют вид нитей диаметром 1-2 мкм и длиной, сопоставимой с протяженностью волокна. Их количество в отдельном волокне варьирует в широких пределах (от нескольких десятков до 2000 и более). Они обладают собственной поперечной исчерченностью. А- и I-диски одних миофибрилл точно совпадают с аналогичными дисками других, обусловливая поперечную исчерченность всего волокна. Структурно-функциональной единицей миофибриллы является саркомер (миомер). Поперечная исчерченностъ скелетных мышечных волокон обусловлена чередованием темных А-дисков (анизотропных, обладающих двойным лучепреломлением в поляризованном свете) и светлых 1-дисков (изотропных, не обладающих двойным лучепреломлением). Каждый диск I рассекается надвое тонкой темной Z, называемой также телофрагмой. В середине А-диска определяется светлая зона – полоска Н, через центр которой проходит М-линия - мезофрагма (рис. 7.3).
Рис. 7.3. Строение скелетного мышечного волокна (1), миофибриллы (2) и расположение в последней миофиламентов (3). В мышечном волокне (MB) в целом и каждой миофибрилле (МФ), входящей в его состав, выявляются чередующиеся темные анизотропные А-диски (А) и светлые изотропные I-диски (I). Последние рассекаются надвое телофрагмой, или Z-линией (Z), а в середине первых определяется светлая полоска Н (Н), через центр которой проходит М-линия (М). СМ - саркомер, ЯМС - ядра миосимпласта, МСЦ - миосателлитоцит, БМ - базальная мембрана, СЛ - сарколемма. В пределах СМ каждый толстый миофиламент (ТЛМФ) окружен шестью тонкими миофиламентами (ТНМФ).
Саркомер (миомер) представляет собой участок миофибриллы, расположенный между двумя телофрагмами (Z-линиями) и включающий А-диск и две половины 1-дисков - по одной половине с каждой стороны (см. рис. 7.3; 7.6). В расслабленной мышце длина саркомера составляет около 2-3 мкм, а ширина его участков выражается соотношением Н: А: I = 1: 3: 2; при сокращении мышцы саркомер укорачивается до 1.5 мкм. Миофибрилла типичного мышечного волокна человека длиной около 5 см насчитывает порядка 20 тыс. последовательно расположенных саркомеров. Структура саркомера представлена упорядоченной системой толстых и тонких белковых нитей (миофиламентов). Толстые нити (диаметром около 10-12 нм и длиной 1.5-1.6 мкм) связаны с мезофрагмой и сосредоточены в А-диске, а тонкие (диаметром 7-8 нм и длиной 1 мкм) прикреплены к телофрагмам, образуют I-диски и частично проникают в А-диски между толстыми нитями (более светлый участок А-диска, свободный от тонких волокон, называется полоской Н). В саркомере насчитывается несколько сотен толстых нитей. По сечению саркомера толстые и тонкие нити располагаются высокоорганизованно в узлах гексагональной решетки. Каждая толстая нить окружена шестью тонкими, каждая из тонких нитей частично входит в окружение трех соседних толстых (см. рис. 7.3). Толстые нити (миофиламенты) образованы упорядоченно упакованными молекулами фибриллярного белка миозина, на который приходится около 54% всех белков миофибриллы. Молекула миозина имеет вид нити длиной 150 нм и толщиной 2 нм. На одном из концов эта молекула содержит две округлые головки длиной около 20 нм и шириной около 4 нм (рис. 7.4). Протеолитическими ферментами миозин расщепляется на две фракции – легкий меромиозин ("стержень" молекулы миозина) и тяжелый меромиозин (участки головок и шейки, связывающие их со стержневой частью). Молекула миозина может сгибаться, как на шарнирах, в месте соединения тяжелого меромиозина с легким и в области прикрепления головки. Стержневые части молекул миозина собраны в пучки (численностью до 200 и более) (рис. 7.4 (2)). Такие пучки, соединенные зеркально концами друг с другом в области М-линии, формируют толстые нити с центральной гладкой частью длиной около 0.2 мкм и двумя периферическими участками, в которых от центрального стержня отходят миозиновые головки (около 500). Миозин головок обладает АТФазной активностью (способностью осуществлять гидролиз АТФ), однако в отсутствие его взаимодействия с актином скорость гидролиза АТФ ничтожно мала.
Рис. 7.4. Строение толстых миофиламентов (по К.Де Дюву, 1987, с изменениями). 1 - молекула миозина имеет вид нити с двумя головками (Г) на одном конце. Миозин включает легкий меромиозин (ЛММ), образующий стержневую часть молекулы, и тяжелый меромиозин (ТММ), соответствующий участкам Г и связующей шейки. Участки сгибания молекулы миозина показаны стрелками. 2 - стержневые части молекул миозина собраны в пучки (П), снаружи которых располагаются миозиновые Г. 3 - толстые миофиламенты (ТЛМФ) образованы П молекул миозина, соединенными зеркально концами друг с другом. Центральная часть ТЛМФ - гладкая, периферическая содержат многочисленные миозиновые Г. Тонкие нити (миофиламенты) содержат сократимый белок актин (на него приходится 20% белков миофибриллы) и два регуляторных белка – тропонин (около 2%) и тропомиозин (около 7%). Последние формируют функционально единый тропонин-тропомиозиновый комплекс. Актин в мономерной форме представлен полярными глобулярными субъединицами диаметром 4-5 нм (G-актин), которые имеют активные центры, способные связываться с молекулами миозина. G-актин агрегирует с образованием полимерного фибриллярного актина (F-актина), молекула которого имеет вид двух скрученных нитей толщиной 7 нм и вариабельной длины (рис. 7.5).
Рис. 7.5. Строение тонких миофиламентов. Тонкие миофиламенты (ТНМФ) содержат сократимый белок актин (АКТ) и два регуляторных белка - тропонин (ТРН) и тропомиозин (ТРМ). Глобулярные субъединицы АКТ (G-AKT), агрегируют с образованием фибриллярного АКТ (F-AKT), молекула которого имеет вид двух скрученных нитей. ТРМ образован нитевидными молекулами, соединяющимися своими концами и образующими тяж, лежащий в борозде молекулы F-AKT. ТРН - глобулярный белок, связанный с молекулой ТРМ и формирующий с ней функционально единый комплекс ТРН-ТМ.
Тропомиозин представлен нитевидными молекулами, которые соединяются своими концами, образуя длинный тонкий тяж, лежащий в борозде, образуемой перевитыми нитями F-актина. Так как таких борозд на молекуле актина две, то и тропомиозиновых нити тоже две. Всего в состав тонкой нити входит примерно 50 молекул тропомиозина. Тропонин представляет собой глобулярный белок, каждая его молекула располагается на тропомиозиновой молекуле вблизи ее конца. Тропонин состоит из трех субъединиц: ТпС – связывающей кальций, ТпТ – прикрепляющейся к тропомиозину, и Tnl – ингибирующей связывание миозина с актином. Механизм мышечного сокращения описывается теорией скользящих нитей, согласно которой укорочение каждого саркомера (а, следовательно, миофибрилл и всего мышечного волокна) при сокращении происходит благодаря тому, что тонкие нити вдвигаются в промежутки между толстыми без изменения их длины (рис. 7.6). Скольжение нитей в саркомере и усилие, развиваемое мышцей, обеспечиваются благодаря циклической активности миозиновых мостиков, которые при сокращении повторно прикрепляются к актину, обеспечивают усилие тяги, а затем открепляются от него (рис. 7.7). В этом механизме АТФ играет двойную роль, обеспечивая энергию, необходимую как для осуществления сокращения, так и для открепления мостиков.
Рис. 7.6. Механизм мышечного сокращения в соответствии с теорией скользящих нитей. Укорочение саркомеров (СМ) при сокращении (2) по сравнению с их состоянием в покое (1) происходит благодаря тому, что тонкие миофиламенты (ТНМФ) вдвигаются в промежутки между толстыми (ТЛМФ) без изменения их длины. Остальные обозначения - как на рис. 13-3.
Рис. 7.7. Молекулярные механизмы мышечного сокращения.,1 - в покое миозиновые головки (МГ), с которыми связаны молекулы АТФ, неспособны взаимодействовать с активными центрами (АЦ) на молекуле актина (АКТ), потому что последние прикрыты комплексом тропонин-тропомиозин (ТРН-ТРМ). 2 - мышечное сокращение начинается вследствие повышения концентрации Са2+, который воздействует на ТРН. Возникающее изменение конформации ТРН и смещение молекулы связанного с ним ТРМ демаскирует АЦ на молекуле АКТ, с которыми связываются МГ, образуя поперечные мостики. 3 - за счет сгибания МГ в области их прикрепления к молекуле АКТ развивается усилие, смещающее тонкие миофиламенты (ТНМФ) вдоль толстых (ТЛМФ) к центру саркомера (см. рис. 13-06). АТФ при этом гидролизуется до АДФ и фосфата (Pi). 4 - размыкание мостика и его отделение от ТНМФ наступают вследствие связывания с ним новой молекулы АТФ. Далее мостик принимает исходное положение (перпендикулярное ТНМФ) и начинается новый цикл сокращения. Циклическое взаимодействие МГ и ТНМФ будет продолжаться при сохранении высокой концентрации ионов Са2+ и наличии АТФ.
В покое (при очень низкой концентрации ионов Са2+) в миофибрилле расслабленного мышечного волокна толстые и тонкие нити не соприкасаются. Миозиновые головки (с которыми связаны молекулы АТФ) не могут взаимодействовать с активными центрами (участками связывания миозина) на молекуле актина, потому что последние прикрыты тропонин-тропомиозиновым комплексом. Толстые и тонкие филаменты беспрепятственно скользят друг относительно друга. При этом мышечные волокна почти не сопротивляются пассивному растяжению. Мышечное сокращение вызывается резким повышением концентрации ионов Са2+ в области миофиламентов и включает несколько этапов (см. рис. 7.7). А. Связывание ионов Са2+ с тропонином и освобождение активных центров на молекуле актина. При этом тропонин изменяет свою конформацию, смещает молекулы тропомиозина и открывает активные центры (участки связывания миозина) на молекуле актина. Б. Связывание миозина и актина (формирование поперечных мостиков). Миозиновые головки связываются с активными центрами на молекуле актина, формируя мостики, расположенные перпендикулярно продольной оси нити. Менее чем через 1 мс после этого под влиянием актомиозинового комплекса происходит гидролиз АТФ и отщепление его продуктов (АДФ и неорганического фосфата). При этом угол наклона мостика относительно продольной оси нити изменяется до 40°. Такой конформационный переход, происходящий в области прикрепления головки миозиновой молекулы, обусловливает развитие усилия и смещение тонких филаментов к центру саркомера. Предполагается, что "рабочий ход" миозинового мостика составляет около 10 нм. Таким образом, за один цикл мостик вызывает относительное перемещение тонких нитей на расстояние, равное примерно 1/200 длины саркомера. B. Размыкание мостика. Связывание новой молекулы АТФ с мостиком вызывает его отделение от тонкого филамента. Мостик размыкается, возвращаясь в прежнее положение относительно миозиновой нити и может прийти в замыкание со следующим активным центром на тонкой. Каждый цикл замыкания-размыкания сопровождается расщеплением молекулы АТФ. В живой мышце это осуществляется с интервалом в несколько десятков миллисекунд после присоединения новой молекулы АТФ. В трупной мышце, где АТФ отсутствует, мостик не может разомкнуться, и мышца переходит в состояние трупного окоченения. При сокращении мышцы не происходит одновременного замыкания всех мостиков – их число нарастает по ходу его развития. При последующем расслаблении мышцы число мостиков снижается.
Аппарат передачи возбуждения (саркотубулярная система) необходим для того, чтобы распространяющаяся по сарколемме волна деполяризации могла вызвать срабатывание сократительного аппарата миофибрилл. В мышечном волокне связь между возбуждением и сокращением выполняют две специализированные мембранные системы - саркоплазматическая сеть и поперечные (Т-) трубочки (от англ. transverse - поперечный), образующие функционально единую саркотубулярную систему (рис. 7.8)
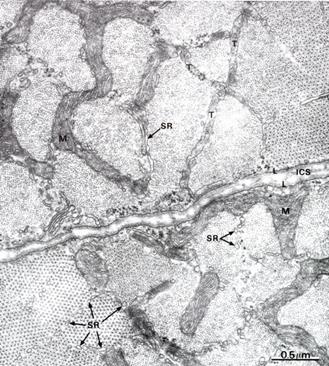
Рис. 7.8. На электронной микрофотографии (x 44.000) изображен: Поперечный срез скелетной мышцы сделанный на уровне соединений А и J дисков. Хорошо видны детали строения СПР (SR). SR располагается между миофибриллами. ICS – intracellular space – внутриклеточное пространство, L – наружная пластинка, Т – трубочки, М – митохондрии.
Саркоплазмашическая сеть - система уплощенных, вытянутых и анастомозирующих мембранных трубочек и мешочков, которая окружает каждый саркомер, миофибриллы наподобие муфты. В области наружных отделов А- и I-дисков трубочки сливаются, образуя пары плоских терминальных цистерн (на каждый саркомер приходится по две такие пары). Саркоплазматическая сеть обладает выраженной способностью депонировать и выделять ионы кальция. Ее мембрана содержит высокие концентрации интегральных белков, являющихся кальциевыми насосами, а на внутренней поверхности находится белок кальсеквестрин, связывающий ионы Са2+. Поперечные (Т-) трубочки представляют собой впячивания сарколеммы, отходящие от нее под прямым углом к оси волокна и расположенные у млекопитающих вблизи границы I- и А- дисков. Ветви соседних Т-трубочек опоясывают каждый саркомер и анастомозируют друг с другом. Конечные участки Т-трубочек проникают в промежуток между двумя терминальными цистернами саркоплазматической сети (см. рис. 7.7), формируя вместе с ними особые структуры - триады. В области триады между параллельно лежащими мембранами Т-трубочки и терминальных цистерн, разделенными узкой щелью, имеются специализированные контакты, которые образованы рядами плотных частиц (ножек), предположительно служащие каналами выделения кальция. Выделение кальция происходит после того, как волна деполяризации с поверхности сарколеммы по Т-трубочкам распространяется вглубь волокна. В области триад возбуждение передается на мембрану саркоплазматической сети и вызывает повышение ее проницаемости. Это приводит к быстрому выделению из ее элементов ионов кальция (главным образом, в области терминальных цистерн). Выделившийся Са2+ диффундирует в миофибриллы, где он, присоединяясь ктропонину, запускает механизм взаимодействия актина и миозина. Концентрация Са2+ вокруг миофиламентов при этом резко повышается с 10-7М до 10-5М. Активный обратный транспорт кальция в саркоплазматическую сеть (секвестрация кальция) происходит наряду с его выбросом, который представляет собой кратковременный процесс.
Телофрагма (Z-линия) - область прикрепления тонких миофиламентов двух соседних саркомеров; она имеет вид плотной полоски шириной 30-100 нм без резких границ. Мезофрагма (М-линия) - плотная линия шириной 75-85 нм, расположенная в центре А-диска и являющаяся областью закрепления толстых (миозиновых) филаментов в саркомере. Структура краевых участков мышечных волокон. На концах мышечных волокон сарколемма, покрытая базальной мембраной, образует многочисленные глубокие впячивания, в которые вдаются коллагеновые волокна сухожилия, вплетающиеся в базальную мембрану и прочно связывающие сухожилие с мышечными волокнами. Энергетический аппарат мышечных волокон представлен митохондриями, вырабатывающими энергию, необходимую для осуществления мышечной работы, синтетических, транспортных и других процессов жизнеобеспечения, а также трофическими включениями (гликоген, липиды, миоглобин), содержащими вещества, расщепление которых служит источником энергии. Синтетический аппарат мышечного волокна представлен свободными рибосомами и полирибосомами (особенно многочисленными под сарколеммой в области I-диска и вблизи ядер), цистернами грЭПС и комплексом Гольджи, элементы которого в виде сотен или тысяч стопок мешочков рассеяны по саркоплазме миосимпласта. Лизосомальный аппарат (аппарат внутриклеточного переваривания) в мышечных волокнах необходим для обеспечения постоянно протекающего процесса обновления его структурных компонентов. Содержание лизосом связано с функциональной активностью мышцы и возрастом человека. Остаточные тельца лизосомального генеза, содержащие липофусцин, становятся многочисленными при старении и, в особенности, при резком снижении функциональной активности мышцы.
Типы мышечных волокон Выделяют три основных типа мышечных волокон, между которыми существуют переходные варианты (рис. 7.9): тип I (красные), тип IIВ (белые) и тип IIА (промежуточные). Тип I - красные, медленные, тонические, устойчивые к утомлению, с небольшой силой сокращения, окислительные. Характеризуются малым диаметром, относительно тонкими миофибриллами, высокой активностью окислительных ферментов, преобладанием аэробных процессов, высоким содержанием миоглобина (определяющим их красный цвет). Численно преобладают в мышцах, выполняющих длительные тонические нагрузки.
Рис. 7.9. Типы мышечных волокон в скелетной мышце. На препарате – поперечном срезе мышечных волокон – проведено гистохимическое выявление фермента сукцинатдегидрогеназы (СДГ). Плотность продукта гистохимической реакции пропорциональна активности СДГ. Представлены три основных типа мышечных волокон: тип I (I) - красные (с высокой активностью СДГ), тип ИВ (ИВ) – белые (с низкой активностью СДГ) и тип НА (НА) – промежуточные (с умеренной активностью СДГ).
Тип IIВ - белые, быстрые, тетанические, легко утомляющиеся, с большой силой сокращения, гликолитические. Характеризуются большим диаметром, крупными и сильными миофибриллами, низкой активностью окислительных ферментов, преобладанием анаэробных процессов, низким содержанием липидов и миоглобина (определяющим их светлый цвет), Преобладают в мышцах, выполняющих быстрые движения, например, мышцах конечностей. Тип IIА - промежуточные, быстрые, устойчивые к утомлению, с большой силой, оксилительно-гликолитические. На препаратах напоминают волокна типа I. В равной степени способны использовать энергию, получаемую путем окислительных и гликолитических реакций. По своим морфологическим и функциональным характеристикам занимают положение, промежуточное между волокнами типа I и ПВ.
СКЕЛЕТНАЯ МЫШЦА КАК ОРГАН Скелетная мышца состоит из пучков мышечных волокон, связанных воедино системой соединительнотканных компонентов. Количество мышечных волокон в отдельных мышцах человека варьирует в широких пределах. Так, в четырехглавой мышце бедра (m. quadriceps femoris) оно составляет около 1.7 млн., икроножной мышце (m. gastrocnemius) - 1-1.5 млн., портняжной мышце (m. sartorius) – 100-200 тыс., в двуглавой и трехглавой мышцах плеча (m. biceps и т. triceps brachii) оно примерно одинаково и колеблется в пределах 200-600 тыс. Соединительнотканные компоненты мышцы представлены эпимизием, перимизием и эндомизием (рис. 7.10, 7.11). Общее содержание соединительной ткани в скелетной мышце очень значительно – в зависимости от типа мышцы коллаген соединительной ткани составляет от 3 до 30% ее белков.
Рис. 7.10. Структурная организаций скелетной мышцы. Мышца (М) покрыта эпимизием (ЭПМ), отдающим вглубь более тонкие соединительнотканные перегородки - перимизий (ПМ), который образует оболочки пучков мышечных волокон (ПМВ). От ПМ внутрь ПМВ отходят тончайшие прослойки рыхлой волокнистой соединительной ткани, окружающие каждое мышечное волокно (MB), именуемые эндомизием (ЭНМ). MB покрыто сарколеммой (СЛ) и базальной мембраной (не показана) и обладает поперечной исчерченностью; в его центральной части содержатся поперечно исчерченные миофибриллы (МФБ), образованные системой тонких и толстых миофиламентов - МФЛ.
Рис. 7.11. Строение мышцы как органа. Мышечные волокна (Muscle fibers) образуют пучки (Fasciculi), каждый из которых соединен рыхлой соединительной тканью – перимизием (Perimysium), снаружи мышца покрыта соединительной тканью, образующей эпимизий (Epimysium). Между волокнами расположены прослойки соединительной ткани – эндомизий (Endomysium). В эндо-, пери- и эпимизии проходят сосуды (blood vessels) и нервы (nerves). Эпимизий - тонкий, прочный и гладкий снаружи чехол из плотной волокнистой соединительной ткани, окружающий всю мышцу. Перимизий - тонкие, разветвляющиеся и не всегда четко очерченные соединительнотканные перегородки, отходящие от внутренней поверхности эпимизия вглубь мышцы. Он образует оболочки отдельных пучков мышечных волокон, численностью 10-100 (наиболее часто - около 20) волокон.
|
||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 475; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.57 (0.016 с.) |



 Б
Б









 Опорный аппарат мышечного волокна включает особые элементы цитоскелета, обеспечивающие высокоупорядоченное расположение миофиламентов и миофибрилл внутри волокна, а также связанную с ними сарколемму и базальную мембрану, соединяющие мышечное волокно с сухожилием, на которое передается усилие, развиваемое волокном при сокращении. К опорным элементам относятся телофрагма и мезофрагма.
Опорный аппарат мышечного волокна включает особые элементы цитоскелета, обеспечивающие высокоупорядоченное расположение миофиламентов и миофибрилл внутри волокна, а также связанную с ними сарколемму и базальную мембрану, соединяющие мышечное волокно с сухожилием, на которое передается усилие, развиваемое волокном при сокращении. К опорным элементам относятся телофрагма и мезофрагма.


 Эндомизий - тончайшие прослойки рыхлой волокнистой соединительной ткани, отходящие от перимизия внутрь пучков мышечных волокон и окружающие каждое мышечное волокно. Соединительнотканные волокна эндомизия вплетаются в базальную мембрану мышечных волокон.
Эндомизий - тончайшие прослойки рыхлой волокнистой соединительной ткани, отходящие от перимизия внутрь пучков мышечных волокон и окружающие каждое мышечное волокно. Соединительнотканные волокна эндомизия вплетаются в базальную мембрану мышечных волокон.


