
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення фізичних властивостей на іономіріСодержание книги
Поиск на нашем сайте
Визначення рН Залити у стакан досліджувану воду, встановити його на штативі так, щоб електроди були занурені у воду. Підключити датчик до приладу, штекер скляного електроду включити в перше гніздо (чорний провід) на задній панелі приладу. Підключити прилад в сітку мережі електричного струму за допомогою шнура і включити тумблер “СЕТЬ”, на передній панелі приладу засвітиться контрольна лампочка. Натискаємо клавіші лівого ряду: біла верхня, біла нижня; у правому ряді – білу верхню. Проводимо відлік по нижній шкалі приладу результатів заміру рН. Для уточнення результатів заміру рН в правому ряді клавіш приладу, де вказані “ПРЕДЕЛЫ ИЗМЕРЕНИЯ” натискаємо клавішу відповідного діапазону вимірювань “4-9”. Проводимо відлік по верхній шкалі приладу. Одержаний результат вимірювання додаємо до нижнього попереднього показника заданого інтервалу вимірювань “0 - 4”. Визначення Еh Для проведення заміру натискуємо чорну клавішу – компенсатор температур. На задній панелі приладу в гніздо “ИЗМЕРЕНИЯ” включаємо штекер платинового електроду. Прилад включаємо у мережу з електричним струмом. На передній панелі приладу натискуємо клавіші: другу білу знизу у лівому ряді і верхню у правому ряді. По нижній шкалі приладу беремо відлік результатів вимірювання Eh і множимо одержаний результат на 100. Для уточнення результатів заміру Еh в правому ряді клавіш приладу, де вказані “ПРЕДЕЛЫ ИЗМЕРЕНИЯ” натискаємо клавішу відповідного діапазону вимірювання. Проводимо відлік по верхній шкалі приладу. Одержані результати заміру додаємо до нижнього показника заданого інтервалу вимірювань.
ОФОРМЛЕННЯ ЗВІТУ Результати досліджень записують у формі таблиці:
КОНТРОЛЬНІ ЗАПИТАННЯ 1 що таке густина води і від яких величин вона залежить? 2 Що таке відносна густина? 3 Для характеристики якої величини використовуються градуси Боме? 4 Від чого залежать лужно-кислотні властивості води? 5 Що визначає величина рН? 6 Що таке мінералізація води? 7 Що визначає величина Eh? ЛІТЕРАТУРА
1 Колодій В.В., Колодій І.В., Маєвський Б.Й. Нафтогазова гідрогеологія. Підручник для ВНЗ. – Івано-Франківськ: Факел, 2009.–184 с. 2 Ляху М.В. Нафтогазова гідрогеологія: Конспект лекцій 2-ге видання зі змінами і доповненнями – івано-Франківськ: ІФНТУНГ, 2010. – 103 с. 3 Карцев А.А., Вагин С.Б., Шурин В.П. Нефтегазовая гидрогеология. М., Недра, 1992. Глава “Основы гидрохимии”. 4 Карцев А.А. Гидрогеология нефтяных и газовых месторождений. М., Недра, 1972. Раздел “Основы гидрохимии”. 5 Шугрин В.П. Нефтегазопромысловая гидрогеология. М., Недра, 1973. Раздел “Основы гидрохимии”. Лабораторна робота №2
ВИЗНАЧЕННЯ ВМІСТУ ХЛОР-ІОНІВ У ПІДЗЕМНИХ ВОДАХ НАФТОВИХ І ГАЗОВИХ РОДОВИЩ
Мета і завдання роботи
Вміст хлор-іонів у підземних водах визначається аналітичним шляхом. З погляду на те, що води нафтових і газових родовищ являють собою в основному розсоли і солені води, де домінують хлор-іони, тому визначення хлор-іонів рекомендується проводити в розведеній пластовій воді в залежності від її початкової мінералізації в співвідношенні 1:100 або 1:10. Для розведення використовується дистильована вода.
Основні теоретичні положення
Визначення хлор-іонів проводиться титруванням іона
Обладнання, прилади, реактиви
Титрувальний стіл, бюретка об’ємом 10 мл, колби об’ємом 50-100мл. Реактиви: розчин хромовокислого калію 10 %, розчин азотнокислого срібла 0,1н. ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ
Проводять два визначення хлор-іонів: орієнтовне і точне. Якщо за даними орієнтовного визначення вода має багато хлоридів, воду для точного визначення відбирають з таким розрахунком, щоб на одне визначення пішло 3-20 мл 0,1н розчину азотнокислого срібла. ОРІЄНТОВНЕ ВИЗНАЧЕННЯ: у пробірку наливають 5 мл досліджуваної води, додають одну каплю 10% розчину хромовокислого калію. Потім постійно перемішуючи, добавляють по каплях 0,1н розчин азотнокислого срібла до незникаючого бурого кольору. При множенні числа використаних капель на 0,02 одержують приблизно вміст хлор-іону у розчині в г/л. ТОЧНЕ ВИЗНАЧЕННЯ: якщо при орієнтовному визначенні вміст хлор-іону не перевищує 0,400 г/л, точне визначення проводиться у 100 мл води. При більш високих складах хлоридів для визначення відбирають відповідно менший об’єм або користуються точно розведеним вихідним розчином. До відміреного об’єму (10 мл) досліджуваної води (розведеної у співвідношенні 1:10) додають 5 крапель хромату калію і повільно титрують при неперервному перемішуванні 0,1н розчином азотнокислого срібла до переходу жовтуватого кольору у рожево-бурий, що не зникає при перемішуванні. При титруванні рекомендується порівнювати колір досліджуваної води з кольором стандарту, який готується додаванням повареної солі до відтитрованої проби. Від добавки повареної солі бурий колір розчину переходить в світлий, в зеленувато-жовтий. Визначення хлоридів за цим методом правильно тільки у тому випадку, коли рН розчину, в якому визначають хлор-іон, не менше 7 і не більше 10,5. Якщо рН розчину більше 10,5, тоді до проби розчину, відібраної для визначення іону хлору, додають 2-3 краплі 0,1 % розчину фенолфталеїну і по краплям розведену (не менше 1:5) азотну кислоту для прозорості розчину. Якщо досліджувана вода має кислу реакцію, то таку пробу нейтралізують 0,1н розчином їдкого натрію, застосовуючи у якості індикатора той же розчин фенолфталеїну і знебарвлюють потім воду однією краплею азотної кислоти. Якщо вода має у собі сірководень, від нього звільняються кип’ятінням її в азотнокислому середовищі. Кількість хлор-іонів розраховують так:
де а – кількість розчину азотнокислого срібла у мл, витрачене на титрування, н – нормальність розчину азотнокислого срібла, у – об’єм проби взятої для титрування (з врахуванням розведення), 35,5 – еквівалентна вага хлору.
ОФОРМЛЕННЯ ЗВІТУ результати досліджень записують у формі таблиці:
КОНТРОЛЬНІ ЗаПИТАННЯ
1 Яким методом визначаються хлор-іони у природній воді? 2 Для чого проводиться розведення пластових вод нафтових і газових родовищ при визначенні хлор-іонів? 3 Що таке розсоли? 4 Чому у розсолах завжди домінують хлор-іони?
ЛІТЕРАТУРА
1 Колодій В.В., Колодій І.В., Маєвський Б.Й. Нафтогазова гідрогеологія. Підручник для ВНЗ. – Івано-Франківськ: Факел, 2009.–184 с. 2 Ляху М.В. Нафтогазова гідрогеологія: Конспект лекцій. 2-ге видання зі змінами і доповненнями – івано-Франківськ: ІФНТУНГ, 2010. – 103 с. 3 Карцев А.А., Вагин С.Б., Шурин В.П. Нефтегазовая гидрогеология. М., Недра, 1992. Глава “Основы гидрохимии”. 4 Карцев А.А. Гидрогеология нефтяных и газовых месторождений. М., Недра, 1972. Раздел “Основы гидрохимии”. 5 Шугрин В.П. Нефтегазопромысловая гидрогеология. М., Недра, 1973. Раздел “Основы гидрохимии”.
Лабораторна робота №3
ВИЗНАЧЕННЯ ВМІСТУ КАЛЬЦІЮ І МАГНІЮ У ПІДЗЕМНИХ ВОДАХ НАФТОВИХ І ГАЗОВИХ РОДОВИЩ
Мета і завдання роботи
Визначення кальцію і магнію у пластових водах нафтових і газових родовищ проводиться трилонометричним методом. Даний метод являється найбільш простим і точним. Однак варто пам'ятати, що точність визначення кальцію у два рази перевищує точність визначення магнію і похибки у визначенні кальцію автоматично посилюють похибки у визначенні магнію (у випадку завищення вмісту кальцію вміст магнію занижується і навпаки).
Основні теоретичні положення
Трилонометричне визначення засновано на реакції взаємодії іонів кальцію і магнію з трилоном Б з утворенням стійких з’єднань добре розчинених у воді. В якості індикатора для титрування при визначенні суми кальцію і магнію застосовують хромоген чорний ЕТ-00. У присутності іонів кальцію і магнію у досліджуваному розчині індикатор утворює у лужному середовищі при рН=10-12 комплексне з’єднання, яке забарвлює розчин у винно-червоний колір. При титруванні досліджуваного розчину трилон Б спочатку вступає в реакцію з іонами кальцію, а потім з іонами магнію. У точці еквівалентності червоне забарвлення індикатора переходить в синє. У іншому рівному об’ємі досліджуваного розчину титрують трилоном Б кальцій також у лужному середовищі з індикатором мурексидом, який являє собою амонійну сіль пурпурної кислоти. У точці еквівалентності рожево-червоний колір переходить у фіолетовий.
Обладнання, прилади, реактиви
Титрувальний стіл, бюретки об’ємом 2 мл, конічні колби об’ємом 250 мл, мірний циліндр об’ємом 100 мл. Реактиви: аміачно-буферний розчин, розчин хромогена чорного, розчин мурексиду, розчин трилона Б (0,1н), розчин їдкого натрію (10%).
ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ Визначення сумарного вмісту кальцію і магнію У конічну колбу об’ємом 250 мл відбирають піпеткою 2 мл досліджуваної води. При великому вмісті кальцію і магнію досліджувану воду розводять дистильованою водою. Об’єм відібраної проби для аналізу доводять до 100 мл, додають 5 мл аміачно-буферного розчину, 7-8 крапель розчину хромогену чорного і титрують 0,1н розчину трилону Б, інтенсивно перемішуючи воду у колбі. До кінця титрування забарвлення води переходить від винно-червоного до фіолетового, після чого розчин трилону Б додають по одній краплі до переходу забарвлення у синій колір (до точки еквівалентності). Сумарний вміст кальцію і магнію розраховують за формулою:
де а – кількість трилону Б, що пішла на титрування; н – нормальність трилону Б; y – об’єм води, взятої для аналізу в мл. ВИЗНАЧЕННЯ ВМІСТУ КАЛЬЦІЮ
У конічну колбу на 250 мл відбирають такий же об’єм досліджуваної води, як для сумарного визначення кальцію і магнію. Додають 2 мл 10% розчину їдкого натрію і доводять об’єм до 100 мл. Додають 0,2-0,3 г (або 5 крапель) порошку мурексиду і титрують розчином трилону Б на білому фоні до переходу рожево-червоного кольору у фіолетовий. Зміна забарвлення проходить поступово, але перехід від блідо-рожевого у фіолетовий досить різкий. Вміст кальцію визначають за формулою:
або
де 20 – еквівалентна вага кальцію; н – нормальність трилона Б; а – кількість трилону Б, що пішла на титрування в мл.
ВИЗНАЧЕННЯ МАГНІЮ
Вміст магнію визначають розрахунковим шляхом, як різницю між сумою кальцію і магнію та кальцієм.
де 12,2 – еквівалентна вага магнію.
ОФОРМЛЕННЯ ЗВІТУ Результати визначень записують у формі таблиці:
КОНТРОЛЬНІ ЗАПИТАННЯ 1 Суть трилонометричного методу визначення кальцію і магнію у воді? 2 Які властивості води визначають солі кальцію і магнію? 3 Що таке твердість води? 4 Які види твердості ви знаєте? 5 Чому у глибинних розсолах домінує іон кальцію над іоном магнію?
ЛІТЕРАТУРА 1 Колодій В.В., Колодій І.В., Маєвський Б.Й. Нафтогазова гідрогеологія. Підручник для ВНЗ. – Івано-Франківськ: Факел, 2009.–184 с. 2 Ляху М.В. Нафтогазова гідрогеологія: Конспект лекцій. 2-ге видання зі змінами і доповненнями – івано-Франківськ: ІФНТУНГ, 2010. – 103 с. 3 Карцев А.А., Вагин С.Б., Шурин В.П. Нефтегазовая гидрогеология. М., Недра, 1992. Глава “Основы гидрохимии”. 4 Карцев А.А. Гидрогеология нефтяных и газовых месторождений. М., Недра, 1972. Раздел “Основы гидрохимии”. 5 Шугрин В.П. Нефтегазопромысловая гидрогеология. М., Недра, 1973. Раздел “Основы гидрохимии”. Лабораторна робота №4
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 189; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.215.149 (0.012 с.) |

 0,1н розчином азотнокислого срібла у присутності індикатора хромовокислого калію. Перша капля надлишкового розчину срібла утворює з індикатором осад хромовокислого срібла, що забарвлює розчин у кров’яно-бурий колір. Зміна кольору титрованого розчину від зеленувато-жовтого до кров’яно-бурого вказує на кінець титрування.
0,1н розчином азотнокислого срібла у присутності індикатора хромовокислого калію. Перша капля надлишкового розчину срібла утворює з індикатором осад хромовокислого срібла, що забарвлює розчин у кров’яно-бурий колір. Зміна кольору титрованого розчину від зеленувато-жовтого до кров’яно-бурого вказує на кінець титрування. мг-екв/л, (2.1)
мг-екв/л, (2.1) мг/л, (2.2)
мг/л, (2.2)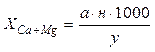 , (3.1)
, (3.1) – сумарний вміст кальцію і магнію в мг-екв/л;
– сумарний вміст кальцію і магнію в мг-екв/л; мг-екв/л, (3.2)
мг-екв/л, (3.2) мг/л, (3.3)
мг/л, (3.3)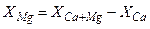 мг-екв/л, (3.4)
мг-екв/л, (3.4) мг/л, (3.5)
мг/л, (3.5)


