
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення сульфат-іону у підземних водах нафтових і газових родовищ. Використання вмісту сульфатів у водах для оцінки геохімічних умов у надрахСодержание книги
Поиск на нашем сайте
Мета і завдання роботи
Метою даної роботи є набуття студентами практичних навиків із аналітичного визначення сульфат-іону у водах нафтових і газових родовищ. При виконанні даної роботи перед студентами ставиться завдання: оволодіти методом аналітичного визначення сульфат-іону у воді з використанням фотоелектричного титрування, який дозволяє з високою точністю проводити комплекснометричне титрування водяних розчинів з низьким вмістом сульфатів. У процесі виконання роботи студент повинен: - навчитися визначати вміст сульфат-іонів у водних розчинах в різних формах; - навчитися розраховувати концентрацію сульфат-іонів у водних розчинах за даними аналітичних визначень з врахуванням розчинення вихідних водних розчинів; - засвоїти практичні навики з проведення аналітичних визначень вмісту сульфат-іонів у підземних водах нафтових і газових родовищ. Основні теоретичні положення
Сульфатність вод є характерною геохімічною особливістю підземних вод нафтогазових відкладів. Вона визначається вмістом сульфат-іону і коефіцієнтом сульфатності Процеси десульфатизації у природному середовищі досить поширені і можуть проходити у середовищі, де нафтових пластів немає. Однак, у нафтогазоносних районах ці процеси проходять більш активно, що і визначає вплив вуглеводнів на особливості солевого складу води, і перш за все, їх низьку сульфатність. Кількісна величина сульфат-іону у підземних водах у певній мірі залежить від генетичного типу води, літологічного складу водовміщуючих порід, інтенсивності процесу десульфатизації і ступеня гідрогеологічної “закритості” структури, у якій знаходиться досліджувана водонасичена товща. Пластові води нафтоносних товщ переважно мають високу температуру. При температурі 70°С і більше процес десульфатизації значно сповільнюється, і тому води можуть характеризуватись підвищеною сульфатністю (наприклад, води нафтових родовищ Грозненського району). При накопиченні у водах значної кількості кальцію, сульфат кальцію, який характеризується незначною розчинністю, останній випадає в осад. Наявність у воді хлористого натрію підвищує розчинність сульфатів кальцію. Метоморфізація води і зростання у ній вмісту хлориду кальцію веде до зниження розчинності сульфату кальцію і сульфатності. Тому низька сульфатність вод нафтогазоносних товщ є позитивним геохімічним показником, який використовується разом з іншими показниками у комплексі для оцінки нафтогазоносності надр.
Обладнання, прилади, реактиви
бюретка об’ємом 10 мл, колби об’ємом 250 мл – 2 шт., стакани об’ємом 150 мл – 2 шт., стакани хімічні – 2 шт., лійка – 2 шт., фільтрувальний папір, лакмусовий папір, вимірювальні циліндри на 10 мл. Реактиви: реактив-осаджувач, 20% розчин їдкого натрію, 10% сірчана кислота, 1% розчин дифеніл-аміну у сірчаній кислоті, розчин солі Мора (0,05н).
МЕТОДИЧНІ ВКАЗІВКИ З ПІДГОТОВКИ ДО ЗАНЯТЬ
Для визначення сульфатів у водах нафтових і газових родовищ проводять фотометричне титрування розчину за допомогою титриметра. Фотоелектричний титриметр (типу ФЭТ-УНИИЗ) при виконанні об’ємно-аналітичних визначень дозволяє визначити точку еквівалентності (кінець титрування) фотоелектричною індикацією. Для цього світловий потік, який випромінюється електролампою приладу і підсилений рефлектором, проходить через конденсорну лінзу, стакан з водою для титрування, інтерференційний світофільтр і потік, що сходиться попадає на приймач випромінення – фотопапір типу ФС-КІ. У процесі титрування досліджувана вода змінює свій колір. При цьому величина світопоглинання титрованого розчину в одних випадках – збільшується, в інших – зменшується. Це приводить до відповідної зміни величини фотоструму, що фіксується на шкалі мікроамперметра. У ході титрування весь процес зміни світопоглинання титрованих розчинів реєструється мікроамперметром. У точці еквівалентності стрілка мікроамперметра сигналізує про закінчення титрування повною зупинкою, поступовим зсувом вліво або вправо, або різким скачковидним переміщенням у той чи інший бік шкали. Кожний студент повинен провести аналітичну роботу по виданому завданню (досліджувана проба пластової води), використовуючи титриметр типу ФЭТ-УНИИЗ. На основі аналітичного визначення вмісту сульфат-іону у воді, розрахувати коефіцієнт сульфатності
ПОРЯДОК ПРОВЕДЕННЯ РОБОТИ
У конічну колбу об’ємом 250 мл наливають 50 мл досліджуваної води, додають 70 мл дистильованої води і 10 мл реактива-осаджувача. Одночасно таким же способом готують у колбі на 250 мл контрольний розчин, який не має у своєму складі досліджувану воду. Обидві колби з розчинами на газовому пальнику доводять до кипіння і кип’ятять протягом 3-х хвилин. Після їх охолодження обидва розчини нейтралізують декількома краплями 20% розчину їдкого натрію у присутності внутрішнього індикатора – лакмусового паперу. Індикаторний папір повинен набути брудно-зеленого кольору – нейтральне середовище (рН=7). Об’єм рідин в обох колбах доводять до мітки 250 мл дистильованою водою, перемішують і фільтрують через фільтрувальний папір у стакани. З кожної проби відбирають по 100 мл фільтрату у мірні стакани об’ємом 150 мл. Проби підкислюють 10 мл 10% сірчаної кислоти і додають 2-3 краплі 1% розчину дифеніл-аміну у сірчаній кислоті. Потім приступають до фотометричного титрування проби і контрольного розчину. Для цього стакан з пробою досліджуваної води встановлюють у циліндричний держак титриметра. Включають прилад, повертаючи ручку тумблера до включення лампи і регулюють ручкою компенсатора до встановлення стрілки мікроамперметра на поділку 80. Для титрування використовують розчин солі Мора (0,05н), який налитий в бюретку об’ємом 10 мл. Розчин титрують до різкого зсуву стрілки мікроамперметра у сторону великих поділок шкали. При цьому розчин забарвлюється в синій колір. Потім таким же методом титрують контрольний розчин. Після завершення титрування для кожного досліду беруть відлік розходу солі Мора по бюретці. Вміст сульфатів у воді визначають:
де а – розхід солі Мора у мл для титрування досліджуваної проби; в – розхід солі Мора у мл для титрування контрольного розчину; н – нормальність розчину солі Мора;
2,5 – коефіцієнт розведення; 48 – еквівалентна вага сульфат-іону.
ОФОРМЛЕННЯ ЗВІТУ
|
||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 298; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.131.37.82 (0.01 с.) |

 . У водах нафтових родовищ сульфатів дуже мало, або вони є в незначній кількості. Це пояснюється тим, що у відновному середовищі нафтових пластів сульфати віддають кисень для окислення вуглеводнів, тому сульфат-іон відсутній у хімічному складі води або залишається у незначній кількості. Замість сульфатів з’являється сірководень, який у водах нафтоносних товщ може накопичуватись до декількох сотень міліграм на літр.
. У водах нафтових родовищ сульфатів дуже мало, або вони є в незначній кількості. Це пояснюється тим, що у відновному середовищі нафтових пластів сульфати віддають кисень для окислення вуглеводнів, тому сульфат-іон відсутній у хімічному складі води або залишається у незначній кількості. Замість сульфатів з’являється сірководень, який у водах нафтоносних товщ може накопичуватись до декількох сотень міліграм на літр.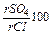 , відношення
, відношення  і дати геохімічну характеристику даної води, природного середовища, в якому вона знаходиться у надрах.
і дати геохімічну характеристику даної води, природного середовища, в якому вона знаходиться у надрах.
 мг-екв/л, (5.1)
мг-екв/л, (5.1)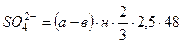 мг/л, (5.2)
мг/л, (5.2) – відношення між еквівалентами сульфата і солі Мора;
– відношення між еквівалентами сульфата і солі Мора;


