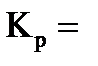Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1. Влияние концентрации реагирующих веществ на химическое равновесиеСодержание книги
Поиск на нашем сайте
Запишите уравнение реакции: __________________________________________________________________________________ Запишите выражение константы химического равновесия для данной реакции:
Кх.р.= _____________________________ Заполните таблицу:
Вывод: ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет»
Кафедра «Прикладная химия и физика»
Дисциплина «Химия»
ОТЧЕТ
по лабораторной работе № ___
На тему: «Электролитическая диссоциация»
Выполнил студент группы__________ ______________И.О. Фамилия (Подпись, дата) Принял преподаватель кафедры ПХиФ __________________И.О. Фамилия (Подпись, дата) Цель работы: - изучить электрическую проводимость растворов электролитов и зависимость её от различных факторов; - научиться предсказывать направление обменной реакции в растворах электролитов.
Теоретическая часть Электролиты - __________________________________________________________________ ____________________________________________________________________________________. Процесс распада молекул вещества на ионы под действием растворителя называется___________________________________________________________________________. Основания – это электролиты, которые при диссоциации образуют только один вид анионов – ___________________________________ NaOH ______________________________________ NH4OH _____________________________________. Кислоты – это электролиты, которые при диссоциации образуют только один вид катионов – ___________________________________________ HCl _______________________________________ HNO3 ______________________________________ H2SO4 _____________________________________ H3PO4 _____________________________________. Амфотерные гидроксиды диссоциируют в водном растворе как по типу кислоты, так и по типу основания. При их диссоциации одновременно образуются ионы:_____________________ ____________________________________________________________________________________. К ним относятся гидроксиды цинка Zn(OH)2, алюминия Al(OH)3, хрома (III) Cr(OH)3, свинца (II) Pb(OH)2 и др.. Например, при диссоциации Zn(OH)2 в водном растворе одновременно присутствуют: ___________⇄ H2ZnO2 º Zn(OH)2 ⇄ _____________. Средние соли – это электролиты, при диссоциации которых в водных растворах образуются ионы ________________________________________________________________________________ Na2SO4 _____________________________ Ca3(PO)4 ___________________________. Кислые соли при растворении в воде образуют ионы_________________________________ KHSO3 _____________________________,сложный анион диссоциирует частично: HSO3- ________________________ Основные соли при диссоциации образуют анионы_______________________и сложные катионы, состоящие и_________________________________________: Al(OH)2Cl ___________________________,Сложный катион диссоциирует частично: Al(OH)2+ _____________________________ AlOH2+ _______________________________. Двойные соли диссоциируют на два катиона__________________________и анион ________________________________: KAl(SO4)2 _____________________________ Na2NH4PO4 ___________________________. Сложные соли диссоциируют на катион ________________и анионы_________________ ZnClNO3 = ______________________________ AlSO4Cl = _______________________________. Степень диссоциации (a) показывает_______________________________________________ ____________________________________________________________________________________. Степень диссоциации зависит от различных факторов:_______________________________ _____________________________________________________________________________________ ____________________________________________________________________________________. Для сильных электролитов a > 30%, для средних электролитов a_______, для слабых электролитов a_________. Константа диссоциации для равновесия, которое устанавливается в растворе слабого электролита: AmBn ⇄ m An+ + n Bm-
___________________________________________. Равновесия в слабых электролитах подчиняются закону _____________________________.
___________________________________________. Между ионами электролитов в растворе действуют силы_____________________________. В связи с этим состояние ионов описывают активностью - условной (эффективной) концентрацией ионов: а = ______________________________.
Экспериментальная часть Опыт 1. Изучение электрической проводимости растворов А. Запишите наблюдения, отмечая степень накала лампы:_ ___________________________ ____________________________________________________________________________________. Напишите уравнение диссоциации воды: H2O _______________________________________________________________________________. Б. Запишите наблюдения, отмечая степень накала лампы: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3. __________________________________________________________________________________ 4.___________________________________________________________________________________ 5. ___________________________________________________________________________________ 6. __________________________________________________________________________________. Напишите уравнения диссоциации электролитов: 1. CH3COOH _________________________________________________________________________ 2. NH4OH ____________________________________________________________________________ 3. HNO3 _____________________________________________________________________________ 4. HCl _______________________________________________________________________________ 5. NaOH _____________________________________________________________________________ 6. KOH ____________________________________________________________________________. Вывод: (по степени накала лампы определить сильным или слабым электролитом являются вышеприведённые вещества)________________________________________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. В. Напишите уравнения реакций в молекулярной и ионной формах: 1. HCl + NaOH _______________________________________________________________________ __________________________________________________________________________________________________________________________________________________________________________ 2. CH3COOH + NH4OH _______________________________________________________________. _________________________________________________________________________________________________________________________________________________________________________. Смешайте равные объёмы растворов и запишите наблюдения: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________, Вывод: (какова электрическая проводимость полученных растворов)_________________________ ____________________________________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________. Опыт 2. Зависимость электрической проводимости раствора (степени диссоциации электролита) от разбавления При добавлении дистиллированной воды к концентрированной кислоте степень накала лампы ______________________________________________________________________________. При добавлении дистиллированной воды к концентрированному раствору аммиака степень накала лампы ________________________________________________________________________. Вывод: (как изменяется электрическая проводимость растворов от разбавления)____________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Опыт 3. Изменение электрической проводимости раствора в результате смещения ионного равновесия Напишите уравнение диссоциации серной кислоты: H2SO4 _______________________________________________________________________________ Степень накала лампы 0,02 М раствора серной кислоты ____________________________________. Напишите уравнение диссоциации гидроксида бария: Ba(OH)2 ____________________________________________________________________________. Степень накала лампы 0,02 М раствора гидроксида бария______________________________ При добавлении фенолфталеина к раствору гидроксида бария раствор окрашивается в___________________цвет. При добавлении серной кислоты к гидроксиду бария цвет раствора_______________________, а степень накала лампы_________________________. В момент исчезновения окраски индикатора (в точке эквивалентности) электрическая проводимость раствора_________________________________________________________. Напишите ионообменную реакцию в молекулярной и ионной формах: H2SO4 + Ba(OH)2_________________________________________________________________ _____________________________________________________________________________________ ____________________________________________________________________________________. При добавлении к раствору избытка серной кислоты электрическая проводимость раствора_______________________________________________________________________. Вывод: (как изменяется электрическая проводимость при связывании ионов)______________________ __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 295; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.007 с.) |