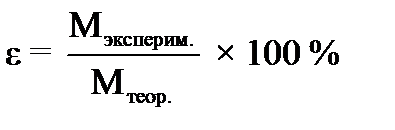Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
О любых происшествиях немедленно сообщить преподавателю или лаборанту, которые ликвидируют опасность и окажут первую помощь.Содержание книги
Поиск на нашем сайте
При ожогах концентрированными растворами кислот обожжённое место промывают сильной струёй воды в течение 2-3 минут, затем 2-3%-ным раствором соды, после чего накладывают марлевую повязку, смоченную 1-2%-ным раствором КМnО4. При ожогах концентрированными растворами щелочей обожжённое место промывают обильным количеством воды до тех пор, пока кожа не перестанет казаться скользкой, затем 1-2%-ным раствором борной или уксусной кислоты. При попадании кислоты, щелочи или какого-либо другого реактива в глаза следует промыть их обильным количеством воды и немедленно обратиться к врачу. По окончании занятия студент обязан: - проверить и привести в порядок свое рабочее место, приборы и аппараты; - проверить закрыты ли краны газовых горелок и выключены ли все электронагревательные приборы; - закрыть общие газовые и водяные краны; - закрыть все форточки и окна; - проверить нет ли тлеющих предметов и не остались ли неубранная ветошь, бумага, полотенца, листовой асбест, разлитая вода и т. д.; - содержимое пробирок слить в канистру для слива, сдать использованные пробирки учебному лаборанту. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет»
Кафедра «Прикладная химия и физика»
Дисциплина «Физика»
ОТЧЕТ
по лабораторной работе № 1-1
На тему: «Определение плотности тел»
Выполнил студент группы БВВ-12-01 ______________ Трясцина Д.В. (Подпись, дата) Принял преподаватель кафедры ПХиФ ______________ Жданов А.Г. (Подпись, дата)
Оценка Цель работы: - ознакомиться с реакциями образования оксидов металлов и неметаллов, кислот, оснований и солей, а также со свойствами основных классов неорганических соединений. Теоретическая часть Сложные неорганические соединения делятся на следующие классы: __________________ _________________________________________________________________________________________________________________________________________________________________________. Оксиды – это __________________________________________________________________ ____________________________________________________________________________________. Оксиды бывают солеобразующие и несолеобразующие. Солеобразующие оксиды делят на _____________________________________________________________________________________ Гидроксиды – это _______________________________________________________________ ____________________________________________________________________________________. Основания – это ________________________________________________________________ ____________________________________________________________________________________. С точки зрения электролитической диссоциации общие свойства оснований обусловлены ионами____________________ NaOH = _____________________ (кислотность равна___________) Mg(OH)2 ⇄ ____________________ (кислотность равна_____) Основания делят на ___________________________________________________________________ Водные растворы оснований изменяют окраску индикаторов. В присутствии оснований универсальная индикаторная бумага окрашивается в _________________ цвет, фенолфталеин становится ____________________, метиловый оранжевый − ______________________. Кислоты – это __________________________________________________________________ ____________________________________________________________________________________. С точки зрения электролитической диссоциации общие свойства кислот обусловлены ионами _____________________. H2CO3 ⇄ ______________________ (основность кислоты равна___________). По наличию или отсутствию атомов кислорода в молекуле кислоты делят на __________________ ____________________________________________________________________________________. В растворах кислот некоторые индикаторы меняют свою окраску: лакмус становится __________________, универсальная индикаторная бумага –________________, метиловый оранжевый – __________________. Амфолиты (амфотерные гидроксиды) – это _________________________________________ ____________________________________________________________________________________. Соли – это _____________________________________________________________________ _____________________________________________________________________________________ Средние соли – _______________________________________________________________________ ____________________________________________________________________________________. Уравнения диссоциации средних солей можно записать следующим образом: K3PO4 = _______________________________ NH4Cl = _______________________________ Название солей по международной номенклатуре: K3PO4 – _____________________________________________________________________________ NH4Cl – _____________________________________________________________________________ Кислые соли – ________________________________________________________________________ ____________________________________________________________________________________. Уравнение диссоциации кислых солей: NaHCO3 = ___________________________________ Название соли по международной номенклатуре __________________________________________ ____________________________________________________________________________________. Основные соли – _____________________________________________________________________ ____________________________________________________________________________________. Диссоциация основной соли выражается уравнением: MgOHCl = __________________________________ Название соли по международной номенклатуре __________________________________________ ____________________________________________________________________________________. Смешанные соли – ____________________________________________________________________ ____________________________________________________________________________________. Диссоциация смешанной соли выражается уравнением MgNO3Cl = __________________________________ Название соли по международной номенклатуре __________________________________________ ____________________________________________________________________________________. Двойные соли – ______________________________________________________________________ ____________________________________________________________________________________. Диссоциация двойной соли выражается уравнением: NaKSO4 = ____________________________________ Название соли по международной номенклатуре___________________________________________ ____________________________________________________________________________________. Экспериментальная часть Опыт 1. Получение оксидов Напишите уравнения реакций получения гидроксида меди (II) и оксида меди (II): 1.___________________________________________________________________________________ 2.___________________________________________________________________________________. Запишите наблюдения: 1.__________________________________________________________________________________ 2.___________________________________________________________________________________ Вывод: (какой способ получения оксида использовали) __________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ ____________________________________________________________________________________. Опыт 2. Свойства кислотных оксидов и получение кислых солей Напишите уравнения реакций, которые последовательно наблюдаете припропускании диоксида углерода (из аппарата Киппа) через раствор гидроксида кальция: образование углекислого газа, образование средней соли, а затем кислой соли: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________. Запишите наблюдения: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________. Напишите названия полученных солей ______________________________________________ ____________________________________________________________________________________. Вывод: (какое свойство кислотных оксидов изучили, какой способ получения кислой соли использовали)__________________________________________________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
Опыт 3. Получение оснований Напишите уравнение реакции взаимодействия натрия с водой ____________________________________________________________________________________. Что наблюдаете при добавлении фенолфталеина? ___________________________________ _____________________________________________________________________. Вывод: (какой способ получения основания использовали)___________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Опыт 4. Свойства кислот Напишите уравнение реакций взаимодействия карбоната кальция с соляной или разбавленной азотной кислотой: _____________________________________________________________________________________ Запишите наблюдения: _________________________________________________________. Вывод: (какое химическое свойство кислот наблюдали)_____________________________________ __________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________. Опыт 5. Получение и свойства амфотерных гидроксидов Напишите уравнения реакций получения гидроксида цинка (II) и уравнения, доказывающие его амфотерность: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________ Запишите наблюдения: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________ Вывод: (каким способом получали гидроксид и какие свойства амфотерных гидроксидов наблюдали)_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Опыт 6. Получение и свойства средних солей Напишите уравнения реакций средних солей: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________. Запишите наблюдения: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.__________________________________________________________________________________. Напишите названия полученных солей: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.__________________________________________________________________________________. Вывод: (какие свойства солей наблюдали, почему реакции идут до конца?)______________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
Опыт 8. Получение основных солей Напишите уравнения реакций получения основной соли (назовите ее) и её взаимодействие с щёлочью и кислотой: 1. ___________________________________________________________________________________ 2. ___________________________________________________________________________________ 3. ___________________________________________________________________________________. Запишите наблюдения: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.__________ _________________________________________________________________________ Вывод: (какой способ получения основной соли использовали, какие свойства основных солей наблюдали)____________________________________________________________________________ _____________________________________________________________________________________ ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет»
Кафедра «Прикладная химия и физика»
Дисциплина «Химия»
ОТЧЕТ
по лабораторной работе № ___
На тему: «Определение молекулярной массы эквивалента карбоната кальция»
Выполнил студент группы__________ ______________ И.О. Фамилия (Подпись, дата) Принял преподаватель кафедры ПХиФ ______________ И.О. Фамилия (Подпись, дата) Цель работы: - определить молекулярную массу эквивалента карбоната кальция весовым методом на основе закона эквивалентов. Теоретическая часть Абсолютная атомная масса – _____________________________________________________ ____________________________________________________________________________________. Моль - ________________________________________________________________________ ____________________________________________________________________________________. Число Авогадро Na показывает____________________________________________________ ____________________________________________________________________________________. Относительная атомная масса -___________________________________________________ ____________________________________________________________________________________. Молекулярная масса - ___________________________________________________________ ____________________________________________________________________________________. Молярная масса - _______________________________________________________________ ____________________________________________________________________________________. К фундаментальным (стехиометрическим) относятся законы химии:____________________ _____________________________________________________________________________________ ____________________________________________________________________________________. Эквивалентом называется некая реальная или условная частица ________________________ ____________________________________________________________________________________. Число эквивалентности равно_____________________________________________________ ____________________________________________________________________________________. Единицей измерения количества эквивалентов является______________________________. Величина, обратная числу эквивалентности, называется ______________________________, которая показывает___________________________________________________________________. Например, масса эквивалента кислорода равна ___________ г/моль. Для газообразных веществ молярный объём эквивалента вещества называется _____________________________________так, молярный объём эквивалента кислорода равен ________ л/моль. Закон эквивалентов:_____________________________________________________________ _____________________________________________________________________________________ ____________________________________________________________________________________. Для реакции А+В=С+Д закон эквивалентов записывается так: ____________________________________________________________________________________. Экспериментальная часть Определение молярной массы эквивалента карбоната кальция проводится по реакции: ________________________________________________________________________________
Записи в ходе эксперимента: 1. Вес пустой фарфоровой чашки - m1, г (________) 2. Вес фарфоровой чашки с мрамором до реакции - m2, г (_________) 3. Вес фарфоровой чашки с мрамором после реакции (после сушки) - m3, г (_________) 4. Объём соляной кислоты - 5 мл 5. Концентрация соляной кислоты - 2 н, моль/л
Обработка результатов: 1. Рассчитайте вес мрамора до реакции m4 = m2 – m1, г ________________________________________________________________________________. 2. Рассчитайте вес мрамора после реакции m5 = m3 – m1, г ________________________________________________________________________________. 3. Рассчитайте вес прореагировавшего мрамора m6 = m4 – m5, г ________________________________________________________________________________. 4. Найдите массу соляной кислоты, вступившей в реакцию m(HCl) (по уравнению), г: ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. 5. Найдите молекулярную массу эквивалента карбоната кальция:
МЭ (СaCO3) = _________________________________________ 6. Рассчитайте абсолютную и относительную ошибки опыта: Δ MЭ = ׀Мтеор. – Мэксперим.׀
Вывод: (каким методом определили молярную массу эквивалента карбоната кальция, о чем говорят результаты расчета ошибок) ___________________________________ _____________________________ _____________________________________________________________________________________ _ __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ___________________. Нарисуйте схематично химическую посуду, используемую в лаборатории. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет»
Кафедра «Прикладная химия и физика»
Дисциплина «Химия»
ОТЧЕТ
по лабораторной работе № ___
|
||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 149; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.6.144 (0.007 с.) |

 ;
;