
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Инструкция по технике безопасностиСодержание книги
Поиск на нашем сайте
ОФОРМЛЕНИЕ ЛАБОРАТОРНЫХ РАБОТ ПО ДИСЦИПЛИНЕ «ХИМИЯ»
Учебно-методическое пособие для студентов бакалавриата и специалитета архитектурно-строительного и горно-нефтяного факультетов
ЧАСТЬ 1
Уфа 2012
В учебно-методическом пособии (часть 1) приведены формы отчётов лабораторных работ по дисциплине «Химия» для студентов бакалавриата и специалитета архитектурно-строительного и горно-нефтяного факультетов. Студенты также могут ознакомиться с общими требованиями к работе, инструкцией по технике безопасности, планом занятий, бально-рейтинговой системой оценок успеваемости и перечнем рекомендуемой литературы.
Составители: Буйлова Е.А., доц., канд. хим. наук; Галиева Д.Р., доц., канд. хим. наук; Сухарева И.А., доц., канд. техн. наук
Рецензент Шаймарданов Н.М., доц., канд. техн. наук
© Уфимский государственный нефтяной технический университет, 2012 СОДЕРЖАНИЕ 1. Введение 2. Cписок литературы для проведения лабораторных работ по дисциплине «химия» 3. Бально-рейтинговая система оценки знаний студентов по дисциплине «химия» 4. Инструкция по технике безопасности при работе студентов в лаборатории химии 5. Формы отчётов по лабораторным работам 5.1. Важнейшие классы неорганических соединений (оксиды, гидроксиды, соли) 5.2. Определение молекулярной массы эквивалента карбоната кальция 5.3. Химическая кинетика. Катализ 5.4. Химическое равновесие 5.5. Электролитическая диссоциация 5.6. Приготовление водных растворов 5.7. Ионообменные реакции 5.8. Ионное произведение воды. Водородный показатель. Гидролиз солей 5.9. Дисперсные системы 5.10. Окислительно-восстановительные реакции 5.11. Ряд напряжений металлов. Гальванические элементы. Электролиз 5.12. Коррозия металлов и методы защиты 5.13. Комплексные соединения ВВЕДЕНИЕ В ходе учебно-профессиональной деятельности студенты должны овладеть опытом выполнения прикладных исследований, которые на начальной стадии начинаются с лабораторных работ по изучаемой теме. Лабораторные работы активизируют самостоятельную работу студентов, которая включает подготовку к работе по методическим указаниям, групповое или индивидуальное выполнение работы и самостоятельное составление отчёта по лабораторной работе. Отчет должен содержать: - титульный лист; - цель работы; - краткое изложение теории; - номер и название опыта; - условия протекания реакции; - схемы, иллюстрирующие проводимый эксперимент; - полученные результаты, наблюдаемые эффекты; - уравнения протекающих реакций в молекулярной и ионной формах; - объяснения и выводы. Для успешного проведения лабораторной работы и своевременной сдачи отчёта следует заранее распечатать форму отчёта, заполнить его теоретическую часть, используя рекомендуемую литературу и продумать опыты (предположить их ход и результаты). Экспериментальная часть заполняется на занятии. Только в этом случае студент сможет вовремя (по окончании занятия) сдать правильно оформленный отчёт и получить максимальный балл. Допуском к лабораторной работе является наличие распечатанного отчета на бумаге с заполненной от руки теоретической частью. Писать следует яркими темными чернилами четким понятным почерком, если почерк неразборчивый – чертежным шрифтом. СПИСОК ЛИТЕРАТУРЫ ДЛЯ ПРОВЕДЕНИЯ ЛАБОРАТОРНЫХ РАБОТ ПО ДИСЦИПЛИНЕ «ХИМИЯ»
Основная литература 1. Глинка Н.Л. Общая химия: Учеб. пособие для вузов. – М.: КНОРУС, 2009. – 752 с. 2. Коровин Н.В. Общая химия: Учеб. для техн. направ. и спец. вузов. – М.: Высш. школа, 2002. – 559 с. 3. Глинка Н.Л. Задачи и упражнения по общей химии: Учеб. пособ. для вузов / под ред. В.А. Рабиновича и Х.М. Рубинной. – М.: Интеграл-Пресс, 2006. – 240 с. 4. Краткий курс лекций по дисциплине «Химия»/Ю.Н.Биглова и др.; под общ. ред. С.С. Злотского и А.К. Мазитовой. – Уфа: УГНТУ, 2010 5. Угай Я.А. Общая и неорганическая химия: Учеб. для вузов. – М.: Высш.шк; 2002. – 527 с. Дополнительная литература 6. Артеменко А.И. Органическая химия: учебник для студ. строит. вузов. – М.: Высшая школа, 2002. – 559 с. 7. Ахметов Н.С. Общая и неорганическая химия: учебник для вузов – 4-е изд. испр. – М: Высшая школа, 2002. – 743 с. 8. Коровин Н.В. Общая химия: учебник для технических направл. и спец. вузов – 7-е изд., испр. – М.: Высшая школа, 2006. – 557 с. Учебно-методические издания 9. Биглова Ю.Н. Определение относительной молекулярной массы эквивалента. Методические указания к проведению лабораторной работы. 10. Сухарева И.А., Мазитова А.К. Практикум по химии. Ч. I – Уфа: УГНТУ, 2007. 11. Сухарева И.А., Мазитова А.К., Кузнецов А.М. Коррозия как окислительно-восстановительный процесс. – Уфа: УГНТУ, 2005. 12. Буйлова Е.А., Шаймарданов Н.М. Комплексные соединения. Методические указания к проведению лабораторной работы. 13. Мазитова А.К., Буйлова Е.А. Практикум по химии. Ч. II – Уфа: УГНТУ, 2008. 14. Шаймарданов Н.М., Аминова Г.К., Буйлова Е.А. Электрохимические процессы. Учебно-методическое пособие к практическим и лабораторным работам.– Уфа: УГНТУ, 2007. 15. Кудаярова Р.Р., Мазитова А.К., Михайлюк Ю.И. Контрольные задания по химии. – Уфа: УГНТУ, 2010. 16. Шаймарданов Н.М. Поверхностные явления. Адсорбция. – Уфа: УГНТУ, 2005. 17. Аминова Г.К., Буйлова Е.А., Галиева Д.Р. Окислительно-восстановительные реакции. Учебно-методическое пособие к практическим и лабораторным занятиям. – Уфа: УГНТУ, 2007. 18. Кудаярова Р.Р., Мазитова А.К. Основные понятия и определения химии. Справочник для студента. – Уфа: УГНТУ, 2006. 19. Шаймарданов Н.М. Элементы химической термодинамики Ч 1. (I закон термодинамики. Термохимия). Учебно-метод. пособие. – Уфа: УГНТУ, 2003. 20. Шаймарданов Н.М., Сухарева И.А. Элементы химической термодинамики Ч 2. (II закон термодинамики. Химическое равновесие). Учебно-метод. пособие. – Уфа: УГНТУ, 2004. 21. Буйлова Е.А., Галиева Д.Р. Методические указания к выполнению практических заданий по дисциплине «Химия» – Уфа: УГНТУ, 2010 (электронный вариант). БАЛЬНО-РЕЙТИНГОВАЯ СИСТЕМА ОЦЕНКИ ЗНАНИЙ СТУДЕНТОВ ПО ДИСЦИПЛИНЕ «ХИМИЯ»
Для студентов специальностей БПГ, БВВ, БДС, БПС, БВТ:
Для студентов специальности ГФ:
Для студентов специальности БГЛ:
Для студентов специальности ГЛ:
ПРИ РАБОТЕ СТУДЕНТОВ В ЛАБОРАТОРИИ ХИМИИ
Студент выполняет в лаборатории работы, только предусмотренные программой и заданиями преподавателей в установленные часы, в указанном месте, не допуская шума, занятий посторонними делами, приглашения в лабораторию посторонних лиц, скопления группами в проходах, у шкафов, весов, раковин, установок, приборов, средств тушения пожара, оказания неотложной помощи и дверей. Перед началом работы все студенты обязаны надеть спецодежду (халат), верхнюю одежду оставлять в гардеробе. Соблюдать чистоту на рабочем месте (стол, тяга, весы), продуманно выполнять все операции, постоянно наблюдать за всем ходом реакции, в полном соответствии с методикой. Реактивы, находящиеся в общем пользовании, нельзя уносить на своё рабочее место; чтобы не спутать пипетки, служащие для взятия реактивов, и пробки от склянок, после взятия требуемого количества реактива их следует немедленно возвращать на место. С ядовитыми газами, кислотами и щёлочами необходимо работать только в вытяжном шкафу, нагревать пробирку следует с помощью держателя, повернув отверстие пробирки от себя и от соседа по рабочему месту. Не следует наклоняться над сосудом (стаканом, колбой, чашкой, пробиркой), в котором происходит нагревание или кипячение жидкости. При необходимости определить запах паров или выделяющегося газа достаточно движением руки направить их к себе и осторожно вдохнуть. Тушить пламя нужно прежде всего песком, кошмой, огнетушителем, а где это возможно - водой. Если загорается жидкость легче воды (например, эфир, бензол и др.), то тушить пламя водой нельзя, так как такая горящая жидкость всплывает и будет продолжать гореть; тушить такие горящие жидкости надо углекислотным огнетушителем ОУ-2, ОУ-5. Нельзя тушить пламя водой и тогда, когда в пламени около него находится натрий, калий или литий. Запрещается оставлять без наблюдения горящий газ (горелку) и другие нагревательные приборы, работать одному в отсутствии учебного лаборанта; убирать случайно пролитые огнеопасные жидкости при зажженных горелках и включенных электронагревательных приборах; хранить и принимать пищу, а также курить на рабочем месте. ОТЧЕТ
по лабораторной работе № 1-1
Выполнил студент группы БВВ-12-01 ______________ Трясцина Д.В. (Подпись, дата) Принял преподаватель кафедры ПХиФ ______________ Жданов А.Г. (Подпись, дата)
Оценка Цель работы: - ознакомиться с реакциями образования оксидов металлов и неметаллов, кислот, оснований и солей, а также со свойствами основных классов неорганических соединений. Теоретическая часть Сложные неорганические соединения делятся на следующие классы: __________________ _________________________________________________________________________________________________________________________________________________________________________. Оксиды – это __________________________________________________________________ ____________________________________________________________________________________. Оксиды бывают солеобразующие и несолеобразующие. Солеобразующие оксиды делят на _____________________________________________________________________________________ Гидроксиды – это _______________________________________________________________ ____________________________________________________________________________________. Основания – это ________________________________________________________________ ____________________________________________________________________________________. С точки зрения электролитической диссоциации общие свойства оснований обусловлены ионами____________________ NaOH = _____________________ (кислотность равна___________) Mg(OH)2 ⇄ ____________________ (кислотность равна_____) Основания делят на ___________________________________________________________________ Водные растворы оснований изменяют окраску индикаторов. В присутствии оснований универсальная индикаторная бумага окрашивается в _________________ цвет, фенолфталеин становится ____________________, метиловый оранжевый − ______________________. Кислоты – это __________________________________________________________________ ____________________________________________________________________________________. С точки зрения электролитической диссоциации общие свойства кислот обусловлены ионами _____________________. H2CO3 ⇄ ______________________ (основность кислоты равна___________). По наличию или отсутствию атомов кислорода в молекуле кислоты делят на __________________ ____________________________________________________________________________________. В растворах кислот некоторые индикаторы меняют свою окраску: лакмус становится __________________, универсальная индикаторная бумага –________________, метиловый оранжевый – __________________. Амфолиты (амфотерные гидроксиды) – это _________________________________________ ____________________________________________________________________________________. Соли – это _____________________________________________________________________ _____________________________________________________________________________________ Средние соли – _______________________________________________________________________ ____________________________________________________________________________________. Уравнения диссоциации средних солей можно записать следующим образом: K3PO4 = _______________________________ NH4Cl = _______________________________ Название солей по международной номенклатуре: K3PO4 – _____________________________________________________________________________ NH4Cl – _____________________________________________________________________________ Кислые соли – ________________________________________________________________________ ____________________________________________________________________________________. Уравнение диссоциации кислых солей: NaHCO3 = ___________________________________ Название соли по международной номенклатуре __________________________________________ ____________________________________________________________________________________. Основные соли – _____________________________________________________________________ ____________________________________________________________________________________. Диссоциация основной соли выражается уравнением: MgOHCl = __________________________________ Название соли по международной номенклатуре __________________________________________ ____________________________________________________________________________________. Смешанные соли – ____________________________________________________________________ ____________________________________________________________________________________. Диссоциация смешанной соли выражается уравнением MgNO3Cl = __________________________________ Название соли по международной номенклатуре __________________________________________ ____________________________________________________________________________________. Двойные соли – ______________________________________________________________________ ____________________________________________________________________________________. Диссоциация двойной соли выражается уравнением: NaKSO4 = ____________________________________ Название соли по международной номенклатуре___________________________________________ ____________________________________________________________________________________. Экспериментальная часть Опыт 1. Получение оксидов Напишите уравнения реакций получения гидроксида меди (II) и оксида меди (II): 1.___________________________________________________________________________________ 2.___________________________________________________________________________________. Запишите наблюдения: 1.__________________________________________________________________________________ 2.___________________________________________________________________________________ Вывод: (какой способ получения оксида использовали) __________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ _____________________________________________________________________________________ ____________________________________________________________________________________. Опыт 2. Свойства кислотных оксидов и получение кислых солей Напишите уравнения реакций, которые последовательно наблюдаете припропускании диоксида углерода (из аппарата Киппа) через раствор гидроксида кальция: образование углекислого газа, образование средней соли, а затем кислой соли: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________. Запишите наблюдения: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________. Напишите названия полученных солей ______________________________________________ ____________________________________________________________________________________. Вывод: (какое свойство кислотных оксидов изучили, какой способ получения кислой соли использовали)__________________________________________________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________.
Опыт 3. Получение оснований Напишите уравнение реакции взаимодействия натрия с водой ____________________________________________________________________________________. Что наблюдаете при добавлении фенолфталеина? ___________________________________ _____________________________________________________________________. Вывод: (какой способ получения основания использовали)___________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. Опыт 4. Свойства кислот Напишите уравнение реакций взаимодействия карбоната кальция с соляной или разбавленной азотной кислотой: _____________________________________________________________________________________ Запишите наблюдения: _________________________________________________________. Вывод: (какое химическое свойство кислот наблюдали)_____________________________________ __________________________________________________________________________________________________________________________________________________________________________ _________________________________________________________________________________________________________________________________________________________________________. Опыт 5. Получение и свойства амфотерных гидроксидов Напишите уравнения реакций получения гидроксида цинка (II) и уравнения, доказывающие его амфотерность: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________ Запишите наблюдения: 1.___________________________________________________________________________________ 2.___________________________________________________________________________________ 3.___________________________________________________________________________________ Вывод: (каким способом получали гидроксид и какие свойства амфотерных гидроксидов наблюдали)_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. ОТЧЕТ
по лабораторной работе № ___
Выполнил студент группы__________ ______________ И.О. Фамилия (Подпись, дата) Принял преподаватель кафедры ПХиФ ______________ И.О. Фамилия (Подпись, дата) Цель работы: - определить молекулярную массу эквивалента карбоната кальция весовым методом на основе закона эквивалентов. Теоретическая часть Абсолютная атомная масса – _____________________________________________________ ____________________________________________________________________________________. Моль - ________________________________________________________________________ ____________________________________________________________________________________. Число Авогадро Na показывает____________________________________________________ ____________________________________________________________________________________. Относительная атомная масса -___________________________________________________ ____________________________________________________________________________________. Молекулярная масса - ___________________________________________________________ ____________________________________________________________________________________. Молярная масса - _______________________________________________________________ ____________________________________________________________________________________. К фундаментальным (стехиометрическим) относятся законы химии:____________________ _____________________________________________________________________________________ ____________________________________________________________________________________. Эквивалентом называется некая реальная или условная частица ________________________ ____________________________________________________________________________________. Число эквивалентности равно_____________________________________________________ ____________________________________________________________________________________. Единицей измерения количества эквивалентов является______________________________. Величина, обратная числу эквивалентности, называется ______________________________, которая показывает___________________________________________________________________. Например, масса эквивалента кислорода равна ___________ г/моль. Для газообразных веществ молярный объём эквивалента вещества называется _____________________________________так, молярный объём эквивалента кислорода равен ________ л/моль. Закон эквивалентов:_____________________________________________________________ _____________________________________________________________________________________ ____________________________________________________________________________________. Для реакции А+В=С+Д закон эквивалентов записывается так: ____________________________________________________________________________________. Экспериментальная часть Определение молярной массы эквивалента карбоната кальция проводится по реакции: ________________________________________________________________________________
Записи в ходе эксперимента: 1. Вес пустой фарфоровой чашки - m1, г (________) 2. Вес фарфоровой чашки с мрамором до реакции - m2, г (_________) 3. Вес фарфоровой чашки с мрамором после реакции (после сушки) - m3, г (_________) 4. Объём соляной кислоты - 5 мл 5. Концентрация соляной кислоты - 2 н, моль/л
Обработка результатов: 1. Рассчитайте вес мрамора до реакции m4 = m2 – m1, г ________________________________________________________________________________. 2. Рассчитайте вес мрамора после реакции m5 = m3 – m1, г ________________________________________________________________________________. 3. Рассчитайте вес прореагировавшего мрамора m6 = m4 – m5, г ________________________________________________________________________________. 4. Найдите массу соляной кислоты, вступившей в реакцию m(HCl) (по уравнению), г: ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. 5. Найдите молекулярную массу эквивалента карбоната кальция:
МЭ (СaCO3) = _________________________________________ 6. Рассчитайте абсолютную и относительную ошибки опыта: Δ MЭ = ׀Мтеор. – Мэксперим.׀
Вывод: (каким методом определили молярную массу эквивалента карбоната кальция, о чем говорят результаты расчета ошибок) ___________________________________ _____________________________ _____________________________________________________________________________________ _ __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ___________________. Нарисуйте схематично химическую посуду, используемую в лаборатории. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет»
Кафедра «Прикладная химия и физика»
Дисциплина «Химия»
ОТЧЕТ
по лабораторной работе № ___
Выполнил студент группы__________ ______________ И.О. Фамилия (Подпись, дата) Принял преподаватель кафедры ПХиФ ______________ И.О. Фамилия (Подпись, дата) Цель работы: - изучить влияние концентрации, поверхности реагирующих веществ, присутствия катализаторов на скорость химической реакции; - оценить каталитическую активность катализатора.
Теоретическая часть Химическая кинетика – это раздел химии, изучающий ____________________________ ______________________________________. Скоростью химической реакции называют ___________________________________________________________________________________ ____________________________________________________________________________________.Скорость гомогенной реакции выражается формулой: Vгомог.= _____________________ Скорость реакции зависит от различных факторов. Зависимость скорости химической реакции от концентрации выражается законом действия масс: ________________________________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________. Например, для реакции ___________________________________________________________________________________ где Данная система является гомогенной, так как _______________________________________ ___________________________________________________________________________________. Особенность гетерогенных процессов заключается в том, что они____________________________ ____________________________________________________________________. Поэтому скорость химических реакций в гетерогенных системах при постоянной температуре зависит и от _______________________________________________________. Скорость гетерогенной реакции выражается формулой: Vгетер.= _____________________ С ростом температуры скорость химической реакции резко возрастает. Зависимость скорости реакции от температуры выражается правилом ____________________________: _______________________________________________________________________________________________________________________________________________________________________________________________________________________________________ и выражается формулой:
______________________________ где V (T1), V (Т2) - ____________________________________________; Лишь определенная часть общего числа соударений молекул реагирующих веществ приводит к химическому взаимодействию. Такие соударения называются _____________________. Энергия активации – это _________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________. Одним из методов ускорения химической реакции является катализ, который, осуществляется при помощи катализаторов – веществ, ________________________________ _____________________________________________. Механизм действия катализатора сводится к _________________________________________________________________________________. Вещества, снижающие скорость химической реакции, называются _____________________. Автокатализ – это ______________________________________________________________ _______________________________________________________________________________________________________________________________________________________________________. Экспериментальная часть Опыт 4. Автокатализ Запишите наблюдения реакции с катализатором и без участия катализатора и отметьте время протекания реакции в каждом случае: 1. ___________________________________________________________________________________ 2. ___________________________________________________________________________________ Запишите уравнения реакций: 1. ___________________________________________________________________________________ 2. ___________________________________________________________________________________ Рассчитайте относительную скорость в обоих случаях ( 1. ___________________________________________________________________________________ 2. ___________________________________________________________________________________ Вывод: (в каком случае реакция протекает быстрее и почему) ______________________________________ ___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________. МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФГБОУ ВПО «Уфимский государственный нефтяной технический университет»
Кафедра «Прикладная химия и физика»
Дисциплина «Химия»
ОТЧЕТ
по лабораторной работе № ___
Выполнил студент группы__________ ______________ И.О. Фамилия (Подпись, дата) Принял преподаватель кафедры ПХиФ ______________ И.О. Фамилия (Подпись, дата) Цель работы: - изучить влияние концентрации реагирующих веществ и продуктов реакции на смещение химического равновесия.
Теоретическая часть Понятие "химическое равновесие" применимо, только к ____________________ ре
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 144; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.151.11 (0.009 с.) |

 ;
;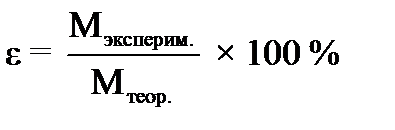
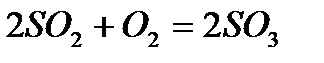 закон действия масс может быть записан:
закон действия масс может быть записан: - ___________________;
- ___________________;  - __________________________; [ ] - _____ ___________________________________________________________________________________.
- __________________________; [ ] - _____ ___________________________________________________________________________________. и
и  - __________ _________________________________________;
- __________ _________________________________________; 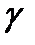 - _______________________________________, показывающий на сколько _________________________________________при повышении температуры на 10°С.
- _______________________________________, показывающий на сколько _________________________________________при повышении температуры на 10°С.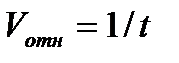 )
)


