
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизм упругой и пластической деформации.Стр 1 из 9Следующая ⇒
Тема №1 Материаловедение – прикладная наука о химическом составе, строении и свойствах материала, используется в современной промышленности Основная задача – установление связи между химическим составом, строением и свойствами материала Цель – применение основных методов управления конструкционной прочностью материалов и проводить обоснованный выбор материала для изделий с учетом условий их эксплуатации. Задачи: · поиск альтернативных источников сырья · совершенствование традиционных материалов · создание принципиально новых материалов из доступного исходного сырья с комплексом необходимых свойств. Объект: Предмет исследования: Тема №2 Вещества, находящиеся в твёрдом состоянии, могут быть либо аморфными, либо кристаллическими. Аморфное состояние твёрдых тел характеризуется тем, что атомы, молекулы или ионы вещества располагаются в пространстве хаотически. Пример: стекло, воск. В кристаллических твёрдых телах частицы вещества располагаются в пространстве упорядоченно, т.е. выстроены правильными рядами, плоскостями, симметричными блоками, что придаёт отдельным кристаллам (монокристаллам) характерную правильную огранку. Кристаллическое состояние твёрдых тел встречается в природе чаще, чем аморфное, поскольку обладает меньшей свободной энергией и, в силу этого, является более стабильным. Пример: кварц, гранит, рубин, алмаз, соль, речной песок и глина. Металлы и сплавы также являются кристаллическими материалами. Тема №3 Кристаллическая решетка представляет собой воображаемую пространственную координатную сетку, узлы которой отображают расположение в пространстве центров тяжести атомов, молекул или ионов кристаллов Основными типами кристаллических решёток являются:
a. простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
b. плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
Тема №4 Анизотропия — это векториальность свойств кристалла, возникающая в результате упорядоченного расположения атомов (ионов,молекул) в пространстве.
Тема №5
Полиморфизм – способность одного и того же металла образовывать несколько разных кристаллических структур.
В интервале температур 1392-1539°С железо имеет ОЦК-структуру, но период кристаллической решётки этого железа чуть больше чем у α-железа. Такое железо обозначают δ-Fe. При температурах выше 1539°С чистое железо плавиться и превращается в жидкий расплав. Тема №6 Общая характеристика: Металлы – это элементы, проявляющие в своих соединениях только положительные степени окисления, и в простых веществах которые имеют металлические связи. Металлическая кристаллическая решетка - решетка, образованная нейтральными атомами и ионами металлов, связанными между собой свободными электронами. У металлов в узлах кристаллической решетки находятся атомы и положительные ионы. Электроны, отданные атомами, находятся в общем владении атомов и положительных ионов. Такая связь называется металлической. Для металлов наиболее характерны следующие физические свойства: металлический блеск, твердость, пластичность, ковкость и хорошая проводимость тепла и электричества. Классификация:
· железные · тугоплавкие · урановые · редкоземельные · щелочноземельные
· легкие · благородные · легкоплавкие Зернистое строение металла: Всякий металл обычно состоит из множества соприкасающихся друг с другом кристаллов (называемых зернами), как правило, имеющих микроскопические размеры. Внутри каждого зерна атомы расположены так, что образуют правильную трехмерную геометрическую решетку. Тип решетки, называемый кристаллической структурой, является характеристикой материала.
Все зерна имеют одинаковую кристаллическую структуру, но, как правило, по-разному ориентированы в пространстве. Поэтому на границе двух зерен атомы всегда менее упорядочены, чем внутри них. Этим объясняется, в частности, то, что границы зерен легче поддаются травлению химическими реагентами. На полированной плоской поверхности металла, обработанной подходящим травителем, обычно выявляется четкая картина границ зерен. Физические свойства материала определяются свойствами отдельных зерен, их воздействием друг на друга и свойствами границ зерен. Свойства металлического материала существенным образом зависят от размеров, формы и ориентации зерен, и цель термической обработки состоит в том, чтобы управлять этими факторами. Тема №7 Точечные дефекты – малы во всех трёх измерениях, и размеры их не превышают нескольких атомных диаметров. Относятся: Вакансии – узлы решетки, в которых атомы отсутствуют Межузельные атомы – образуются в результате перехода атома из узла решетки в междоузлие Линейные дефекты – имеют малые размеры в двух измерениях и большую протяженность в третьем измерении. Относятся: Краевая дислокация – представляет собой локализованное искажение кристаллической решетки, вызванное наличием в ней «лишней» атомной полуплоскости или электроплоскости Винтовая дислокация – прямая линия, вокруг которой атомные плоскости изогнуты по винтовой поверхности. Поверхностные дефекты – дефекты малы только в одном измерении. К поверхностным несовершенствам относятся различного рода границы раздела, которые делятся на две группы: межфазные и внутрифазные. Межфазные границы разделяют области, находящиеся в разном фазовом состоянии. Области внутрифазные в области контакта различно ориентированы у кристаллических решёток одной и той же фазы. Если углы разориентации относительно не велики: менее, то границы называются малоугловыми или субграницами, а разделяемые ими области – субзёрнами. Малоугловые границы формируются так называемыми стенками дислокации.
Объёмные дефекты – размеры во всех трёх направлениях соизмеримы с размерами кристалла. Тема №8
Система приходит к термодинамически более устойчивому состоянию с меньшей энергией Гиббса (свободной энергией). Уменьшение энергии Гиббса возможно только при переохлаждении ниже То 0 – температуры фазового равновесия, когда Gтв = Gж. ΔТ = Тп – Тк, Тп – температура, при которой идет процесс кристаллизации. ΔG – изменение энергии. ΔТ = Тп – Тк – степенью переохлаждения: ΔТ = Тп – Тк. Чем больше степень переохлажденияD Т, тем больше разность свободных энергий D G и больше скорость кристаллизации.
Тема №9
Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым. Процесс кристаллизации может протекать при условии уменьшения свободной энергии, поэтому, если образуется зародыши размером меньше r, он расти не может, так как это повело бы к увеличению энергии системы. Зародыши с размерами равными и большими критического, растут с уменьшением энергии и поэтому способны к существованию.
Рис.3. Модель механизма процесса кристаллизации Центры кристаллизации образуются в исходной фазе независимо друг от друга в случайных местах. Сначала кристаллы имеют правильную форму, но по мере столкновения и срастания с другими кристаллами форма нарушается. Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело. Размеры образовавшихся кристаллов зависят от соотношения числа образовавшихся центров кристаллизации и скорости роста кристаллов при температуре кристаллизации. При равновесной температуре кристаллизации ТS число образовавшихся центров кристаллизации и скорость их роста равняются нулю, поэтому процесса кристаллизации не происходит.
Тема №10
Тема №11 Классификация свойств материалов:
1. Физические свойства металлов и сплавов определяются цветом, удельным весом, плотностью, температурой плавления, тепловым расширением, тепло- и электропроводностью» а также магнитностью.
Механические свойства – характеризуют определенное поведение материала при воздействии внешних нагрузок. Неодинаковы в зависимости от характера нагрузки. Методы определения механических свойств:
· на растяжение; · на твердость (HB, HRC, HV) · на ударную вязкость
· на ударную вязкость(КС)
· На усталость
· На изгиб · На перегиб · На выдавливание · Тема №12 Твердостью называется способность металла сопротивляться внедрению в него инородного тела. Определение твердости является наиболее часто применяемым методом испытания металлов. Для определения твердости не требуется изготовления специальных образцов, т. е. испытание проводится без разрушения детали
Методы определения твердости: · вдавливание · царапание · упругая отдача · магнитный метод ИЗМЕРЕНИЕ ТВЕРДОСТИ ПО БРИНЕЛЛЮ: В качестве индетора используют стальной шарик диаметром D, который вдавливается в испытываемый материал с усилием Р. После снятия нагрузки на поверхности материала остается лунка диаметром d. Чем меньше диаметр отпечатка, тем выше твердость испытываемого материала. При измерении твердости по Бринеллю применяются шарики (стальные или из твердого сплава) диаметром 1,0; 2,0; 2,5; 5,0; 10,0 мм. При твердости металлов менее 450 единиц для измерения твердости применяют стальные шарики или шарики из твердого сплава. При твердости металлов более 450 единиц - шарики из твердого сплава.
F —площадь отпечатка в мм2; Р —нагрузка в кГ; D —диаметр шарика в мм; d —диаметр отпечатка в мм. ИЗМЕРЕНИЕ ТВЕРДОСТИ ПО РОКВЕЛЛУ: Индентором служит алмазный конус с углом при вершине 120 оС или шарик из закаленной стали диаметром 1,5 мм. В отличие от метода Бринелля, в данном методе твердость определяется не площадью поверхности отпечатка индетора, а глубиной его проникновения. ИЗМЕРЕНИЕ ТВЕРДОСТИ ПО ВИККЕРСУ: Основан на вдавливании четырехгранной алмазной пирамидки, с углом между гранями 136 оС. Чем больше нагрузка, тем глубже проникает в испытываемый материал, поэтому для определения твердости тонких слоев применяют меньше нагрузки. Алмазная пирамидка повышает точность измерения даже при проникновении ее на небольшую глубину и делает этот способ пригодным для определения твердости тонких и твердых сплавов.
d – среднее арифметическое диагоналей отпечатка; P – нагрузка к измеренному значению диагонали отпечатка; M – значение диагонали отпечатка;
Тема №13
Диаграмма (кривая) растяжения (кривая 1 – условные, 2 – истинные
напряжения) ХАРАКТЕРИСТИКИ ПРОЧНОСТИ определяются по кривой растяжения. σпц = Рпц/Fo – предел пропорциональности, максимальные напряжения, при которых выполняется закон Гука. σ0,2 = Р0,2/Fo – условный предел текучести, характеризует сопротивление малым пластическим деформациям. σв = Рв/Fo – временное сопротивление, соответствующее максимальной нагрузке. Точка В – начало образования шейки на образце при растяжении. Разрушение наступит в точке С, при резком уменьшении поперечного сечения образца. Sk = Pk/Fk – истинное сопротивление разрыву (напряжения при разрушении). ХАРАКТЕРИСТИКИ ПЛАСТИЧНОСТИ определяются по размерам образца до и после испытаний. относительное удлинение: δ = (lк - lн)/lн⋅100%; относительное сужение: ψ = (Fo – Fk)/Fo⋅100%, где lн и lк – длина образца до и после испытаний; Fo и Fk – площадь поперечного сечения образца до и после испытаний. Тема №14 Тема №15 Тема №16 Тема №17 Тема №18 Методы исследования металлов и сплавов: структурные и физические Металлы и сплавы обладают разнообразными свойствами. Используя один метод исследования металлов, невозможно получить информацию о всех свойствах. Используют несколько методов анализа. Определение химического состава. Используются методы количественного анализа. 1. Если не требуется большой точности, то используют спектральный анализ. Спектральный анализ основан на разложении и исследовании спектра электрической дуги или искры, искусственно возбуждаемой между медным электродом и исследуемым металлом. Зажигается дуга, луч света через призмы попадает в окуляр для анализа спектра. Цвет и концентрация линий спектра позволяют определить содержание химических элементов. Используются стационарные и переносные стилоскопы. 2. Более точные сведения о составе дает рентгеноспектральный анализ. Проводится на микроанализаторах. Позволяет определить состав фаз сплава, характеристики диффузионной подвижности атомов. Изучение структуры Различают макроструктуру, микроструктуру и тонкую структуру. 1. Макроструктурный анализ – изучение строения металлов и сплавов невооруженным глазом или при небольшом увеличении, с помощью лупы. Осуществляется после предварительной подготовки исследуемой поверхности (шлифование и травление специальными реактивами). Позволяет выявить и определить дефекты, возникшие на различных этапах производства литых, кованных, штампованных и катанных заготовок, а также причины разрушения деталей. Устанавливают: вид излома (вязкий, хрупкий); величину, форму и расположение зерен и дендритов литого металла; дефекты, нарушающие сплошность металла (усадочную пористость, газовые пузыри, раковины, трещины); химическую неоднородность металла, вызванную процессами кристаллизации или созданную термической и химико-термической обработкой; волокна в деформированном металле. 2. Микроструктурный анализ – изучение поверхности при помощи световых микроскопов. Увеличение – 50…2000 раз. Позволяет обнаружить элементы структуры размером до 0,2 мкм. Образцы – микрошлифы с блестящей полированной поверхностью, так как структура рассматривается в отраженном свете. Наблюдаются микротрещины и неметаллические включения. Для выявления микроструктуры поверхность травят реактивами, зависящими от состава сплава. Различные фазы протравливаются неодинаково и окрашиваются по разному. Можно выявить форму, размеры и ориентировку зерен, отдельные фазы и структурные составляющие. Кроме световых микроскопов используют электронные микроскопы с большой разрешающей способностью. Изображение формируется при помощи потока быстро летящих электронов. Электронные лучи с длиной волны (0,04…0,12) ·10-8 см дают возможность различать детали объекта, по своим размерам соответствующие межатомным расстояниям. 3. Для изучения атомно-кристаллического строения твердых тел (тонкое строение) используются рентгенографические методы, позволяющие устанавливать связь между химическим составом, структурой и свойствами тела, тип твердых растворов, микронапряжения, концентрацию дефектов, плотность дислокаций. Физические методы исследования 4. Термический анализ основан на явлении теплового эффекта. Фазовые превращения в сплавах сопровождаются тепловым эффектом, в результате на кривых охлаждения сплавов при температурах фазовых превращений наблюдаются точки перегиба или температурные остановки. Данный метод позволяет определить критические точки. 5. Дилатометрический метод. При нагреве металлов и сплавов происходит изменение объема и линейных размеров – тепловое расширение. Если изменения обусловлены только увеличением энергии колебаний атомов, то при охлаждении размеры восстанавливаются. При фазовых превращениях изменения размеров – необратимы. Метод позволяет определить критические точки сплавов, температурные интервалы существования фаз, а также изучать процессы распада твердых растворов. 6. Магнитный анализ. Используется для исследования процессов, связанных с переходом из парамагнитного состояния в ферромагнитное (или наоборот), причем возможна количественная оценка этих процессов. Тема №19 Механические смеси Если элементы, входящие в состав сплава, при затвердевании из жидкого состояния не растворяются друг в друге и не взаимодействуют, то образуется механическая смесь. Механические смеси образуются при кристаллизации многих сплавов, например Pb - Sb, А1 - Си. По структуре смесь представляет собой неоднородное тело. При металлографическом анализе на шлифе видны кристаллиты разных компонентов, образующих механическую смесь. Химический анализ определяет также разные элементы. Рентгеноструктурный анализ определяет два типа кристаллических решеток, образующих такую смесь. Химические соединения Если же элементы, составляющие сплав, взаимодействуют друг с другом, то образуются химические соединения. По структуре они представляют собой однородные твердые тела. Свойства химических соединений отличаются от свойств образующих их элементов. Они имеют постоянную температуру плавления (диссоциации). Рентгеноструктурный анализ показывает различие кристаллических решеток химического соединения и исходных элементов. В химическом соединении сохраняется определенное соотношение атомов элементов, позволяющее выразить их состав стехиометрической пропорцией в виде простой формулы А„Вт, где А и В - соответствующие элементы, an vim - целые числа. Составы этих соединений на диаграммах «состав - свойство» характеризуются особыми сингулярными точками. Различают химические соединения двух типов: металл — неметалл и металл - металл. К химическим соединениям металлов с неметаллами относят фазы с ионным типом связи и фазы внедрения. Фазы с ионным типом связи образуются в тех случаях, когда атом металла отдает валентные электроны и становится положительным ионом, а атом неметалла (например, кислорода, серы) принимает их на свою внешнюю оболочку и становится отрицательным ионом. В такой кристаллической решетке элементы удерживаются электростатическими силами. Химические соединения этой группы имеют строго стехиометрический состав, их формулы определяются валентностью составляющих элементов. В структуре сплавов они находятся в виде неметаллических включений сульфидов, оксидов, фосфидов и т. д. Например, оксид марганца МnО, карбид железа Fe3C и др. Фазы внедрения образуются в результате взаимодействия железа, марганца, хрома, вольфрама, молибдена и других металлов с неметаллами с малым атомным диаметром - углеродом, азотом, бором и водородом. К этим фазам относятся карбиды, нитриды, бориды и гидриды. Условием образования фаз внедрения является отношение атомных диаметров у неметалла и металла меньше 0,59. Атомы металла размещаются в узлах решетки, а атомы неметалла - в ее октаэдрических или тетраэдрических порах. Из-за меньших объемов тетраэдрических пор в них могут разместиться только атомы водорода. Фазы внедрения имеют простую химическую формулу Ме,Х (Fe4N, Mn4N), Ме2Х (Fe2N, Мо2С), МеХ (карбиды VC, TiC, WC, NbC и нитриды FeN, VN, TiN), где Me - металл, X - неметалл. Такие фазы внедрения, как карбиды и нитриды, обладают высокой твердостью. На базе фаз внедрения с избытком металлических атомов могут образовываться твердые растворы. К системе металл - металл относятся электронные соединения (фазы Юм-Розери), фазы Лавеса и G-фазы. Электронные соединения образуются между одновалентными (Си, Ag, Li) металлами или металлами переходных групп (Fe, Мп, Со), с одной стороны, и металлами с валентностью от 2 до 5 (А1, Be, Mg, Zn) - с другой стороны. Электронные соединения являются фазами переменного состава. Соединения этого типа имеют определенную электронную концентрацию, т. е. определенное отношение числа валентных электронов к числу атомов: 3/2, 21/13, 7/4. Фазы с такими значениями электронной концентрации принято обозначать соответственно Р-, у- и є-фазами. К P-соединениям с электронной концентрацией N1 = 3/2, обычно имеющим ОЦК решетку, относятся соединения CuZn, CuBe, Cu3Al и др. Например, для соединения CuZn N. = (1-1 + + 2 • 1)/(1 + 1) = 3/2. К у-соединениям с электронной концентрацией 21/13 и сложной кубической решеткой относятся Cu5Zn8, Co5Zn21, Fe5Zn21. Для соединения Cu5Zng N2 = (1 • 5 + 2 • 8)/(5 + 8) = 21/13. Электронная концентрация 7/4 с гексагональной решеткой характерна для е-соединений CuZn3, Cu3Sn, Cu3Si. Для соединения CuZn3 с гексагональной е-решеткой N3 = (1? 1 + 2 • 3) /(1 + 3) = 7/4. Электронные соединения характерны для сплавов на медной основе (латуней и бронз), где они являются упрочняющими фазами. Фазы Лавеса имеют формулу АВ2. Они образуются между компонентами А и В при отношении их атомных диаметров от 1,1 до 1,6, обычно 1,2. К фазам Лавеса относятся соединения TiFe2, TiCr2, MoFe2, NbFe2, TiCo2, присутствующие в ряде жаропрочных сплавов и способствующие их упрочнению. Они имеют гексагональную плотноупакованную или гранецентрированную кубическую решетку. Сигма-фаза, образующаяся на базе металлов с близкими атомными диаметрами (как, например, о-фаза в системе Fe - Сг), появляется в структуре высокохромистых сплавов при их очень медленном охлаждении или изотермической выдержке при 600-800 °С. Образование кристаллов о-фазы сопровождается увеличением твердости и резким охрупчиванием коррозионностойких сталей. Твердые растворы Твердыми растворами называют фазы, в которых один из компонентов (растворитель) сохраняет свою кристаллическую решетку, а атомы других (растворяемых) компонентов располагаются в его решетке, искажая ее. Химический анализ твердого раствора показывает несколько элементов, а металлографический и рентгеноструктурный - однородные зерна и один тип решетки, как у металла-растворителя. Различают твердые растворы замещения и внедрения. Твердый раствор замещения образуется замещением части атомов растворителя в его кристаллической решетке атомами растворенного компонента (рис. 1, а). Атомы растворенного элемента обычно не занимают особых мест в кристаллической решетке, а только замещают в некоторых узлах атомы растворителя. Такое размещение атомов называют неупорядоченным (рис. 4.2, а). Оно образуется в тех случаях, когда взаимодействие разнородных элементов твердого раствора недостаточно выражено. Если же атомы разных элементов твердого раствора взаимодействуют между собой несколько сильнее, чем однородные атомы, то они стремятся расположиться в определенном порядке. Атомы растворителя и растворенного элемента располагаются на разных кристаллографических плоскостях. Например, в системе Au - Си после медленного охлаждения расплава одни кристаллографические плоскости состоят целиком из атомов меди, а другие - из атомов золота (рис. 4.2, б). Такие твердые растворы называют упорядоченными. Полностью упорядоченные растворы образуются, когда отношение компонентов в сплаве составляют целые числа: 1:1, 1:2, 1:3
Рис. 1. Кристаллическая решетка ГЦК твердого раствора замещения (а) и твердого раствора внедрения (б)
Рис. 2. Размещение атомов в кристаллической решетке твердых растворов: а - неупорядоченное (сплав Cu-Au); б - упорядоченное (сплав Cu-Au); в - решетка твердого раствора вычитания и т. д. Такой сплав с упорядоченной структурой можно характеризовать формулой химического соединения, например CuAu или Cu3Au. Упорядоченные твердые растворы характеризуются более высокой твердостью и хрупкостью и могут рассматриваться как промежуточные фазы между неупорядоченными твердыми растворами и химическими соединениями. В связи с различием в размерах атомов, при замещении атомов одного компонента атомами другого компонента происходит искажение кристаллической решетки. Это искажение тем больше, чем больше разница в размерах атомов и строении их кристаллических решеток. При чрезмерном искажении решетки дальнейшая растворимость становится невозможной. Наступает предельная растворимость, при которой дополнительно вводимые атомы не могут войти в решетку и образуют самостоятельную фазу. Если же оба компонента имеют однотипные кристаллические решетки, а атомные диаметры различаются не более чем на 8-15 %, то возможна неограниченная растворимость. Неограниченно растворяются в твердом состоянии такие металлы с ГЦК решеткой, имеющие небольшую разницу в атомных размерах AR, как Ag и Au (AR = 0,2 %), Ni и Си (AR = 2,7 %) и др., а также металлы с ОЦК решеткой: Мо и W (AR = 9,9 %), V и Ті (AR = 2 %). Металлы с большим атомным диаметром (Na, Са, РЬ) в Fe, Си, Ni нерастворимы. Предельная растворимость зависит также от различия в строении валентных оболочек электронов. Одновалентные металлы полностью растворяются только в одновалентных: Cu-Ag, Ag-Au, Cu-Ni. Ограниченная растворимость компонентов наступает при достижении критической величины электронной концентрации в твердом растворе N, где электронная концентрация — это количество валентных электронов на атом. Для ОЦК решетки N = 1,36, для ГЦК решетки N = 1,40. Если электронная концентрация превышает эти значения, то образуется новая фаза с другой кристаллической решеткой. Например, из диаграммы состояния Си - Zn известно, что предел растворимости Zn в Си составляет 39 %. Для сплава, содержащего 61 % Си и 39 % Zn, N = (61? 1 + 39? 2)/100 = 1,39, что меньше предельного значения 1,40. Твердый раствор внедрения образуется путем внедрения атомов растворенного компонента в междоузлия (пустоты) кристаллической решетки (рис. 1, б). В решетке ГЦК такая пустота находится в центре куба и образует сферу диаметром 0,4D, где D -диаметр атомов растворителя. В решетке ОЦК пустота находится в центре грани и образует сферу диаметром 0,29.0. Образование твердых растворов внедрения, как правило, сопровождается увеличением параметров кристаллической решетки и ее искажением. Твердый раствор внедрения характерен для сплавов металлов с элементами 1-го и 2-го периодов, имеющими малые атомные диаметры (С, В, N, Н, О). Концентрация второго компонента в твердом растворе внедрения обычно невысока и всегда ниже, чем в твердых растворах замещения и химических соединениях этих элементов. В отличие от химических соединений твердые растворы внедрения имеют кристаллическую решетку металла-растворителя, в то время как химические соединения образуют решетку, отличающуюся от решетки металла. На базе химических соединений - фаз внедрения могут образовываться твердые растворы вычитания (рис. 2, в), иногда называемые твердыми растворами с дефектной решеткой. В таких твердых растворах уменьшается число атомов растворителя и появляются свободные узлы в его решетке. Твердые растворы вычитания образуются при растворении атомов V, Ті, Nb, Zr в их карбидах VC, TiC, NbC, ZrC в тех узлах, которые ранее были заняты атомами углерода. Атомы растворенных элементов скапливаются в кристаллической решетке растворителя преимущественно вблизи дислокаций, снижая их упругую энергию (рис. 3). В растворах замещения атомы меньшего, по сравнению с атомами растворителя, размера присутствуют в сжатой зоне решетки, а большего размера - в растянутой зоне. При образовании твердых растворов внедрения атомы располагаются в растянутой зоне решетки под экстраплоскостью. Вблизи дислокации они образуют группы в виде облаков, называемые атмосферами Коттрелла. Такое расположение сопровождается уменьшением искажений кристаллической решетки и отвечает наименьшему запасу свободной энергии. Тема №20 Правило фаз Гиббса Закономерности существования устойчивых фаз в условиях равновесия определяются правилом фаз Гиббса. Правило фаз, устанавливая количественную зависимость между числом фаз Ф, количеством компонентов К и числом степеней свободы С, дает возможность предсказать процессы, проходящие в сплавах при нагреве и охлаждении, и определить число фаз в системе при данных условиях. Правило фаз выражается следующим уравнением: С = К + Р-Ф. Под числом степеней свободы, или вариантностью системы, понимают число внешних Р (температура, давление) и внутренних (концентрация) факторов, которые можно изменять без изменения числа фаз, находящихся в равновесии. Для металлических сплавов внешним фактором равновесия является только температура, так как при работе в атмосферных условиях давление практически постоянно. Поэтому для металлических сплавов правило фаз принимает следующий вид: С = К + 1 - Ф. Вариантность не может быть отрицательной. Поэтому для равновесия металлических сплавов необходимо, чтобы в их структуре число фаз не превышало число компонентов более, чем на 1. Из этого уравнения следует, что в случае кристаллизации чистого металла, когда имеются две фазы (жидкая и твердая), число степеней свободы равно нулю, так как С = К+1-Ф = 1 + 1-2 = 0. Такая система является инвариантной. Обе фазы находятся в равновесии при строго определенной температуре - температуре затвердевания. Температура может измениться только при исчезновении одной из фаз. Если чистый металл находится в жидком состоянии и присутствует только одна жидкая фаза, то число степеней свободы будет равно 1 (моновариантная система): C = к + 1 -Ф = 1 + 1 - 2 = 1. Наличие одной степени свободы показывает возможность изменять, например, в определенных пределах температуру без изменения числа фаз. Из правила фаз следует, что в двойных системах число одновременно существующих фаз не может быть более 3. При большем числе фаз сплав не будет находиться в равновесном состоянии. Правило фаз используется при построении диаграмм состояния сплавов. Правило отрезков. Посредством правила отрезков можно определить состав фаз в любой двухфазной области и количественное их соотношение. Правило отрезков состоит из двух частей. Первая часть: для того чтобы определить состав фаз через заданную точку в двухфазной области (точка соответствует конкретной температуре) проводят горизонтальную линию до пересечения с линиями, ограничивающими эту область. Проекция точек пересечения на ось концентрации даст нам состав фаз. Вторая часть: для того чтобы определить количество фаз через заданную точку проводят горизонтальную линию до пересечения с линией, ограничивающей эту область. Отрезки между заданной точкой и точками с соответствующим составом фаз обратно пропорциональны их количеству Тема №21 Тема №22 Диаграмма состояния. Диаграмма состояния представляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры (рис. 4.5). Рис. 4.5. Диаграмма состояния Диаграммы состояния показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. Построение диаграмм состояния наиболее часто осуществляется при помощи термического анализа. В результате получают серию кривых охлаждения, на которых при температурах фазовых превращений наблюдаются точки перегиба и температурные остановки. Температуры, соответствующие фазовым превращениям, называют критическими точками. Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации – точками солидус. По кривым охлаждения строят диаграмму состава в координатах: по оси абсцисс –концентрация компонентов, по оси ординат – температура.
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 624; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.254.122 (0.14 с.) |

 В интервале температур 911-1392 °С железо имеет ГЦК-структуру. Такое железо обозначают γ-Fe. ГЦК-структура отличается от ОЦК более высокой плотностью упаковки атомов. Поэтому при нагреве железа до температур выше 911°С наблюдается уменьшение объёма образца.
В интервале температур 911-1392 °С железо имеет ГЦК-структуру. Такое железо обозначают γ-Fe. ГЦК-структура отличается от ОЦК более высокой плотностью упаковки атомов. Поэтому при нагреве железа до температур выше 911°С наблюдается уменьшение объёма образца.
 При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется.
При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется.
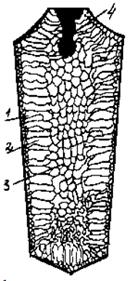 1 – зона мелких рав-
ноосных кристаллов;
2 – зона столбчатых
кристаллов;
3 – зона равноосных
кристаллов;
4 – усадочная ракови-
на.
1 – зона мелких рав-
ноосных кристаллов;
2 – зона столбчатых
кристаллов;
3 – зона равноосных
кристаллов;
4 – усадочная ракови-
на.
 2 – зона столбчатых
кристаллов;
4 – усадочная ракови-
на. Явление транскри-
сталлизации.
2 – зона столбчатых
кристаллов;
4 – усадочная ракови-
на. Явление транскри-
сталлизации.
 3 – зона равноосных
кристаллов;
4 – усадочная ракови-
на.
3 – зона равноосных
кристаллов;
4 – усадочная ракови-
на.
 ,где
,где , где:
, где:






