
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення органічної речовиниСодержание книги Поиск на нашем сайте
Основним забруднювачем водного середовища в інтенсивно експлуатованих ставках є органічна речовина, джерела надходження якої численні. Прямого методу визначення всієї органічної речовини немає. Її визначають непрямим методом і по фракціях. Для поточного контролю найбільш важливими і потребуючими постійного спостереження можна вважати БIIKi і агресивну окисляємість. Ці визначення дозволяють одержати досить повну інформацію про наявність легкоокисляємої хімічно і біологічно органічної речовини, що споживає значну кількість кисню на своє окислювання і тим самим граючу істотну роль у процесах формування кисневого режиму водойми. Загальна кількість органічної речовини визначають по біхроматній окисляємості. Перманганатна окисляємість становить близько 40 % усієї органічної речовини. Агресивна окисляємість За допомогою агресивної окисляємості визначають наявність у воді надлегкоокисляємої органічної речовини. Величина агресивної окисляємості до 40% свідчить про відносно чисту воду; 40-60% - про наявність органічного забруднення; 70-80% - про погрозу замору. Величина агресивної окисляємості 70% і вище свідчить не тільки про наявність заморної ситуації в ставках, але й дозволяє говорити про порушення балансу продукційно-деструкційних процесів. Для судження про зрушення процесів у ту або іншу сторону слід зазначити дані по рН, прозорості та кольоровості. Величина агресивної окисляємості 70-100%, рН 8,5 і вище, прозорість по диску 30-50 см і кольоровість 530-570 нм (зелений) свідчать про перевагу продукції над деструкцією. У цьому випадку за певних умов (безвітряна погода, високі значення температури в денний і нічний час) внаслідок вторинного забруднення можливе виникнення передзаморної ситуації. Значення агресивної окисляємості 60-100%, рН менше 8,0, прозорість 20-30 см, кольоровість 600-620 нм указують на явну перевагу деструкції над продукцією, що говорить про погрозу замору в найближчі троє діб. Величина агресивної окисляємості до 50% вказує на відносну чистоту водного середовища та збалансованість продукційно-деструкційних процесів. Хід аналізу. Якщо аналіз не може бути проведений протягом 2 год. після відбору проб, то пробу фіксують додатком 1 мл 15 %- ної Н2S04 на 250 мл води. У пробірку (об’ємом 20-25 мл) вносять 10 мл проби досліджуваної води, 1 мл 15 %- ного розчину сірчаної кислоти і 5 мл 0,01 н. розчину перманганату калію. Штатив із пробірками занурюють у каструлю-термостат з температурою води 55-66 °С, у якому пробірки витримують протягом 30 хв. Потім пробірки із пробами поміщають у холодну воду. Після охолодження проби фільтрують через складчастий фільтр у заздалегідь приготовлені пробірки. Готовлять холосту пробу, у яку вносять 10 мл дистильованої води і реактиви, як для досліджуваної проби. Із пробірки з холостою пробою відбирають 10 мл розчину і переносять у колбочку об’ємом 50 - 100 мл, потім додають 1 мл 10 %- ного KJ і титрують йод, що виділився, у присутності крохмалю 0,01 н. розчину гіпосульфіту, як при визначенні кисню. Так само відтитровують всі проби. Кількість гіпосульфіту, що іде на титрування холостої проби, приймається за 100% в аналізованому об’ємі перманганату калію. Різницю між кількістю гіпосульфіту, що йде на титрування холостої проби, і аналізованої визначає витрата перманганату калію, що витрачається на окислювання органічної речовини. Ця різниця, виражена у відсотках щодо холостої проби, приймається умовно як процентне вираження агресивної окисляємості. Приклад розрахунку. На холосту пробу пішло 5,6 мл гіпосульфіту; на пробу № 1 - 3,2 мл; на пробу № 2 - 0,8 мл. Визначаємо кількість перманганату калію, витраченого на окислювання органічної речовини: 1) 5, 6-3,2 = 2,4; 2) 5, 6-0,8 = 4,8; 5,6 становлять 100%, а 2,4 і 4,8 — відповідно х1 і х2 · xl = 42 %; х2 = 86 %. При повному зникненні забарвлення агресивна окисляємість приймається за 100 %. Визначення БПК1 Спостережувана в аеробних умовах, втрата розчиненого кисню за добу називається біохімічним споживанням кисню (БПК1). Кисень у цих умовах затрачається головним чином на окислювання нестійкої органічної речовини мікроорганізмами. Підготовка до аналізу. При визначенні БПК1 важливо, щоб вміст кисню в первинній або розведеній пробі протягом усього часу інкубації був достатнім для забезпечення нормальних умов протікання аеробних біохімічних процесів. Ці умови звичайно дотримуються, якщо концентрація кисню в склянці після інкубації буде не менше 2 мг/л. При вмісті кисню в досліджуваній воді менше 100% насичення пробу аерірують або струшують посудину з водою протягом декількох хвилин. Якщо БIIK1 перевищує 6 мг 02/л, то пробу необхідно розбавляти. У ставках БПК1 звичайно не перевищує цю величину, тому розведення не потрібно. Хід визначення. Досліджуваною водою, профільтрованою через щільний газ, заповнюють кисневі склянки за допомогою сифона. Трубку сифона опускають у склянку до дна і наповнюють її так, щоб пройшов подвійний об’єм води, витиснувши зі склянки все повітря. В одну зі склянок додають реактиви і визначають кисень по методу Вінклера. Інші склянки ставлять на інкубацію в темряву при температурі 20 °С, занурюючи у воду пробками вниз (2 склянки для БПК1 на одну добу). Після інкубації в склянках визначають кисень звичайним способом. Розрахунок. БПК1 визначають за формулою: Сa - Сb (мг02/л), де Са - концентрація кисню до інкубації; Cb, - концентрація кисню після інкубації. Біхроматна окисляємість Окислювання речовини відбувається біхроматом калію в присутності каталізатора Ag2SО4. Якщо концентрація хлорид-іонів перевищує 1 г/л, варто додати сульфат ртуті в кількості, що перевищує вміст хлорид-іонів в 22,5 рази. Одночасно варто ввести 5 мл концентрованої сірчаної кислоти для кращого розчинення сульфату ртуті. Хід визначення. Досліджувану воду, кількість мілілітрів якої розраховують так, щоб при окислюванні використовувалося не більше 50 % біхромату (20-50 мл), випарюють у сушильній шафі при 83—85 °С у колбах на 100 мл. У колби з випареною пробою додають на кінчику скальпеля каталізатор і моровскою піпеткою 10 мл 0,1 н. хромової суміші. Хромовій суміші дають стекти зі стінок піпетки ще одну хвилину, тому що суміш в’язка і стікає довго. Одночасно готують дві контрольні колби для обліку розкладання хромової суміші. У них вносять ті ж реактиви, але без досліджуваної речовини. Колби закривають пробками-холодильниками (для запобігання випаровування) і ставлять у сушильну шафу на 15 хв. для спалювання органічної речовини при температурі 132 - 140 °С (час зауважують після встановлення 137 °С). Вийняті колби охолоджують, доливають у кожну, обмиваючи пробки, по 15 мл дистильованої води, охолоджують і титрують сіллю Мору в присутності 3 крапель фенілантранілової кислоти до переходу забарвлення з вишневого в зелений. Розрахунок. Біхроматну окисляємість (X) визначають за формулою: Х=(a-b)8 1000 н/V, де а, b - розчин солі Мору, витрачений на холостий дослід і на титрування проби води, мл; 8 - еквівалент кисню; н - нормальність солі Мору; V - обсяг проби води, узятої на визначення, мл. Реактиви. 1.0,05 н. розчин солі Мору — 39,2 г солі Мору розчиняють у дистильованій воді, додають 20 мл концентрованої сірчаної кислоти і після охолодження доливають до 1 л дистильованою водою. Отриманий 0,1 н. розчин розбавляють у два рази. Нормальність розчину визначають по 0,1 н. розчину біхромату калію. Для цього до 5 мл 0,1 н. К2Сг2О7 додають 5 мл H2SО4, охолоджують, додають 3 краплі індикатора (фенілантранілової кислоти) і титрують сіллю Мору. н солі Мору = h1 V1/V2, де h1 - нормальність K2Cr2O7; V1 – об’єм К2Сг2О7, мл; V2 – об’єм солі Мору, мл. 2. Сірчана кислота H2SО4 x. ч., концентрована, прокип’ячена. 3. Сірчанокисле срібло х. ч. кристалами. 4. Розчин індикатора фенілантранілової кислоти - 0,107 г кислоти розчиняють в 100 мл 1 %- ного розчину соди (Na2CO3). Спочатку розмішують паличкою в малій кількості рідини, а потім додають всю кількість содового розчину. 5. Хромова суміш - для приготування 0,1 н. розчину зважують 4,903 г х. ч. К2Сг2О7, переносять в мірну колбу на 1 л кількісно в 10 - 20 мл дистильованої води ы довести до 1 л концентрованою сірчаною кислотою. 6. 0,1 н. розчин біхромату калію для визначення титру. Перманганатна окисляємість по Кубелю Окислювання проводять 0,01 н. розчином перманганату калію (КМп04) у сірчанокислому середовищі при кип’ятінні: О Правильні результати виходять при надлишку перманганату калію. Необхідно, щоб до кінця окислювання в пробі залишалося ще близько 40%КМnО4. Хід визначення. У конічну колбу на 250 мл вносять 10 - 50 мл досліджуваної води. Залежно від передбачуваного вмісту органічної речовини доводять об’єм до 10 мл бідистильованою водою, додають скляні капіляри, доливають 5 мл розведеної сірчаної кислоти і 10 мл 0,01 н. перманганату калію. Суміш нагрівають так, щоб вона закипіла через 5 хв., і кип’ятять рівно 10 хв. Якщо забарвлення розчину залишилося рожевим, то до нього додають 10 мл 0,01 н. розчину щавлевої кислоти. Знебарвлену ще гарячу суміш (80 -90 °С) титрують 0,01 н. розчином перманганату калію до слабо-рожевого забарвлення. Для введення поправки на бідистильованою воду, якою розбавляли, необхідно визначити її окисляємість так само, як і у випадку досліджуваної води. Розрахунок. Перманганатна окисляємість (мг О/л) визначається за формулою Х= [(а1 + а2)на- b.нb · 8 · 1000]/V, де a1 – a2 - кількість розчину перманганату, прибавленого на початку і в кінці визначення, мл; b - кількість доданої щавлевої кислоти, мл; на - нормальність перманганату калію; нb - нормальність щавлевої кислоти; V - обсяг проби. Якщо пробу досліджуваної води розбавляють для аналізу, то за тією ж формулою визначають окисляємість холостої проби, а потім розраховують поправку на воду, якою розбавляли. Наприклад, окисляємість холостої проби (С) мг О/л, а для розведеної проби брали 80 мл води. Поправка (К) буде дорівнювати, мг О/л К = С 80/100. Поправку віднімають від окисляємості проби. Реактиви. 1.0,1 н. перманганат калію (основний розчин) - 3,2 г перманганату калію розчиняють в 1 л дистильованої води. Розчин зберігають у темній склянці, придатний для використання через 15 - 20 діб після приготування. 2. Розчин 0,01 н. перманганату калію готують із основного розчину. Нормальність розчину визначають для кожної серії аналізу. Для цього у відтитровану ще теплу холосту пробу додають 10 мл 0,01 н. щавлевої кислоти і титрують перманганатом калію. нКМпО 3. 0,01 н. розчин щавлевої кислоти - 0,602 г (СООН2)2Н2О х. ч. розчиняють у мірній колбі на 1 л. 4. Сірчана кислота (1: 2).
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 228; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.135.231 (0.006 с.) |

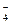 + 8Н+ + 5e = Мn+2 + 4Н2О.
+ 8Н+ + 5e = Мn+2 + 4Н2О.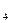 = 10 · 0,01/КМnO4.
= 10 · 0,01/КМnO4.


