Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические свойства спиртов.Содержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
I. По разрыву связи О - Н 1) реагируют с активными металлами (Na, K) с выделением водорода: 2СН3ОН + 2К ® 2СН3ОК + Н2 2) вступают в реакцию с карбоновыми кислотами с образованием сложных эфиров: О О // // СНз-С-ОН + НО-СНЗ ® СНз-С-О-СНЗ + Н20
II. По разрыву связи C - О при действии на спирты галогеноводородных кислот происходит замещение гидроксогруппы на галоген: СН3ОН + НСl® СН3С1 + Н20
III. По разрыву различных связей 1) в присутствии водоотнимающих веществ и при нагревании могут С2Н5-ОН®С2Н4 + Н20 СН3 -ОН + НО- СН3 ® СНз -О- СН3 + Н20 2) этанол горит на воздухе синеватым пламенем с образованием углекислого С2Н5ОН + ЗО2®2С02 + ЗН20 3) оксид меди (II) окисляет спирты до альдегидов: О // С3Н7ОН + СuО® С2Н5-С-Н + Сu + Н20 Пропанол пропаналь Качественной реакцией на глицерин является его реакция с гидроксидом меди (II), в результате которой образуется ярко-синий раствор глицерата меди (II). Порядок выполнения работы Оборудование и реактивы: фарфоровая чашка для сжигания; спиртовка; пробирки; медная проволока; этиловыйспирт; глицерин; металлический натрий; раствор сульфата меди (II); раствор гидроксида натрия. Опыт №1. Горение этанола. В фарфоровую чашку налить немного спирта и осторожно поднести горящую спичку. Запишите наблюдения: ________________________________________________________________________ Составьте уравнение реакции: _______________________________________________________________________ Вывод:__________________________________________________________________________________________________________________________________________ Опыт №2.Взаимодействие этанола с натрием. Налить в пробирку 1 мл этилового спирта и осторожно бросить в него Составьте уравнение реакции_____________________________________ Вывод:___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Опыт №3. Окисление этилового спирта оксидом меди (II). Налить в пробирку 1-2 мл этилового спирта и погрузить в него раскаленную Вывод: ________________________________________________________________________________________________________________________________________________________________________________________________________________________ Опыт №4.Растворение глицерина в воде. Налейте в пробирку 1-2 мл глицерина и прилейте столько же воды, пробирку встряхните. Запишите наблюдения___________________________________________ Вывод: ________________________________________________________________________________________________________________________________________________________________________________________________________________________ Опыт №5.Взаимодействие глицерина с гидроксидом меди (II). В пробирку налейте 1 мл 10%-ного раствора сульфата меди (II) и добавьте несколько капель 10%-ного раствора гидроксида натрия до образования голубого осадка гидроксида меди (II). К полученному осадку прилейте по каплям глицерин. Смесь взболтайте. Запишите наблюдения: ________________________________________________________________________________________________________________________________________________Вывод: ________________________________________________________________________________________________________________________________________________ Контрольные вопросы 1. Какие органические вещества называются спиртами? 2. Какие спирты называются одноатомными? 3. Какие спирты называются многоатомными? 4. В чем состоит сходство одноатомных и многоатомных спиртов? 5. В чем причина хорошей растворимости спиртов? 6. При помощи какой реакции, можно отличить одноатомные спирты от многоатомных? Литература Ю.М. Ерохин «Химия» Москва 2003г глава 24 стр. 307
Лабораторная работа №8 «Получение и свойства карбоновых кислот» Цель: изучение свойств карбоновых кислот на примере уксусной кислоты. Теория Карбоновыми кислотами называются органические вещества, молекулы которых содержат одну или несколько карбоксильных групп -СООН, соединенных с углеводородным радикалом: RСООН. Среди кислот нет газообразных веществ, низшие представители ряда - это жидкости с острым запахом, хорошо растворимые в воде. С повышением молекулярной массы растворимость их в воде понижается. Все карбоновые кислоты обладают кислотными свойствами и при диссоциации образуют ионы водорода. Кислотные свойства карбоновых кислот выражены сильнее, чем у спиртов, но по сравнению с сильными неорганическими кислотами - это слабые кислоты (кроме муравьиной кислоты). Химические свойства карбоновых кислот 1. Кислоты хорошо растворяются в воде, имеют характерный кислый вкус, RСООН® RСООН-+ Н+ 2. Кислоты реагируют с активными металлами с образованием соли и 2RСООН+ Са ® (RСОО)2Са + Н2 2RСОО-+ 2Н+ + Са0 ® 2RСОО- + Са2+ + Н2 2Н+ + Са0 ® Са2+ + Н2 3. Кислоты реагируют с оксидами металлов с образованием соли и воды: 2RСООН+ СаО ® (НСОО)2Са + Н20 2RСОO-+2Н+ + СаO ®2RСОО- + Са2+ + Н20 2Н+ + СаО ® Са2+ + Н20 4. Кислоты реагируют с основаниями с образованием соли и воды: RСООН + KOH®RCOOK+ H2O RСООН + Н+ + К+ + ОН -®RСОО -+ К+ + ОН - + Н2О Н+ + ОН - ® Н2О 5. Кислоты реагируют с солями более слабых и летучих кислот: 2RСООН + К2С03 ®2RCOOK + Н20 + С02 2RCOO + 2Н+ + 2К+ + С032- ®2RCOO- + 2К+ + Н20 + С02 2Н+ + CO32- ® Н20 + С02 6. Кислоты реагируют со спиртами с образованием сложных эфиров: НСООН + НО-СНз ® НСОО-СНз + Н2O метиловый эфир метановой кислот
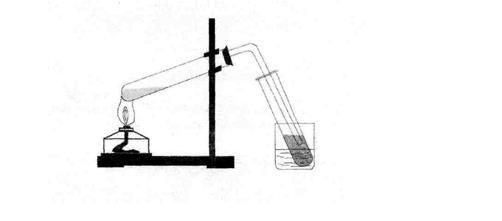
Название солей карбоновых кислот 1.Остаток муравьиной кислоты НСОО – - формиат (например, НСООК формиат калия) 2. Остаток уксусной кислоты СН3СОО – - ацетат (например, СН3СООК ацетат калия). Порядок выполнения работы Оборудование и реактивы: лабораторный штатив; штатив с пробирками; спиртовка; газоотводная трубка; ацетат натрия; концентрированная серная кислота; магний; карбонат кальция (мел); раствор лакмуса. Опыт 1. Получение уксусной кислоты. Соберите прибор для получения уксусной кислоты как показано на рисунке.
Поместите в пробирку 3-5 г ацетата натрия и прибавьте немного концентрированной серной кислоты. Пробирку закройте пробкой с газоотводной трубкой, свободный конец которой опустить в пустую пробирку, находящуюся в стакане с холодной водой. Нагрейте смесь до тех пор, пока в пробирке - приемнике не соберется немного уксусной кислоты. Полученную уксусную кислоту сохранить до следующего опыта. Запишите наблюдения ________________________________________________________________________________________________________________________________________________ Напишите уравнение реакции взаимодействия ацетата натрия с серной кислотой:________________________________________________________________ В ы вод: ________________________________________________________________________________________________________________________________________________
|
||||
|
Последнее изменение этой страницы: 2016-04-18; просмотров: 695; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.245.152 (0.007 с.) |